Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Методы учета болезней сельскохозяйственных культурСодержание книги
Поиск на нашем сайте
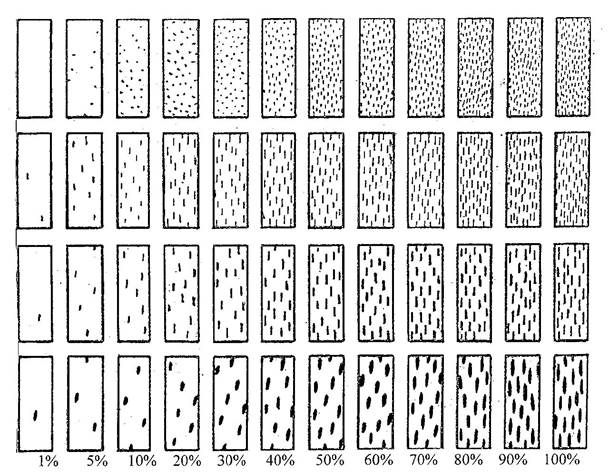
МЕТОДЫ УЧЕТА БОЛЕЗНЕЙ СЕЛЬСКОХОЗЯЙСТВЕННЫХ КУЛЬТУР Учеты распространенности и развития болезней осуществляют наблюдениями на стационарных участках и маршрутными обследованиями. Элементы учетов рассчитываются по формулам: P = (n × 100): N (1); R = (∑ а ×b) × 100: N × K (2); или R = (∑а ×с): N (3)), где Р – распространенность болезни, %. R – развитие болезни, %. n – количество больных растений (стеблей, листьев, плодов) в пробе, штук. N – общее количество больных и здоровых растений (стеблей, листьев, плодов) в пробе, штук. ∑а × b – сумма произведений числа больных растений (а) на соответствующий им балл поражения (b), штук × балл. К – высший балл учетной шкалы. К= 4. ∑а × с – сумма произведений числа больных растений (а) на соответствующий им % поражения (с), штук × %. Результаты учета записываются по соответствующим формам (табл.13,14 15). Методы учета болезней зерновых культур Головня. Учет пораженности посевов озимой и яровой пшеницы, озимой ржи, ячменя, овса пыльной и твердой головней проводят по апробационному снопу, отобранному в 100 местах диагонали поля (1500 стеблей). На семеноводческих посевах отбирают 2 апробационных снопа по двум диагоналям поля. Распространенность болезни определяют по формуле (1). Недобор урожая зерна пшеницы, ржи, ячменя, овса от твердой, пыльной и черной головни складывается из явных и скрытых потерь. Такая оценка при пораженности головней до 1,25% может быть сделана по формулам (Чумаков,1962): У = 11,0х – 4,4х² - для яровых и У = 20,0 – 8,0х²- для озимых. При более высоком проценте поражения применяют формулы: У = 5,89 + 0,79х – для яровых и У = 11,55 + 0,76х – для озимых культур, где У – общий недобор урожая зерна, %; х – степень проявления головни в посеве. При поражении яровых хлебов на 30% и выше и озимых - на 50% и выше скрытые потери, как правило, отсутствуют. В таких случаях процент недобора зерна будет соответствовать проценту распространенности болезни в поле. Учеты проводятся у пшеницы, ржи, ячменя, овса в конце молочной – начале восковой спелости зерна, у проса – после появления окраски цветковых пленок в верхней части метелок, у сорго – в начале полной спелости семян основной массы растений. Посевы выбраковываются из числа семенных, если пораженность пшеницы пыльной головней (по главным стеблям) превышает 0,5%, твердой – 0,3%, в сумме пыльной и твердой головней – более 0,5%, ячменя – пыльной головней (по стеблям) превышает 0,5%, твердой головней – 0,5%, овса – твердой и пыльной головней (по стеблям) – 0,5%, ржи – твердой и пыльной головней (по стеблям) – 0,5%. Корневая гниль пшеницы и ячменя. Распространенность и развитие корневой гнили учитывается трижды за вегетационный период: в фазах кущения, колошения и восковой спелости, для чего проводят маршрутное обследование посевов культур. Для анализа на каждом поле в 100 местах выкапывают 1000 – 1500 растений, а в полевых опытах по 100 растений с делянок площадью 100 м² (в 10 местах по 10 растений). Распространенность болезни – это количество больных растений, выраженное в процентах от общего количества учтенных растений. Вычисляют эту величину по формуле (1). Интенсивность поражения (развитие или индекс развития болезни) служит качественным показателем болезни и определяется по формуле 2; ее определяют по условной шкале (рис.12) и выражают в баллах или в процентах: 0 – отсутствие признаков болезни; 1 балл – слабое побурение колеоптиля, гипокотиля и корней; 2 балла – сильное побурение гипокотиля с точечными некрозами, переходящие на узел кущения и основание стебля, угнетение развития продуктивных стеблей; 3 балла – сильное побурение гипокотиля с обширными некрозами (трухлявость), побурение узла кущения и основания стебля, резкое снижение продуктивности; 4 балла – гибель или пустоколосость растений. При определении интенсивности поражения растений в процентах 1 балл соответствует интенсивности проявления болезни в 25%, 2 балла – 50%, 3 балла – 75%, 4 балла – 100%. Вредоносность корневой гнили определяют методом перерасчета (Михайлина, 1983), когда по урожаю здоровых растений определяют возможный урожай, затем вычисляют из него фактический урожай и получают потери, которые можно выразить как в ц/га, так и в процентах. Определяют также коэффициент вредоносности по известной формуле: К = (а – b) × 100: а, где а – урожай здорового растения; b – урожай больного растения; К – коэффициент вредоносности, %. Потери урожая вычисляют по формуле: П – (а ×К): 100, где П – потери урожая, %; а – пораженность растений, %; К – коэффициент вредоносности. Бурая, желтая и стеблевая ржавчина. Равномерно по диагонали поля отбирается 20 проб (по 10 стеблей). Интенсивность поражения листьев или стеблей определяют по процентной шкале Р.Ф. Петерсона и др. (1948), (рис.11). Осмотр растений при учете бурой и желтой ржавчины начинают с флагового листа. При учете листьев, усохшие более чем на ¾, во внимание не принимаются. При учете стеблевой ржавчины осматривают стебли растений. Учеты проводят четырежды в фазы: выход в трубку, конец колошения, налив – молочная спелость, начало восковой спелости. Форма записи учета (табл.15). Развитие болезни рассчитывают по формуле (3). Экономический порог вредоносности бурой, желтой, стеблевой ржавчины в начале вегетации – 3 – 5% распространенности болезни. Развитие болезни: линейная ржавчина – 15% в фазу полной спелости, желтая – 30% в фазу цветения и бурая – 40% в фазу молочной спелости зерна при ожидаемой урожайности 20 ц/га. Недобор урожая зерна пшеницы в % определяют по шкале К.М. Степанова и А.Е. Чумакова (1972), таблица 11. 11. Недобор урожая пшеницы (в %) от поражения ржавчиной в различные фазы (М.К. Степанов, А.Е. Чумаков, 1972)
Мучнистая роса. Учет мучнистой росы ведут по 200 растениям, отобранным в 10 местах. Определяют распространенность (формула 1) и развитие болезни (формула 3). Степень поражения пшеницы, ржи, ячменя и других злаков определяют с помощью иллюстрационной шкалы (рис. 10) в процентах. Обследование проводят начиная с фазы кущения до молочной спелости зерна с интервалом 10 дней. Форма записи учета (табл.15). Осматривают по три листа главного стебля, начиная сверху. Листья, усохшие более чем на 75%, не берут во внимание при вычислении средней пораженности растения. Примерные потери зерна яровой пшеницы от мучнистой росы в богарных условиях можно определить по уравнению Т.И. Захаровой (1981) в процентах: У = 0,34х + 3,79, где У – недобор урожая; х – максимальное развитие болезни после колошения. Экономический порог вредоносности мучнистой росы считается развитие болезни в фазу выхода в трубку – 5 – 13%, конец трубкования – 10 – 15%. Септориоз, гельминтоспориозные пятнистости ячменя (темно - бурая, полосатая, сетчатая). Учет заболеваний проводится на 200 растениях отобранных в 10 местах по диагонали поля. Развитие болезней определяют по формуле (2) в процентах, используя для этих целей иллюстрационные шкалы (рис. 9,10,12): 0 – признаки болезни отсутствуют, 1 балл – поражено до 10% поверхности органа, 2 – поражено 11 – 25%, 3 – поражено 25 – 50%, 4 - свыше 50% поверхности. В таблице 12 показаны критические уровни поражаемости растений восприимчивых сортов пшеницы, ячменя, ржи септориозом. 12. Критические уровни поражаемости септориозом (по Г.В. Пыжиковой, Г.Ю. Тушинскому, 1985)
Методы учета болезней зернобобовых культур И многолетних бобовых трав Корневая гниль гороха. В 10 местах поля выкапывают по 15 растений (всего 150 растений). Растения связывают в снопики по каждой пробе отдельно. Учет развития корневой гнили проводят по 4 – х балльной шкале: 0 – поражение отсутствует; 1 балл – слабое побурение, почернение корневой шейки или основания стебля; 2 – заметное побурение и почернение корневой шейки и основания стебля, загнивание стержневых и боковых корней; 3 – сильное побурение и и загнивание основных стеблей, пораженная ткань покрыта белым, серым или бурым налетом, растения легко выдергиваются из почвы; 4 – погибшие растения. Учеты проводят трижды в фазы: всходы (2 – 3 настоящих листа), цветение и созревание семян. Результаты учета записывают по форме (табл.14). Развитие болезни определяют по формуле (2). А Б
Рис.10.А – интенсивность развития мучнистой росы злаков; Б - интенсивность развития септороиоза на колосе (W.C. James, 1971).
Рис.12. Шкала оценки степени поражения злаковых видами корневой гнили (А) и фузариозного поражения колоса (Б), в баллах. Баллы: 1 – поражено до 25% поверхности органа; 2 – поражено 26-50%; 3 - поражено 51-75%; 4 - поражено свыше 75% поверхности (А.Е.Чумаков, Т.И. Захарова, 1990)
Глава 7 Макроскопический метод Отбор проб семян на зараженность проводится по ГОСТ 12036 - 85; выделение навесок по ГОСТ 12037 - 81. Метод применяют для визуального обнаружения в семенах головневых образований, склероциев спорыньи и других грибов, а также галлов пшеничной нематоды. Анализ проводят одновременно с определением чистоты семян по ГОСТ 12037 - 81. Метод отпечатков Метод применяют вместо центрифугирования для определения поверхностей заспоренности семян зерновых культур головневыми грибами. Из семян основной культуры отсчитывают 10 семян. Каждое семя обертывают отрезком прозрачной клейкой ленты размером 1 см2, плотно прижимая его по всей поверхности семени. Затем с помощью пинцета ленту отклеивают и помещают на предметном стекле под микроскоп для идентификации патогена и подсчета спор. Подсчет спор проводят в 10 полях микроскопа в соприкасавшихся с семенем частях отрезка ленты и устанавливают среднеарифметическое количество спор в одном поле зрения микроскопа. Для пшеницы и ячменя с помощью окуляр-линейки под микроскопом при однократном увеличении объектива измеряют длину и ширину семени с точностью до 0,1 мкм.
Рис.13. 1 – колос ржи, пораженный спорыньей; рожки спорыньи: 2 - ржи; 3 – пшеницы; 4 – ячменя; 5 - злаковых трав; 6 - склероции белой и серой гнили; 7 – здоровое семя клевера; 8 – склероции рака клевера; 9 – склероции тифуля.
Рис.14. Головня злаков: 1 – здоровое зерно пшеницы; 2 – головневый мешочек (зерно пшеницы, пораженное твердой головней); 3 – здоровое зерно ржи; 4 - головневый мешочек (зерно ржи, пораженное твердой головней ржи); 5 - здоровое зерно ячменя: 6, 7, 8 - головневые комочки (колоски и зерновки ячменя, пораженные твердой головней ячменя); 9 – здоровое семя овса; 10 – семя овса, пораженное твердой головней; 11 – здоровое семя сорго; 12 – семя сорго, пораженное твердой головней.
На основании данных измерения длины и ширины определяют площадь поверхности семени. Для семян других зерновых культур площадь поверхности семени измеряют наложением отпечатка на миллиметровую бумагу или посредством окулярной сетки микроскопа. 7.4. Метод анализа зародышей (эмбрионов) Метод применяют для обнаружения мицелия пыльной головни (Ustilago sp.) в эмбрионах семян пшеницы и ячменя, отделенных от эндосперма. Для анализа используют семена основной культуры, выделенные из навески массой 100 г для пшеницы и 120 г для ячменя. Перед отделением зародышей (эмбрионов) семена ячменя для отделения пленок помещают на 40 мин в 50 %-ный раствор серной кислоты. (Концентрированную химически чистую кислоту разбавляют вдвое, наливая кислоту в воду). Затем семена тщательно перемешивают, промывают проточной водой, а остатки пленок оттирают на решете капроновой щеткой. Эмбрионы семян пшеницы и ячменя отделяют от эндосперма двумя способами. Второй способ. Семена помещают в эмалированную или стеклянную посуду, заливают 3 %-ным раствором щелочи и кипятят около 1 ч до полного отделения зародышей от эндосперма. Затем содержимое из посуды пропускают через набор лабораторных решет с диаметром отверстий 5, 3 и 1 мм с последующей промывкой их проточной водой. Зародыши, оставшиеся на последнем решете, переносят в колбу вместимостью 250 см3 и кипятят 40 мин в 15-20 %-ном растворе щелочи, взятой в количестве 200 см3, после чего их тщательно отмывают от щелочи. Отмытые зародыши помещают в стеклянный бюкс или колбу, где налито небольшое количество раствора анилинового синего или трипанового синего красителя в концентрации 0,1 %, доводят до кипения на электроплитке или спиртовке и кипятят в течение 10-20 с. При работе с химикатами следует соблюдать меры предосторожности. Потеря зародышей после всех операций не должна превышать 20 %. Зародыши можно хранить в 50 %-ном водном растворе глицерина. После кипячения каждый зародыш просматривают под микроскопом или бинокулярной лупой при увеличении (12х-15х). В поле зрения должен быть виден один зародыш. Покровным стеклом зародыш накрывать не следует.
Рис.15. Устоспоры головневых грибов (К.В. Попкова, 1988): Tilletia caries; 2 – T. foetida; 3 – T. controversa; 4 – Telletia indica; 5 – Urocystis tritici; 6 – Ustilago tritici; 7 – Urocystis occulta; 8 – Ustilago hordei; 9 – Ustilago nuda; 10 – Ustilago zeae; 11 – U. avena; 12 – U. levis; 13 – Sphacelotheca panici-miliacei Зародыши располагают в рядки, очерченные восковым карандашом, с помощью препаровальных игл или небольшого скальпеля, и просматривают под микроскопом на предметном стекле или в чашках Петри. Зародыши необходимо просматривать в основном со стороны зародышевой почки, корешков и колеоптиля, где может располагаться мицелий, и со стороны щитка. Грибница головни при малом увеличении микроскопа представляет собой комочки спутанных гифов мицелия. Гифы окрашены в сине-голубой цвет, имеют толщину 3 мкм. Встречаются редкие случаи, когда в ткани щитка находятся другие грибы помимо головни, но они имеют другое строение и ясно различимы. Подсчитывают все инфицированные зародыши независимо от места локализации мицелия в органах эмбриона и вычисляют их содержание в процентах к числу просмотренных зародышей. Биологический метод Метод применяют для выявления внешней и внутренней зараженности семян болезнями. Он основан на стимуляции развития и роста микроорганизмов в зараженных семенах. Зараженность семян определяют при проращивании их во влажной камере, на питательных средах, песке или в рулонах фильтровальной бумаги. F. avenaceum; 2 – F. solani; F. culmorum; F. gibbosum; F. sporotrichialla; F. oxysporum; F. semitectum; F. graminearum; F. sambusinum; F. moniliforme; F. javanicum; а – макроконидии; б – микроконидии; в – хламидоспоры; г – перитеций; д – сумка с сумкоспора
Рис.17. Спороношение сапротрофных грибов: Alternaria tenuis; 2 – Penicillium glaucum; 3 – Aspergillus glaucus; 4 – Cladosporium herbarum; 5 - Epicoccum sp.; 6 – Mucor sp.; 7 – Rhyzopus nigricans; 8 – Trichotecium roseum; 9 – Cechalosporium acremonium; 10 – Macrosporium sp.; 11 – Stachybotris sp.
Рис.18. Спороношение грибов рода Drechslera: Phoma betae (пикнида со спорами); 2 – Uromyces betae (а – урединиоспоры, б – телиоспоры); 3 – Cercospora beticola (конидиеносцы с конидиями); 4 – Peronospora schachtii (конидиеносец с конидиями); 5 – Erysiphe communis (а – конидиеносцы с конидиями, б – клейстотеций, в – сумка с сумкоспорами). Семена промывают струей воды под водопроводным краном в течение 1-2 ч и дезинфицируют 1 %-ным раствором марганцовокислого калия или 0,1 %-ным раствором азотнокислого серебра, или 96 %-ным спиртом в течение 1-2 мин. Затем семена промывают в стерильной или прокипяченной воде и просушивают между листами стерильной фильтровальной бумаги. Семена помещают в чашки Петри по 10-25 шт. в зависимости от культуры и ставят их для проращивания в термостат при температуре 22-25 °С. Проращивание семян проводят в течение срока, указанного для определения всхожести семян по ГОСТ 12038 - 84. Для контроля правильности определения болезней при просмотре семян небольшую часть развившейся колонии исследуют в капле воды под микроскопом.
Рис.21. Возбудители болезней на семенах овощных культур: 1 - Colletotrichum lagenarium на тыквенных (видны щетинки, конидиеносцы и конидии); 2 - Alternaria brassicae (конидии гриба); 3 – Alternaria oleraceae (конидии); 4 – Alternaria rodicina (конидии). Анализ семян пшеницы и ржи Для анализа берут четыре рабочие пробы по 100 семян, не дезинфицируя их. Зараженность семян пшеницы и ржи фузариозом, темно-бурым гельминтоспориозом, альтернариозом определяют, проращивая семена в рулонах из фильтровальной бумаги или на питательных средах. Анализ семян ячменя и овса Анализ проводят путем проращивания семян во влажной камере на свету и в темноте, где определяют зараженность семян ячменя полосатой и сетчатой пятнистостью, овса - красно-бурой пятнистостью. Зараженность семян ячменя и овса темно-бурым гельминтоспориозом (Bipolaris sorokiniana) определяют, проращивая семена в рулонах из фильтровальной бумаги. Для анализа используют четыре рабочие пробы по 50 семян без дезинфекции. Семена предварительно замачивают в воде комнатной температуры в течение 3 ч и раскладывают бороздкой кверху на стекло или керамические плитки, обернутые фильтровальной бумагой. Стекло или плитки помещают в растильни и наливают воду, следя за тем, чтобы вода не смыла семена (можно использовать обычные строительные керамические плитки без ячеек). Во время инкубации воду подливают, не допуская подсыхания бумаги и семян. Инкубацию проводят в течение первых 2 суток при освещении лампами дневного света ЛД-40 или ЛБ-40 при температуре 22-25 "С. Возбудители полосатой пятнистости ячменя и красно-бурой пятностости овса образуют спороношение только при инкубации семян в открытых растильнях (не накрытых стеклом). Для идентификации возбудителей сетчатой пятнистости две растильни с семенами каждой пробы ячменя закрывают стеклом, две оставляют открытыми. Возбудитель сетчатой пятнистости образует спороношение в том и другом случае. Последующую инкубацию (в течение суток) проводят в темноте, в закрытых растильнях при температуре 12-16 "С (в холодильнике). В этих условиях хорошо формируется конидиальное спороношение патогенов. Просмотр семян проводят на 4-е сутки со дня закладки во влажную камеру. Зараженные семена просматривают под микроскопом типа МБС при 24-кратном увеличении. Семена вместе со стеклом (плиткой) переносят под микроскоп. Около зараженных семян делают отметку на бумаге цветным карандашом или фломастером, а затем подсчитывают число отметок. Одновременно подсчитывают число семян, пораженных темно-бурым гельминтоспориозом, который также может проявиться при анализе этим методом. Анализ семян кукурузы Зараженность семян кукурузы красной гнилью, бактериозом, белью и нигроспорозом выявляют внешним осмотром семян, при необходимости микроскопируя грибницу. Для этого навеску семян массой 200 г, предназначенную для анализа на зараженность, просматривают и выделяют семена с явными признаками зараженности болезнями. Анализ семян гороха (Ascochyta pisi Lib.; Ascochyta рinodes (Berk. Et Bl.) L.K. Jones; Fusarium sp.; Alternaria sp.; Хanthomonas sp.)(рисунок 19). Определяют зараженность семян гороха аскохитозом, фузариозом, альтернариозом, бактериозом, проращивая их на гофрированной фильтровальной бумаге. Из семян основной культуры отбирают четыре рабочие пробы по 50 семян. Фильтровальную бумагу режут на полоски шириной 120 мм и длиной 1000—1050 мм. Полоски бумаги, сложенные по две, гофрируют, то есть складывают гармошкой с высотой одного зубца (20±1) мм. Таких зубцов на полоске длиной 1000 мм должно получиться (25+2) шт. Гофрированную бумагу обмакивают в свежекипяченую воду, дают воде стечь и укладывают в растильню. Проводят предварительную поверхностную дезинфекцию семян 0,5 %-ным марганцовокислым калием в течение 5 мин, затем промывают стерильной водой и раскладывают в гофрированную бумагу. В каждую складку помещают по два семени. Растильни с семенами ставят в термостат при температуре 22-25 °С. На шестые сутки проводят просмотр семян. Признаки бактериоза: на семенах появляется эксудат желтого цвета. Признаки альтернариоза: на семенах образуется бархатистый войлок темно-серого цвета, состоящий из конидий гриба. На семенах, пораженных аскохитозом, образуется белый пушистый мицелий, иногда наблюдается загнивание ростка, при сильном поражении семена не прорастают. Семена, пораженные фузариозом, покрыты хорошо развитым пушистым белым или розово-белым мицелием, с тонкими серповидно-удлиненными конидиями. Для уточнения вида гриба проводят микроскопирование. Просмотр (не открывая чашки) проводят по колониям на 5-7-е сутки. Признаки заболевания. Мицелий гриба обычно развивается на 5-е сутки после раскладки семян в чашки Петри. Он вначале ярко-белый, затем постепенно утрачивает яркость и со временем (примерно на 10-15-е сутки со дня посева) становится грязно-кремово-желтым, уплотненным. Чашки, в которых (на 5-7-е сутки) обнаружен мицелий, нужно выставить на свет при комнатной температуре (около 20 °С). На свету на 10-14-е сутки со дня высева на мицелии образуются пикниды гриба в виде мелких черных точек. Иногда пикниды лучше просматриваются со дна чашки. Для установления точного диагноза пикниды просматривают под микроскопом при малом увеличении. Под микроскопом будет видна темная пикнида с массой выходящих из нее мелких спор. Анализ семян подсолнечника Зараженность семян белой и серой гнилью определяют при проращивании их в рулонах фильтровальной бумаги, помещенных в стеклянные сосуды. Из семян основной культуры отбирают четыре рабочие пробы по 50 семян. Перед закладкой в рулоны семена промывают под струей воды в течение 20—30 мин, затем дезинфицируют 1 %-ным раствором марганцовокислого калия в течение 10—15 мин. После дезинфекции семена тщательно промывают стерилизованной или свежекипяченой водой. Для проращивания используют полоски фильтровальной бумаги размером 73x20 см, смоченные стерильной водой до полной влагоемкости (избытку воды дают стечь). Семена каждой пробы раскладывают острым концом книзу на полоску бумаги, отступая от верхнего края на 2 см. Затем ее накрывают второй смоченной полоской фильтровальной бумаги, коррексом и сворачивают в рулон. Рулон помещают в стеклянный сосуд. Для поддержания рулонов во влажном состоянии сосуд закрывают сверху стеклянной пластинкой, оставляя зазор для доступа воздуха. Сосуды с рулонами помещают в термостат при температуре 22-23 0 С. Просмотр семян проводят на 10-е сутки. При необходимости просмотр повторяют на 14-е сутки. Для контроля правильности определения возбудителя серой гнили небольшую часть развившейся колонии со спороношением исследуют в капле воды под микроскопом (рисунок 22). МЕТОДЫ УЧЕТА БОЛЕЗНЕЙ СЕЛЬСКОХОЗЯЙСТВЕННЫХ КУЛЬТУР Учеты распространенности и развития болезней осуществляют наблюдениями на стационарных участках и маршрутными обследованиями. Элементы учетов рассчитываются по формулам: P = (n × 100): N (1); R = (∑ а ×b) × 100: N × K (2); или R = (∑а ×с): N (3)), где Р – распространенность болезни, %. R – развитие болезни, %. n – количество больных растений (стеблей, листьев, плодов) в пробе, штук. N – общее количество больных и здоровых растений (стеблей, листьев, плодов) в пробе, штук. ∑а × b – сумма произведений числа больных растений (а) на соответствующий им балл поражения (b), штук × балл. К – высший балл учетной шкалы. К= 4. ∑а × с – сумма произведений числа больных растений (а) на соответствующий им % поражения (с), штук × %. Результаты учета записываются по соответствующим формам (табл.13,14 15).
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2016-04-26; просмотров: 5031; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.12.147.12 (0.011 с.) |