
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Завдання 2. Визначити у представлених зразках харчових продуктів масову частку цукрів методом Бертрана, оформити отримані результати дослідження, зробити висновок про якість досліджуваного продукту.Содержание книги
Поиск на нашем сайте
Метод Бертрана оснований на здатності редукуючих цукрів, які мають вільну карбонільну групу, відновлювати у лужному розчині оксид міді (II) до оксиду міді (I). У даному методі окислювачами виступають розчини Фелінга (Фелінг№1 – розчин сірчанокислої міді і Фелінг №2 – лужний розчин сегнетової солі). При проведенні аналізу змішують рівну кількість Ф-1 і Ф-2 і досліджуваний розчин цукру, кип’ятять певний час. При цьому одразу утворюється синій осад гідроксиду міді (II):
Осад швидко зникає, тому що утворюється комплексна сполука міді з сегнетовою сіллю, і рідина набуває темно-синій колір.
COONa COONa
COOK COOK
COOK COOK Оксид міді (II) реагуючи з цукром, відновлюється до оксиду міді (I), а цукор окислюється до відповідної кислоти.
H OH
Кількість цегляно-червоного оксиду міді (I) еквівалентна кількості цукру, який окислився. Таким чином, про кількість цукру, що знаходився у розчині, судять по кількості оксиду міді (I), що утворився внаслідок окислювально-відновної реакції. Кількість оксиду міді (I) визначають методом редоксиметрії. Для визначення кількості утвореного оксиду міді (I), його окислюють розчином Фелінга №3 (розчин сульфату заліза (III) у присутності сірчаної кислоти), внаслідок чого утворюється еквівалентна кількість сульфату заліза (II), яку потім відтитровують перманганатом калію: Cu 10Fe SO За кількістю розчину перманганату калію, що пішло на титрування, розраховують масову частку міді у взятій пробі, мг. За емпірично складеною таблицею знаходять масову частку цукру в досліджуваній пробі, що відповідає знайденій міді (дод.4) Хід роботи. У конічну колбу місткістю 150 мл наливають мірним циліндром 20 мл рідини Фелінга №1 та 20 мл рідини Фелінга №2. Розчини перемішують. В цю ж саму колбу вносять піпеткою 20 мл розчину А (або Б). Вміст колби перемішують, колбу становлять на електроплитку. Рідину нагрівають до кипіння і кип’ятять 3 хв з моменту появи перших бульбашок на її поверхні. Після закінчення кип’ятіння колбу знімають з нагрівального приладу і дають можливість утвореному цегляно-червоному осаду оксиду міді (I) осісти (2-3 хв).
Необхідно стежити за тим, щоб розчин над осадом був синього кольору. Якщо під час кип’ятіння рідина утратить синє забарвлення, дослід необхідно повторити з попередньо розбавленими дистильованою водою розчинами А і Б у співвідношенні 1:1. Об’єми досліджуваних розчинів залишають по 20 мл. Синю рідину над осадом обережно декантують (зливають) по скляній паличці на паперовий фільтр, який вставляють у воронку. Після декантації синьої рідини осад у колбі промивають 3-4 рази невеликими порціями гарячої дистильованої води, зливаючи щоразу воду на фільтр. Безбарвна рідина над осадом і відсутність у неї лужної реакції свідчить, що в осаді нема рідини Фелінга №2. Необхідно уникати попадання на фільтр осаду і слідкувати за тим, щоб осад у колбі і на фільтрі знаходився під шаром гарячої води, в протилежному випадку оксид міді (I) під дією кисню повітря перейде в оксид міді (II), який не розчиняється у рідині Фелінга №3. Промитий осад оксиду міді (I) розчиняють рідиною Фелінга №3. Для цього відміряють циліндром 15- 20 мл рідини Фелінга №3. Половинну цієї рідини наливають у колбу з промитим осадом міді, який розчиняється. Потім воронку з фільтром, частково заповненим промивною рідиною, переносять у колбу з розчиненим осадом міді. На фільтр виливають другу половину відміряної рідини Фелінга №3. Всі частинки оксиду міді (I), що є на фільтрі, при похитуванні воронки повинні розчинитися. Після закінчення фільтрування фільтрат наповнюють 1-2 рази холодною дистильованою водою; фільтрат збирають к колбу з розчиненим осадом міді. Отриману зеленувату рідину титрують розчином перманганату калію до появи блідо-рожевого забарвлення всього об’єму рідини, яку титрують. Для визначення масової частки редукуючих цукрів у взятій пробі кількість перманганату калію, що пішло на титрування розчину, помножують на титр розчину перманганату по міді. Таким чином знаходять масу міді, що відновлена редукуючими цукрами (мг). Наприклад: на титрування сірчанокислого заліза витрачено 4,1 мл перманганату калію, титр KMnO Беремо найближчі табличні значення, між якими знаходиться розраховане число. В нашому прикладі це 40,4 мг і 42,3 мг, які відповідають 20 і 21 мг рекукуючих цукрів. Далі розраховуємо так: 1 мг редукуючих цукрів (21-20) відповідає 1,9мг (42,3-40,4) міді. Якій кількості редукуючих цукрів (Х) буде відповідати 0,8 мг (41,2-40,4) міді, тобто одержуємо пропорцію: 1 мг – 1,9 мг Х мг – 0,8 мг Значить 41,2 мг міді буде відповідати 20,44 мг (20+0,44) редукуючих цукрів або 0,02044г. Масову частку редукуючих цукрів визначають за формулою, %: W = де a – маса цукру у витяжці, яка знайдена з таблиці, г; V, V m – маса наважки, г. Вміст цукрів розраховують з точністю до 0,1%. Масову частку цукрози вираховують за формулою, %: S = (I д е I
Оформлення результатів дослідження. Результати аналізів заносять до табл.1, 2. На основі отриманих результатів роблять висновок про харчову цінність продукту, відповідність масової частки загального та інвертного цукру вимогам стандарту. Таблиця 1
Таблиця 2
Завдання 3. Визначити у представлених зразках харчових продуктів масову частку цукрів фериціанідним методом, оформити отримані результати дослідження, зробити висновок про якість досліджуваного продукту. Метод заснований на власності редукуючих цукрів взаємодіяти з розчином фериціаніду в лужному середовищі і відновлювати гексаціано-(III) ферат калію K C глюказа червона кров’яна сахарна жовта кров’яна сіль кислота сіль У плодах і овочах містяться головним чином цукри – глюкоза, фруктоза і цукроза, які легко екстрагуються водою. При визначення масової частки цукрів слід одержати чисту водяну витяжку цих цукрів, для чого плоди та овочі ретельно подрібнюють і настоюють у теплій дистильованій воді. Фруктоза і глюкоза мають відновлювальні властивості, тому їх масову частку визначають у цій витяжці, а цукрозу, яка не має відновлювальних властивостей, визначають після її інверсії: C Цукроза глюкоза фруктоза
Чисті плоди та овочі подрібнюють на тертушці і перемішують. У скляному стаканчику зважують 25г подрібнених плодів та овочів і переносять за допомогою скляної палички і воронки у мірну колбу місткістю 250мл. Залишки наважки з стаканчика, воронки і палички змивають теплою дистильованою водою, доводять загальний об’єм води і наважки до 2/3 місткості колби. Органічні кислоти, які містяться в наважці, нейтралізують 15%-ним розчином NaCO Для відділення білків, дубильних, барвних та інших відновлюючих речовин із досліджуваної наважки плодів і овочів у колбу додають 10 мл 15%-ного розчину жовтої кров’яної солі K Хід роботи. Визначення масової частки редукуючих цукрів. Фільтратом А заповнюють бюретку. Піпеткою переносять по 10 мл 1%-ного розчину червоної кров’яної солі K За шкалою бюретки визначають фільтрат А, використаний на титрування. Потім виконують подібне титрування фільтратом А у другій колбі і фіксують його кількість, витрачену на титрування. За результат приймають середнє значення між першим і другим визначенням. Масову частку редукуючих цукрів визначають за формулою, %:
W де К – коефіцієнт поправки для приготування розчину гексаціано-(III) ферат каліювідносно 1%-го розчину; V – об’єм досліджуваного фільтрату А, використаного на титрування, мл; V m – маса наважки, г. Визначення масової частки загального цукру. Для визначення частки загального цукру готують фільтрат Б. Для цього піпеткою відбирають 50 мл фільтрат А і переносять у мірну колбу місткістю 100 мл, в яку додають 5 мл концентрованої соляної кислоти. Колбу вміщують у водяну баню, нагрівають до 70 Фільтрат Б заливають у бюретку. У дві конічні колби піпеткою переносять по 10 мл 1%-ного розчину червоної кров’яної солі і 5 мл розчину гідроксиду натрію(калію) концентрації 2,5 моль/л, ставлять на електричну плитку, доводять до кипіння, додають 2-3 краплі метиленового синього, титрують киплячий розчин фільтратом Б до зникнення синього кольору. Масову частку загального цукру визначають за формулою, %:
W
де К – коефіцієнт поправки для приготування розчину гексаціано-(III) ферат калію відносно 1%-го розчину; V – об’єм досліджуваного фільтрату Б, використаного на титрування, мл; V m – маса наважки, г. Визначення масової частки цукрози. Для визначення масової частки цукрози слід від масової частки загальних цукрів W W де W W 0,95 – поправочний коефіцієнт на цукрозу.
Оформлення результатів дослідження. Результати аналізів заносять до табл.3. На основі отриманих результатів роблять висновок про харчову цінність продукту. Таблиця №3
|
||||||||
|
Последнее изменение этой страницы: 2016-04-23; просмотров: 263; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.51.159 (0.011 с.) |

 CuSO
CuSO  + 2NaOH = Cu(OH)
+ 2NaOH = Cu(OH)  + Na
+ Na  SO
SO 

 H –C –OH H –C –O
H –C –OH H –C –O
 H –C –OH + Cu(OH)
H –C –OH + Cu(OH) 
 COONa COONa
COONa COONa
 H –C –O – Cu + H
H –C –O – Cu + H 




 O + Fe
O + Fe  (SO
(SO  + H
+ H  Х = 0,8:1,9 = 0,44
Х = 0,8:1,9 = 0,44
 100 (12),
100 (12),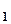 -об’єми витяжок із наважки і взятої для визначення цукрів, мл;
-об’єми витяжок із наважки і взятої для визначення цукрів, мл; 0.95 (13),
0.95 (13), і I
і I 


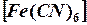 у гексоціано (II) ферат калію K
у гексоціано (II) ферат калію K 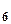 H
H  O
O  O
O  + 6K
+ 6K  O
O  + H
+ H  С, періодично струшуючи. При дослідженні картоплі, яка містить крохмаль, колбу з наважкою нагрівають при температурі не більшої за 50
С, періодично струшуючи. При дослідженні картоплі, яка містить крохмаль, колбу з наважкою нагрівають при температурі не більшої за 50 
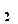 =
= 






