Чему равен коэффициент диффузии?
Похожие статьи вашей тематики
Коэффициент диффузии – количественная характеристика скорости диффузии, равная количеству вещества (в массовых единицах), проходящего в единицу времени через участок единичной площади (например, 1м²) при градиенте концентрации, равном единице (соответствующем изменению 1 моль/л → 0 моль/л на единицу длины)

79. Что понимают под внутренним трением?
В нутреннее трение – трение между частями одного и того же сплошного тела (например, жидкости или газа).
Силу трения, возникающую при движении твердого тела относительно жидкой или газообразной среды, следует отнести к категории сил внутреннего трения, поскольку в этом случае слои среды, непосредственно соприкасающиеся с телом, вовлекаются им в движение с той же скоростью, какую имеет тело, и на движение тела оказывает влияние трение между этими и внешними по отношению к ним слоями среды.
| КРИТЕРИЯ КНУДСЕНА
| Диапазон давлений,Па
| Степень вакуума
| | << 1
| 1·104 — 1·103
| Низкий вакуум
| |
| 1·102 — 1·10-1
| Средний вакуум
| | >> 1
| 9·10-2 — 1·10-5
| Высокий вакуум
| 80. Охарактеризуйте основные степени вакуума.
Вакуум – пространство, свободное от вещества. Различают 4 степени вакуума: низкий, средний, высокий и сверхвысокий. Для количественной оценки вводится число Кнудсена.
Зависимость критерия Кнудсена от степени вакуумирования
КРИТЕРИЙ КНУДСЕНА:
Kn = / L
-высокий вакуум: Kn >> 1;
- средний вакуум: Kn 1;
- низкий вакуум: Kn << 1.
Сверхвысокий вакуум — по допустимой степени покрытия поверхности адсорбированными газами.
Низкий вакуум характеризуется разряжением газа (РГ), при котором средняя длина свободного пробега частиц во много раз меньше характерного линейного размера, например диаметра трубопровода, существенного для рассматриваемого процесса (Kn<<l). При этом обмен энергией происходит исключительно между ближайшими молекулами. Такие условия проявляются в виде вязкости газа, а соответствующие процессы называются вязкостными. Низкому ВАКУУМУ обычно соответствует область давлений от 105 до 102 Па.
Средний вакуум характеризуется (РГ), при котором средняя длина свободного пробега частиц соизмерима с характерным линейным размером, существенным для рассматриваемого процесса (Kn ≈ l). В этом диапазоне давлений столкновения молекул со стенками и друг с другом равновероятны. Среднему ВАКУУМУ обычно соответствует область давлений от 100 до 0.1 Па.
Высокий вакуум характеризуется (РГ), при котором средняя длина свободного пробега частиц много больше размеров вакуумного объема, и молекулы преимущественно сталкиваются со стенками сосуда (Kn >> l). В этом случае каждая молекула выступает индивидуально, а процессы в газах называется молекулярными. Высокому ВАКУУМУ обычно соответствует область давлений от 0.1 до 10-5 Па.
Области сверхвысокого вакуума отличаются тем, что за характерное время рабочего процесса не происходит заметного изменения свойств поверхности, связанного с адсорбцией остаточных газов. Сверхвысокому ВАКУУМУ обычно соответствует область давлений ниже 10-5 Па.
81. Что понимают под числом степеней свободы?
Число степеней свободы механической системы – количество независимых величин, с помощью которых может быть задано положение системы. Одноатомный газ имеет три поступательные степени свободы і = 3, так как для описания положения такого газа в пространстве достаточно трёх координат (х, у, z).
82. Сформулируйте закон Больцмана о равномерном распределении энергии по степеням свободы.
В статистической физике выводится закон Больцмана о равномерном распределении энергии по степеням свободы молекул: для статистической системы, которая находится в состоянии термодинамического равновесия, на каждую поступательную и вращательную степени свободы приходится в среднем кинетическая энергия, равная kT/2, а на каждую колебательную степень свободы — в среднем энергия, равная kT. Колебательная степень обладает вдвое большей энергией, т.к. на нее приходится как кинетическая энергия (как в случае поступательного и вращательного движений), так и потенциальная, причем средние значения потенциальной и кинетической и энергии одинаковы. Значит, средняя энергия молекулы

i — сумма числа поступательных, числа вращательных в удвоенного числа колебательных степеней свободы молекулы: i = i пост+ i вращ+2 i колеб.
В классической теории рассматривают молекулы с жесткой связью между атомами; для них i совпадает с числом степеней свободы молекулы.
Так как в идеальном газе взаимная потенциальная энергия взаимодействия молекул равна нулю (молекулы между собой не взаимодействуют), то внутренняя энергия для одного моля газа, будет равна сумме кинетических энергий NA молекул: 
Внутренняя энергия для произвольной массы m газа. 
М — молярная масса, ν — количество вещества.
83. Дайте определение внутренней энергии.
Внутренняя энергия какого-либо тела – энергия этого тела за вычетом кинетической энергии тела как целого и потенциальной энергии тела во внешнем поле силы. Так, например, при определении внутренней энергии некоторой массы газа не должны учитываться энергия движения газа вместе с сосудом и энергия, обусловленная нахождением газа в поле сил земного тяготения.
Следовательно, в понятие внутренней энергии включаются кинетическая энергия хаотического движения молекул, потенциальная энергия взаимодействия между молекулами и внутримолекулярная энергия.
84. Чему равняется энергия произвольной массы идеального газа?
Идеальный газ – это газ, для которого собственный объем его молекул пренебрежимо мал по сравнению с объемом сосуда; между молекулами газа отсутствуют силы взаимодействия; столкновения молекул газа между собой и со стенками сосуда абсолютно упругие.
pV/T= const
85. Что такое работа, совершаемая над системой?
Работа сил над системой материальных точек определяется как сумма работ этих сил над каждой точкой (работы, совершённые над каждой точкой системы, суммируются в суммарную работу этих сил над системой).
Даже если изначально тело не является системой дискретных точек, можно разбить его (мысленно) на множество бесконечно малых элементов (кусочков), каждый из которых считать материальной точкой, вычисляя работу в соответствии с определением выше. В этом случае дискретная сумма заменяется на интеграл.
Эти определения могут быть использованы как для какой-то конкретной силы или класса сил — для вычисления именно их работы отдельно, так и для вычисления полной работы, совершаемой всеми силами, действующими на систему.
86. Что понимают под выражением «сообщение теплоты».
Сообщение теплоты – это передача Количества теплоты телу, способствующая нагреванию, т.е повышению его температуры.
Количеством теплоты Q, полученным телом, называют изменение внутренней энергии тела в результате теплообмена.
87. Дайте формулировку первому началу термодинамики.
Количество тепла, сообщенное системе, идет на приращение внутренней энергии системы и на совершение системой работы над внешними телами.
88. Дайте определение теплоёмкости.
Теплоёмкость ю какого-либо тела – величина, равная количеству тепла, которое нужно сообщить телу, чтобы повысить его температуру на один кельвин. Величина теплоемкости зависит от условий, при которых происходит нагревание тела.

89. Запишите уравнение Майера.
Сравнение между собой Ср и СV приводит к уравнению Майера: 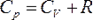
Это уравнение показывает, что Ср больше, чем СV на величину универсальной газовой постоянной R. Это объясняется тем, что при изобарном нагревании газа, в отличие от изохорного нагревания, требуется дополнительное количество теплоты на совершение работы расширения газа.
Таким образом, молярная теплоемкость газа определяется лишь числом степеней свободы и не зависит от температуры. Это утверждение справедливо в довольно широком интервале температур лишь для одноатомных газов. Уже у двухатомных газов число степеней свободы, проявляющееся в теплоемкости, зависит от температуры.
90. Дайте определение адиабатному процессу.
Адиабатическим процесс – процесс протекающий без теплообмена с внешней средой.
pVv = const
91. Что понимают под круговым процессом?
Круговой процесс - (цикл термодинамический) - термодинамический процесс, прикоторомвсетермодинамические параметры(и термодинамические функции) возвращаютсяксвоимнач. значениям.Еслитермодинамическое состояниеопределяется двумяпараметрами(напр., давлением Р иобъёмом V), Круговой процесс изображаетсяввидезамкнутойкривой(цикла)наплоскости, координатамикоторойслужаттермодинамические параметры(напр., Р и V).
92. Что такое прямой цикл?
Прямой цикл - круговой процесс, в котором система получает от нагревателя количество теплоты, отдает холодильнику количество теплоты и совершает работу
93. Что такое обратный цикл?
Обратный цикл - круговой процесс, в котором рабочее тело переносит теплоту от холодного тела к более нагретому. Устройства, предназначенные для этого, называют холодильными машинами или холодильниками.
94. Запишите коэффициент полезного действия для кругового процесса.
Термический коэффициент полезного действия для кругового процесса - это величина, равная отношению работы, совершенной системой, к количеству теплоты, полученному в этом цикле системой:
η=A/Q1=(Q1-Q2)/Q1=1-(Q2/Q1) (65)
95. В чём отличие обратимого от необратимого процессов?
Термодинамический процесс называется обратимым, если он может происходить как в прямом, так и в обратном направлении. Причем, если такой процесс происходит сначала в прямом, а затем в обратном направлении и система возвращается в исходное состояние, то в окружающей среде и в этой системе не происходит никаких изменений. Всякий процесс, не удовлетворяющий этим условиям, является необратимым.
96. Дайте определение энтропии.
Энтропия (от др.-греч.ἐντροπία — поворот, превращение) Впервые введён в рамках термодинамикикак функция состояниятермодинамической системы, определяющая меру необратимого рассеивания энергии. В статистической физикеэнтропия является мерой вероятностиосуществления какого-либо макроскопического состояния. Энтропия может интерпретироваться как мера неопределённости (неупорядоченности) некоторой системы (например, какого-либо опыта (испытания), который может иметь разные исходы, а значит, и количество информации.
. Другой интерпретацией этого понятия является информационная ёмкость системы. С данной интерпретацией связан тот факт, что создатель понятия энтропии в теории информации Клод Шеннонсначала хотел назвать эту величину информацией. В широком смысле, в каком слово часто употребляется в быту, энтропия означает меру неупорядоченности системы; чем меньше элементы системы подчинены какому-либо порядку, тем выше энтропия.
97. Какова формулировка второго начала термодинамики?
Второе начало термодинамики — физический принцип, накладывающий ограничение на направление процессов, которые могут происходить в термодинамических системах.
Второе начало термодинамики запрещает так называемые вечные двигатели второго рода, показывая, что коэффициент полезного действия не может равняться единице, поскольку для кругового процесса температура холодильника не может равняться абсолютному нулю (невозможно построить замкнутый цикл, проходящий через точку с нулевой температурой).
Второе начало термодинамики является постулатом, не доказываемым в рамках классической термодинамики. Оно было создано на основе обобщения опытных фактов и получило многочисленные экспериментальные подтверждения.
98. Что понимают под циклом Карно?
В термодинамике цикл Карно́ или процесс Карно — это обратимый круговой процесс, состоящий из двух адиабатических и двух изотермических процессов. В процессе Карно термодинамическая система выполняет механическую работу и обменивается теплотой с двумя тепловыми резервуарами, имеющими постоянные, но различающиеся температуры. Резервуар с более высокой температурой называется нагревателем, а с более низкой температурой — холодильником
Цикл Карно назван в честь французского учёного и инженера Сади Карно, который впервые его описал в своём сочинении «О движущей силе огня и о машинах, способных развивать эту силу» в 1824 году.
99. Чему равен термический КПД цикла Карно?
Количество теплоты, полученное рабочим телом от нагревателя при изотермическом расширении, равно
 . .
Аналогично, при изотермическом сжатии рабочее тело отдаёт холодильнику
 . .
Отсюда коэффициент полезного действия тепловой машины Карно равен
 . .
100. Что понимают под реальным газом?
Реальный газ — газ, который не описывается уравнением состояния идеального газа Клапейрона — Менделеева. Зависимости между его параметрами показывают, что молекулы в реальном газе взаимодействуют между собой и занимают определенный объём.
101. Запишите уравнение Ван-дер-Ваальса.
Уравнение состояния газа Ван-дер-Ваальса — уравнение, связывающее основные термодинамические величиныв модели газаВан-дер-Ваальса.
Уравнение Ван-дер-Ваальса — это одно из широко известных приближённых уравнений состояния, имеющее компактную форму и учитывающее основные характеристики газа с межмолекулярным взаимодействием
Термическим уравнением состояния (или, часто, просто уравнением состояния) называется связь между давлением, объёмом и температурой.
Для одного моля газа Ван-дер-Ваальса оно имеет вид:

 — давление, — давление,
 — молярный объём, — молярный объём,
 — абсолютная температура, — абсолютная температура,
 — универсальная газовая постоянная. — универсальная газовая постоянная.
Видно, что это уравнение фактически является уравнением состояния идеального газа с двумя поправками. Поправка  учитывает силы притяжения между молекулами (давление на стенку уменьшается, так как есть силы, втягивающие молекулы приграничного слоя внутрь), поправка учитывает силы притяжения между молекулами (давление на стенку уменьшается, так как есть силы, втягивающие молекулы приграничного слоя внутрь), поправка  — объем молекул газа. — объем молекул газа.
Для  молей газа Ван-дер-Ваальса уравнение состояния выглядит так: молей газа Ван-дер-Ваальса уравнение состояния выглядит так:

 — объём. — объём.
102. Дайте определение насыщенному пару.
Насы́щенный пар — это пар, находящийся в термодинамическом равновесии с жидкостью или твёрдым телом того же состава. Давление насыщенного пара связано определённой для данного вещества зависимостью от температуры.
|








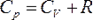
 .
. .
. .
.
 — давление,
— давление, — молярный объём,
— молярный объём, — абсолютная температура,
— абсолютная температура, — универсальная газовая постоянная.
— универсальная газовая постоянная. учитывает силы притяжения между молекулами (давление на стенку уменьшается, так как есть силы, втягивающие молекулы приграничного слоя внутрь), поправка
учитывает силы притяжения между молекулами (давление на стенку уменьшается, так как есть силы, втягивающие молекулы приграничного слоя внутрь), поправка  — объем молекул газа.
— объем молекул газа. молей газа Ван-дер-Ваальса уравнение состояния выглядит так:
молей газа Ван-дер-Ваальса уравнение состояния выглядит так:
 — объём.
— объём.


