Дайте определение напряженности гравитационного поля?
Напряжённость гравитационного поля — векторная величина, характеризующая гравитационное поле в данной точке и численно равная отношению силы тяготения, действующей на тело, помещённое в данную точку поля, к гравитационной массе этого тела:

38. Работа в гравитационном поле.
Если тело перемещается в гравитационном поле на значительное расстояние, то совершаемую против сил гравитационного притяжения работу (например, наботу для вывода ракеты в космос) нельзя вычислить по формуле W=G*h, потому, что сила тяжести G обратно пропорциональна расстоянию между центрами масс.
Работа, совершаемая при перемещении тела вдоль радиуса в гравитационном поле, определяется как интеграл.
39. Потенциальная энергия тела в гравитационном поле.
Энергия взаимодействия тела с гравитационным полем Земли описывается формулой En=mgh только в том случае, если гравитационное поле Земли можно считать однородным, не зависящим от координат. Гравитационное поле определяется законом всемирного тяготения

где R – радиус-вектор, проведенный от центра масс Земли (принятого за начало отсчета) до данной точки. По аналогии с электростатикой можно записать эту формулу в виде: Fтяг.= m1g
и назвать вектором напряженности гравитационного поля в данной точке. Ясно, что это поле изменяется с расстоянием от создающего поле тела. Когда же можно считать 
гравитационное поле с достаточной точностью однородным? Очевидно, это возможно в области пространства, размеры которой h много меньше расстояния до цента поля R. Иными словами если вы рассматриваете падение камня с верхнего этажа дома, можно спокойно пренебречь разницей в значении гравитационного поля на верхнем и нижнем этажах. Однако изучая движение планет вокруг Солнца, нельзя считать, что планета движется в одном поле, и следует пользоваться общим законом тяготения.
40. Приведите отличительные особенности жидкостей газов.
Жидкости и газы не имеют собственной формы и всегда принимают форму сосуда, в котором они содержатся. Под действием сколь угодно малых сил они будут изменять свою форму, пока силы действуют. Следовательно, жидкости и газы не обладают упругостью по отношению к деформациям, вызывающим изменение их формы без изменения объема. Но жидкости и газы обладают упругостью по отношению к деформациям сжатия, так как для изменения их объема на конечную величину к ним необходимо приложить конечные силы тем большие по величине, чем больше их сжатие. В жидкостях и газах, как и в твердых телах, при их сжатии возникают силы, препятствующие сжатию, причем величина их возрастает с возрастанием величины деформации сжатия. Эти силы, подобные упругим, уравновешивают деформирующие силы в стационарном состоянии жидкости или газа.
41. Несжимаемая жидкость.
В очень многих случаях течения жидкостей (и газов) их плотность можно считать неизменяющейся, т. е. постоянной вдоль всего объема жидкости в течение всего времени движения. Другими словами, в этих случаях при движении не происходит заметных сжатий или расширений жидкости. О таком движении говорят как о движении несжимаемой жидкости.
42. Давление в жидкости.
В жидкостях частицы подвижны, поэтому они не имеют собственной формы, но обладают собственным объемом, сопротивляются сжатию и растяжению; не сопротивляются деформации сдвига (свойство текучести).
В покоящейся жидкости существует два вида статического давления: гидростатическое и внешнее. Вследствие притяжения к Земле жидкость оказывает давление на дно и стенки сосуда, а также на тела, находящиеся внутри нее. Давление, обусловленное весом столба жидкости, называется гидростатическим. Давление жидкости на разных высотах различно и не зависит от ориентации площадки, на которую оно производится.
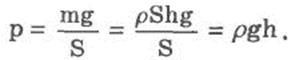
Гидростатическое давление жидкости зависит от плотности р жидкости, от ускорения g свободного падения и от глубины h, на которой находится рассматриваемая точка. Оно не зависит от формы столба жидкости.
Глубина h отсчитывается по вертикали от рассматриваемой точки до уровня свободной поверхности жидкости. В условиях невесомости гидростатическое давление в жидкости отсутствует, так как в этих условиях жидкость становится невесомой. Внешнее давление характеризует сжатие жидкости под действием внешней силы.
Оно равно:

43. Сформулируйте закон Паскаля.
Закон Паскаля формулируется так: Давление, производимое на жидкость или газ, передается в любую точку без изменений во всех направлениях.
44. Принцип действия гидравлического подъемника.
Любой гидравлический подъемник характеризуется как грузоподъемное приспособление, платформа которого движется при помощи специального электрогидравлического привода. Последний состоит из насоса, который нагнетает рабочую жидкость, и гидроцилиндра, куда, собственно, эта жидкость и попадает в конечном итоге. Действует данное устройство очень плавно, что позволяет производить подъем платформы без каких-либо рывков. При этом скорость действия механизма достаточно высока.
45. Сформулируйте закон Архимеда.
Закон Архимеда формулируется следующим образом: на тело, погружённое в жидкость (или газ), действует выталкивающая сила, равная весу жидкости (или газа) в объёме тела. Сила называется силой Архимеда:

где P — плотность жидкости (газа), g — ускорение свободного падения, а V — объём погружённого тела (или часть объёма тела, находящаяся ниже поверхности).
Если тело плавает на поверхности (равномерно движется вверх или вниз), то выталкивающая сила (называемая также архимедовой силой) равна по модулю (и противоположна по направлению) силе тяжести, действовавшей на вытесненный телом объём жидкости (газа), и приложена к центру тяжести этого объёма.
46. Чему равно гидростатическое давление?
Гидростатическое давление p – это скалярная величина, характеризующая напряженное состояние жидкости. Давление равно модулю нормального напряжения в точке:
p=|s|
Давление в системе СИ измеряется в паскалях:
Па = Н / м 2.Связь единиц давления в различных системах измерения такая:
100000 Па = 0,1 МПа = 1 кгс/см 2 = 1 ат = 10 м вод. ст.
Два свойства гидростатического давления:
1. Давление в покоящейся жидкости на контакте с твёрдым телом вызывает напряжения, направленные перпендикулярно к поверхности раздела.
2. Давление в любой точке жидкости действует одинаково по всем направлениям. Это свойство отражает скалярность давления.
47.Что понимают под словом «вязкость»?
Вязкость (внутреннее трение) — одно из явлений переноса, свойство текучих тел (жидкостей и газов) оказывать сопротивление перемещению одной их части относительно другой. В результате работа, затрачиваемая на это перемещение, рассеивается в виде тепла.
Механизм внутреннего трения в жидкостях и газах заключается в том, что хаотически движущиеся молекулы переносят импульс из одного слоя в другой, что приводит к выравниванию скоростей — это описывается введением силы трения. Вязкость твёрдых тел обладает рядом специфических особенностей и рассматривается обычно отдельно.
Различают динамическую вязкость (единица измерения в Международной системе единиц (СИ) — Па·с, в системе СГС — пуаз;1 Па·с = 10 пуаз) и кинематическую вязкость (единица измерения в СИ — м²/с, в СГС — стокс, внесистемная единица — градус Энглера). Кинематическая вязкость может быть получена как отношение динамической вязкости к плотности вещества и своим происхождением обязана классическим методам измерения вязкости, таким как измерение времени вытекания заданного объёма через калиброванное отверстие под действием силы тяжести. Прибор для измерения вязкости называется вискозиметром.
Переход вещества из жидкого состояния в стеклообразное обычно связывают с достижением вязкости порядка 1011−1012 Па·с.
48. Сила внутреннего трения. Определение.
Идеальная жидкость, т. е. жидкость без трения, является абстракцией. Всем реальным жидкостям и газам в большей или меньшей степени присуща вязкость или внутреннее трение. Вязкость проявляется в том, что возникшее в жидкости или газе движение после прекращения действия причин, его вызвавших, постепенно прекращается.
49. Дайте определение термодинамики.
Термодинамика (греч. θέρμη — «тепло», δύναμις — «сила») — раздел физики, изучающий наиболее общие свойства макроскопических систем и способы передачи и превращения энергии в таких системах. В термодинамике изучаются состояния и процессы, для описания которых можно ввести понятие температуры. Термодинамика — это феноменологическая наука, опирающаяся на обобщения опытных фактов. Процессы, происходящие в термодинамических системах, описываются макроскопическими величинами (температура, давление, концентрации компонентов), которые вводятся для описания систем, состоящих из большого числа частиц, и не применимы к отдельным молекулам и атомам, в отличие, например, от величин, вводимых в механике или электродинамике.
50. Что такое термодинамическая система?
Термодинамическая система — выделяемая (реально или мысленно) для изучения макроскопическая физическая система, состоящая из большого числа частиц и не требующая для своего описания привлечения микроскопических характеристик отдельных частиц, «часть Вселенной, которую мы выделяем для исследования». Единицей измерения числа частиц в термодинамической системе обычно служит число Авогадро (примерно 6·1023 частиц на моль вещества), дающее представление, о величинах какого порядка идёт речь. Ограничения на природу материальных частиц, образующих термодинамическую систему, не накладываются: это могут быть атомы, молекулы, электроны, ионы, фотоны и т. д. Любой объект, видимый невооружённым глазом или с помощью оптических приборов (микроскопы, телескопы и т. п.), можно отнести к термодинамическим системам: «Термодинамика занимается изучением макроскопических систем, пространственные размеры которых и время существования достаточны для проведения нормальных процессов измерения»
Для описания термодинамической системы используются макроскопические параметры, характеризующие не свойства составляющих её частиц, а свойства самой системы: температуру, давление, объём, магнитную индукцию, электрическую поляризацию, массу и химический состав компонентов и др.
Важно, что в состав термодинамической системы включают все частицы, имеющиеся в выделяемой для изучения области пространства. Дело в том, что в термодинамике иногда один и тот же объём рассматривают как занимаемый одновременно двумя и более квазинезависимыми (слабо взаимодействующими друг с другом) парциальными подсистемами частиц разной природы (например, газовую смесь характеризуют парциальными давлениями составляющих её газов; в кристалле выделяют подсистемы фононов и магнонов; систему ядерных спинов парамагнетика характеризуют собственной парциальной спиновой температурой, способной принимать отрицательные значения по шкале Кельвина). Данный формальный приём позволяет вводить для рассматриваемой подсистемы частиц парциальные характеристики, не обязательно имеющие прямое отношение к физической системе как единому целому (см., например, Отрицательная абсолютная температура).
51.Что понимают под внешней средой?
Внешняя среда – среда, окружающая биоценозы, физическая основа их биоцентрической среды, атмосфера и ее циркуляция, солнечный свет и теплота, материнская порода почвы, ее химические вещества, газы и растворы, вода и влажность атмосферы почвы, общий климат территории и акватории. Режим всех этих факторов отличается ритмичностью: суточной, обусловленной вращением Земли – изменения прихода солнечной радиации и теплового режима и влажности в течение суток; годовой, связанной с вращение Земли вокруг Солнца – колебания прихода солнечной радиации и тепла, изменение поверхности по сезонам года; вековой – особенно связанной с циклами солнечной активности.
52. Замкнутая термодинамическая система. Дайте определение.
Замкнутая термодинамическая система — изолированная термодинамическая система, для которой невозможен обмен с внешней средой путём совершения работы. (нет обмена веществом с окружающей средой). Пример – герметичный сосуд.
53.Приведите примеры термодинамических параметров.
Макроскопические признаки, характеризующие систему, называются термодинамическими параметрами. Наибольшее значение имеют параметры, поддающиеся непосредственному определению т.е. температура, давление, объем, плотность, концентрация и др.
Классификация термодинамических параметров:
–Внешние параметры – величины, определяемые положением не входящих в данную систему тел. Например, объем системы определяется расположением внешних тел, напряженность внешнего силового поля зависит от положения источников поля, не входящих в данную систему.
–Внутренние параметры - величины, определяемые движением и расположением в пространстве частиц, входящих в данную систему. Давление, плотность, поляризация зависят от взаимного расположения частиц системы, скорости их движения, сил взаимодействия между ними. Однако считать тот или иной параметр внешним или внутренним зависит от того, как мы проводим границу между системой и окружающей средой.
Другая классификация ТД параметров связана с их зависимостью от размеров системы:
–Интенсивные параметры не зависят от размера системы. Это - температура, давление и т.д. Интенсивные параметры могут быть измерены лишь через некоторую экстенсивную величину.
–Переменные, значения которых изменяются пропорционально размерам и массе системы при ее разбиении на части без нарушения равновесного состояния, называются экстенсивными параметрами. К ним относятся объем, длина, масса и т.д. Экстенсивные параметры обладают свойством аддитивности.
54. Перечислите термодинамические процессы.
По разным признакам в термодинамике процессы классифицируются так:
1. По конечному результату – разомкнутые и циклические, в результате которых параметры приобретают исходные значения.
2. По характеру взаимодействия с окружающей средой: обратимые и необратимые. Обратимые процессы не оставляют изменений в окружающей среде.
3. По местонахождению причины: самопроизвольные (причина – в самой системе) и вынужденные (причина – в окружающей среде)
4. По пути проведения процесса: изотермический (при постоянной температуре), изобарический или изобарный (при постоянном давлении), изохорический (при постоянном объеме), адиабатический (без обмена энергией с окружающей средой).
55. Что понимают под термодинамическим равновесием?
Термодинамическое равновесие — состояние системы, при котором остаются неизменными по времени макроскопические величины этой системы (температура, давление, объём, энтропия) в условиях изолированности от окружающей среды. В общем, эти величины не являются постоянными, они лишь флуктуируют (колеблются) возле своих средних значений.
Если равновесной системе соответствует несколько состояний, в каждом из которых система может находиться неопределенно долго, то о системе говорят, что она находится в метастабильном равновесии. В состоянии равновесия в системе отсутствуют потоки материи или энергии, неравновесные потенциалы (или движущие силы), изменения количества присутствующих фаз.
Отличают тепловое, механическое, радиационное (лучистое) и химическое равновесия. На практике условие изолированности означает, что процессы установления равновесия протекают гораздо быстрее, чем происходят изменения на границах системы (то есть изменения внешних по отношению к системе условий), и осуществляется обмен системы с окружением веществом и энергией. Иными словами, термодинамическое равновесие достигается, если скорость релаксационных процессов достаточно велика (как правило, это характерно для высокотемпературных процессов) либо велико время для достижения равновесия (этот случай имеет место в геологических процессах).
56. Дайте определение температуре.
Температу́ра (от лат. temperatura — надлежащее смешение, нормальное состояние) — физическая величина, характеризующая термодинамическую систему и количественно выражающая интуитивное понятие о различной степени нагретости тел. Живые существа способны воспринимать ощущения тепла и холода непосредственно, с помощью органов чувств. Однако точное определение температуры требует, чтобы температура измерялась объективно, с помощью приборов.
Такие приборы называются термометрами и измеряют так называемую эмпирическую температуру. В эмпирической шкале температур устанавливаются две реперные точки и число делений между ними — так были введены используемые ныне шкалы Цельсия, Фаренгейта и другие. Измеряемая в кельвинах абсолютная температура вводится по одной реперной точке с учётом того, что в природе существует минимальное предельное значение температуры — абсолютный нуль. Верхнее значение температуры ограничено планковской температурой.
В термодинамике температура — это интенсивная термодинамическая величина.
Наряду с термодинамическим, в других разделах физики могут вводиться и другие определения температуры. В молекулярно-кинетической теории показывается, что температура пропорциональна средней кинетической энергии частиц системы. Температура определяет распределение частиц системы по уровням энергии (см. Статистика Максвелла — Больцмана), распределение частиц по скоростям (см. Распределение Максвелла), степень ионизации вещества (см. Уравнение Саха), спектральную плотность излучения (см. Формула Планка), полную объёмную плотность излучения (см.Закон Стефана — Больцмана) и т. д. Температуру, входящую в качестве параметра в распределение Больцмана, часто называют температурой возбуждения, в распределение Максвелла — кинетической температурой, в формулу Саха — ионизационной температурой, в закон Стефана — Больцмана — радиационной температурой. Для системы, находящейся в термодинамическом равновесии, все эти параметры равны друг другу, и их называют просто температурой системы.
57. Опишите модель идеального газа.
Идеальный газ — математическая модель газа, в которой в рамках молекулярно-кинетической теории предполагается, что:
1. Потенциальной энергией взаимодействия частиц, составляющих газ, можно пренебречь по сравнению с их кинетической энергией;
2. Суммарный объём частиц газа пренебрежимо мал;
3. Между частицами нет дальнодействующих сил притяжения или отталкивания, соударения частиц между собой и со стенками сосуда абсолютно упруги;
4. Время взаимодействия между частицами пренебрежимо мало по сравнению со средним временем между столкновениями. В расширенной модели идеального газа частицы, из которого он состоит, имеют форму упругих сфер или эллипсоидов, что позволяет учитывать энергию не только поступательного, но и вращательно-колебательного движения, а также не только центральные, но и нецентральные столкновения частиц. В рамках термодинамики идеальными называются гипотетические (реально не существующие) газы, подчиняющиеся термическому уравнению состояния Клапейрона — Менделеева.
Модель широко применяется для решения задач термодинамики газов и аэрогазодинамики. Например, воздух при атмосферном давлении и комнатной температуре с большой точностью описывается данной моделью. В случае экстремальных температур или давлений требуется применение более точных уравнений состояния реальных газов, например уравнения Ван-дер-Ваальса, в котором учитывается притяжение между молекулами.
Различают классический идеальный газ (его свойства выводятся из законов классической механики и описываются статистикой Больцмана) и квантовый идеальный газ (свойства определяются законами квантовой механики, описываются статистиками Ферми — Дирака или Бозе — Эйнштейна).
58. В чём отличие количества вещества от молярной массы?
Количество вещества — физическая величина, характеризующая количество однотипных структурных единиц, содержащихся в веществе. Под структурными единицами понимаются любые частицы, из которых состоит вещество (атомы, молекулы, ионы, электроны или любые другие частицы). Единица измерения количества вещества — моль
Молярная масса вещества (M) – масса одного моля этого вещества.
По величине она равна относительной молекулярной массе Mr (для веществ атомного строения – относительной атомной массе Ar). Единица измерения количества вещества — г/моль
59. Сформулируйте закон Авогадро.
Закон, согласно которому в равных объёмах различных газов, взятых при одинаковых температурах и давлениях, содержится одно и то же число молекул. В виде гипотезы был сформулирован в 1811 году Амедео Авогадро (1776 — 1856), профессором физики в Турине.
 NA= 6.02214129 × 1023 Моль-1 – постоянная Авогадро NA= 6.02214129 × 1023 Моль-1 – постоянная Авогадро
Первое следствие: один моль (одинаковое количество молей) любого газа при одинаковых — изобаричных и изотермичных — условиях занимает одинаковый объём. С другой стороны, 1 моль любого вещества содержит (по определению) одинаковое число частиц (англ.)русск. (например, молекул). Отсюда следует, что при определённых температуре и давлении 1 моль любого вещества в газообразном состоянии занимает один и тот же объём.
В частности, при нормальных условиях, т. е. при 0 °C (273К) и 101,3 кПа, объём 1 моля газа равен 22,413(962) л (л/моль). Этот объём называют молярным объёмом газа Vm. Пересчитать эту величину на другие температуру и давление можно с помощью уравнения Клапейрона:
Второе следствие: молярная масса первого газа равна произведению молярной массы второго газа на относительную плотность первого газа ко второму.
Положение это имело громадное значение для развития химии (химии идеального газа), так как оно дает возможность определять частичный вес тел, способных переходить в газообразное или парообразное состояние.
60. Сформулируйте закон Дальтона.
Законы Дальтона — два физических закона, определяющих суммарное давление (1801) и растворимость (1803) смеси газов. Сформулированы Джоном Дальтоном в начале XIX века. Дальтону также принадлежит формулировка закона кратных отношений (1803).
–Закон о суммарном давлении смеси газов
Закон, согласно которому парциальное давление идеального газа в смеси равно давлению, которое будет оказываться, если бы он занимал тот же объём, что и вся смесь газов, при той же температуре. Причина этого в том, что между молекулами идеального газа не действуют силы притяжения или отталкивания, их соударения между собой и со стенками сосуда абсолютно упруги, а время взаимодействия между молекулами пренебрежимо мало по сравнению со средним временем между столкновениями. Реально существующие газы очень близко подходят к этому идеалу.
Следствием этого является то, что общее давление смеси идеальных газов равно сумме парциальных давлений каждого газа в смеси, как это формулирует закон Дальтона. Например, дана смесь идеального газа из азота (N2), водорода (H2) и аммиака(NH3):
 , где: , где:
 = общему давлению в газовой смеси = общему давлению в газовой смеси
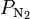 = парциальному давлению азота (N2) = парциальному давлению азота (N2)
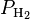 = парциальному давлению водорода (H2) = парциальному давлению водорода (H2)
 = парциальному давлению аммиака (NH3) = парциальному давлению аммиака (NH3)
–Закон о растворимости компонентов газовой смеси
При постоянной температуре растворимость в данной жидкости каждого из компонентов газовой смеси, находящейся над жидкостью, пропорциональна их парциальному давлению.

61. Что такое парциальное давление?
Парциа́льное давление (лат. partialis — частичный, от лат. pars — часть) — давление отдельно взятого компонента газовой смеси. Общее давление газовой смеси является суммой парциальных давлений её компонентов.
62. Запишите уравнение Клайперона-Менделеева.
Газы нередко бывают реагентами и продуктами в химических реакциях. Не всегда удается заставить их реагировать между собой при нормальных условиях. Поэтому нужно научиться определять число молей газов в условиях, отличных от нормальных. Для этого используют: Уравнение состояния идеального газа (иногда уравнение Клапейрона или уравнение Менделеева — Клапейрона) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа.
Уравнение имеет вид: PV = n RT
n — число молей газа,
Р— давление,
V— молярный объём,
R— универсальная газовая постоянная
T— абсолютная температура, К.
Уравнение, выведенное Клапейроном, содержало некую неуниверсальную газовую постоянную (r), значение которой необходимо было измерять для каждого газа:
PV = n T
Менделеев же обнаружил, что неуниверсальная газовая постоянная (r) прямо пропорциональна количеству вещества (n), коэффициент пропорциональности R он назвал универсальной газовой постоянной.
63. Запишите основное уравнение МКТ.
Молекулярно-кинетическая теория (сокращённо МКТ) — теория, возникшая в XIX веке и рассматривающая строение вещества, в основном газов, с точки зрения трёх основных приближенно верных положений:
– все тела состоят из частиц: атомов и молекул;
– частицы находятся в непрерывном хаотичном движении (тепловом);
– частицы взаимодействуют друг с другом путём абсолютно упругих столкновений.

Основное уравнение МКТ связывает макроскопические параметры (давление, объём, температура) термодинамической системы с микроскопическими параметры (масса молекул, средняя скорость их движения).
64. Чему равняется средняя квадратичная скорость молекул?
Уравнение среднеквадратичной скорости молекулы выводится из основного уравнения МКТ для одного моля газа.
 R = 8.3144621 – универсальная газовая постоянная. R = 8.3144621 – универсальная газовая постоянная.
65. Чему равняется средняя кинетическая энергия поступательного движения одной молекулы идеального газа?
Средняя кинетическая энергия поступательного движения молекулы идеального газа зависит только от его термодинамической температуры Т и прямо пропорциональна этой температуре.
T=2⟨Ek⟩/k.
 – Средняя кинетическая энергия поступательного движения молекул: – Средняя кинетическая энергия поступательного движения молекул:
66. Запишите барометрическую формулу.
Барометрическая формула –зависимость давления или плотности газа от высоты в поле силы тяжести.
Для идеального газа, имеющего постоянную температуру и находящегося в однородном поле тяжести (во всех точках его объёма ускорение свободного падения одинаково), барометрическая формула имеет следующий вид:
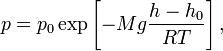
 — давление газа в слое, расположенном на высоте — давление газа в слое, расположенном на высоте 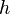 , ,
 — давление на нулевом уровне ( — давление на нулевом уровне (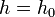 ), ),
 — молярная масса газа, — молярная масса газа,
 — универсальная газовая постоянная, — универсальная газовая постоянная,
 — абсолютная температура. Из барометрической формулы следует, что концентрация молекул — абсолютная температура. Из барометрической формулы следует, что концентрация молекул  (или плотность газа) убывает с высотой по тому же закону: (или плотность газа) убывает с высотой по тому же закону:
  — масса молекулы газа, — масса молекулы газа,  — постоянная Больцмана. — постоянная Больцмана.
67. Напишите распределение Больцмана.
Распределение Больцмана – распределение по энергиям частиц (атомов, молекул) идеального газа в условиях термодинамического равновесия было открыто в 1868–1871 гг. австрийским физиком Л. Больцманом.
В присутствии гравитационного поля (или, в общем случае, любого потенциального поля) на молекулы газа действует сила тяжести. В результате, концентрация молекул газа оказывается зависящей от высоты:
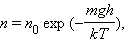 n – концентрация молекул на высоте h, n 0 – концентрация молекул на начальном уровне h = 0, m – масса частиц, g – ускорение свободного падения, k – постоянная Больцмана, T – температура. n – концентрация молекул на высоте h, n 0 – концентрация молекул на начальном уровне h = 0, m – масса частиц, g – ускорение свободного падения, k – постоянная Больцмана, T – температура.
| 68. Что понимают под длиной свободного пробега?
Длина свободного пробега молекулы – это среднее расстояние (обозначаемое), которое частица пролетает за время свободного пробега от одного столкновения до следующего.
Длина свободного пробега каждой молекулы различна, поэтому в кинетической теории вводится понятие средней длины свободного пробега (<λ>). Величина <λ> является характеристикой всей совокупности молекул газа при заданных значениях давления и температуры.
69. Что понимают под эффективным диаметром молекулы?
Эффективный диаметр молекулы – минимальное расстояние, на которое сближаются центры двух молекул при столкновении.
При столкновении молекулы сближаются до некоторого наименьшего расстояния, которое условно считается суммой радиусов взаимодействующих молекул. Столкновение между одинаковыми молекулами может произойти только в том случае, если их центры сблизятся на расстояние, меньшее или равное диаметру — эффективному диаметру молекулы.
70. Как определяется длина свободного пробега. Запишите формулу.
 , где , где  — эффективное сечение молекулы, — эффективное сечение молекулы,  — концентрация молекул. — концентрация молекул.
71. Дайте определение явлению переноса.
Нарушение равновесия сопровождается возникновением потоков либо молекул, либо тепла, либо электрического заряда и т.п. В связи с этим соответствующие процессы носят название явлений переноса.
При нарушении равновесия система стремится вернуться в равновесное состояние. Этот процесс сопровождается возрастанием энтропии и, следовательно, необратим. Таким образом, процессы, изучаемые физической кинетикой, являются необратимыми. Следовательно, и явление переноса представляет собой необратимый процесс.
72.Сформулируйте закон Фурье.
Для распространения теплоты в любом теле или пространстве необходимо наличие разности температур в различных точках тела. Это условие относится и к передаче теплоты теплопроводностью, при которой градиент температуры в различных точках тела не должен быть равен нулю.
Связь между количеством теплоты dQ в Дж, проходящим через элементарную площадку dF, расположенную на изотермной поверхности, за промежуток времени dt и градиентом температуры устанавливается гипотезой Фурье, согласно которой

Минус в правой части показывает, что в направлении теплового потока температура убывает и величина grad t является величиной отрицательной. Множитель пропорциональности λ называют коэффициентом теплопроводности. Уравнение носит название основного уравнения теплопроводности, или закона Фурье.
73. Дайте определение теплопроводности.
Теплопроводность – способность материальных тел к переносу энергии (теплообмену) от более нагретых частей тела к менее нагретым телам, осуществляемому хаотически движущимися частицами тела (атомами, молекулами, электронами и т. п.), приводящих к выравниванию температур. Такой теплообмен может происходить в любых телах с неоднородным распределением температур, но механизм переноса теплоты будет зависеть от агрегатного состояния вещества.
74. Что такое диффузия.
Диффузиея – обусловленное тепловым движением молекул самопроизвольное выравнивание концентраций смеси нескольких (в простейшем случае двух) различных веществ.
75. Что понимают под плотностью теплового потока?
Плотность теплового потока jE – величина, которая определяется энергией, переносимой в форме теплоты в единицу времени через единичную площадку, перпендикулярную оси х.
Теплота самопроизвольно переносится только в сторону убывания температуры. Количество теплоты, переносимое через какую-либо изотермическую поверхность в единицу времени, называется тепловым потоком Q. Тепловой поток, отнесенный к единице площади изотермической поверхности, называется плотностью теплового потока q. Плотность теплового потока есть вектор, направление которого совпадает с направлением распространения теплоты в данной точке и противоположно направлению вектора температурного градиента.
76. Чему равняется коэффициент теплопроводности?
Коэффициент теплопроводности λ – физический параметр вещества, характеризующий его способность проводить теплоту. Размерность коэффициента теплопроводности определяется из уравнения
 ; ; 
Числовое значение коэффициента теплопроводности определяет, количество теплоты, проходящей через единицу изотермной поверхности в единицу времени, при условии, что градиент температуры равен единице (grad t = 1). Коэффициент теплопроводности зависит от давления и температуры. Для большинства веществ коэффициенты теплопроводности определяются опытным путем и для технических расчетов берутся из справочных таблиц.
77. Дайте определение градиенту температуры.
Предел отношения изменения температуры Δt к расстоянию между изотермами по нормали Δn, когда Δn стремится к нулю, называют градиентом температуры, имеющим размерность [град/м]

Градиент температуры есть вектор, направленный по нормали к изотермной поверхности в сторону возрастания температуры и численно равный частной производной от температуры по этому направлению. За положительное направление градиента принимается направление возрастания температур.
|






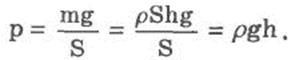


 NA= 6.02214129 × 1023 Моль-1 – постоянная Авогадро
NA= 6.02214129 × 1023 Моль-1 – постоянная Авогадро , где:
, где: = общему давлению в газовой смеси
= общему давлению в газовой смеси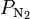 = парциальному давлению азота (N2)
= парциальному давлению азота (N2)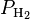 = парциальному давлению водорода (H2)
= парциальному давлению водорода (H2) = парциальному давлению аммиака (NH3)
= парциальному давлению аммиака (NH3)

 R = 8.3144621 – универсальная газовая постоянная.
R = 8.3144621 – универсальная газовая постоянная. – Средняя кинетическая энергия поступательного движения молекул:
– Средняя кинетическая энергия поступательного движения молекул: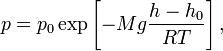
 — давление газа в слое, расположенном на высоте
— давление газа в слое, расположенном на высоте 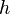 ,
, — давление на нулевом уровне (
— давление на нулевом уровне (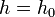 ),
),  — молярная масса газа,
— молярная масса газа, — универсальная газовая постоянная,
— универсальная газовая постоянная, — абсолютная температура. Из барометрической формулы следует, что концентрация молекул
— абсолютная температура. Из барометрической формулы следует, что концентрация молекул  (или плотность газа) убывает с высотой по тому же закону:
(или плотность газа) убывает с высотой по тому же закону:
 — масса молекулы газа,
— масса молекулы газа,  — постоянная Больцмана.
— постоянная Больцмана.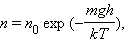 n – концентрация молекул на высоте h, n 0 – концентрация молекул на начальном уровне h = 0, m – масса частиц, g – ускорение свободного падения, k – постоянная Больцмана, T – температура.
n – концентрация молекул на высоте h, n 0 – концентрация молекул на начальном уровне h = 0, m – масса частиц, g – ускорение свободного падения, k – постоянная Больцмана, T – температура.
 , где
, где  — эффективное сечение молекулы,
— эффективное сечение молекулы, 
 ;
; 




