
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Постулаты Бора. Элементарная теория атома водорода по Бору.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
I постулат – стационарных орбит. II постулат – касается вопроса об излучении и поглощении энергии атома. I: -атомная система может находится только в особых стационарных (квантовых) состояниях -вращаясь по стационарной орбите, электрон не меняет своей энергии Из всевозможного числа орбит, разрешенных классической физикой, в действительности реализуются лишь орбиты, которые подчиняются условиям квантования.
Электроны, находящиеся на этих орбитах, энергию не излучают. Орбиты получили название стационарных. I постулат находится в противоречии: - с классической механикой, по которой энергия движения электронов может быть любой, - с электродинамикой Максвелла, которая не допускает возможность ускорение движения без излучения электромагнитных волн. II: излучение света происходит при переходе атома из стационарного состояния с большей энергией En в стационарное состояние с меньшей энергией Em.
Модель Бора хорошо объясняет линейчатые спектры атомов водорода. Атом испускает электромагнитное излучение при переходе электрона из стационарного с большей энергией En в стационарное состояние с меньшей энергией Em. h𝜐 =
При излучении света атом переходит из стационарного состояния с большей энергией в стационарное состояние с меньшей энергией. Поглощение и излучение света – взаимообратные процессы. Атом поглощает излучение той же самой частоты, которую излучил, переходя с верхнего уровня на нижний уровень. Теория атома по Бору. Запишем систему двух уравнений: - условие квантования момента импульса электрона - второй закон Ньютона Решая систему относительно радиусов орбит, получим: Радиусы боровских орбит меняются дискретно с изменением числа n.
Вычислим полную энергию электрона на стационарных орбитах (энергетических уровнях). Она складывается из кинетической и потенциальной энергий. Потенциальная энергия взаимодействия электрона и ядра: Кинетическая энергия: Полная энергия: Из II закона Ньютона:
Особенности энергетического спектра: 1. Энергия электрона в атоме – отрицательна. 2. Энергетический спектр – дискретен. 3. Энергетический спектр – сходящийся (к нулю).
1эВ=1,6*10^-19 Дж В основном состоянии (на уровне с энергией Е1) атом может находиться сколь угодно долго. Все остальные состояния - возбуждённые. «Время жизни» в этих состояниях =
Спектральные серии атома водорода: Теория Бора приводит к количественному согласию с экспериментом для значений частот, излучаемых атомом водорода. Все частоты излучений атома водорода образуют ряд серий, каждому из которых соответствует определенное значение m и различные значения n (n>m). В спектре атома водорода наблюдается 5 серий:
Постоянная Ридберга: R=3.3*10^15 Гц Серия Лаймана Данная серия образуется при переходе электрона с возбужденного энергетического уровня на первый.
Частоты этой серии относятся к ультрафиолетовой области спектра. Серия Бальмера
Данная серия образуется при переходе электрона с возбужденного энергетического уровня на второй. Частоты этой серии относятся к видимой области спектра. Серия Пашена
Инфракрасная область спектра. Достоинства и недостатки Теории Бора: Достоинства: -построила количественную теорию спектра атома водорода
-позволила сделать качественные заключения о водородоподобных атомах (иониз.атом гелия z=2, дважды иониз. атом лития z=3) Недостатки: -не удалось создать количественную теорию атомов -теория Бора не является последовательной классической теорией, а так же последовательной квантовой теорией, причиной этого является применение неклассических законов классической частицы, которая по теории считается электроном. Как показали опыты, наряду с корпускулярными свойствами, электрон в атоме водорода и в других атомных системах обладают и волновыми свойствами, т.е. электрону присущи корпускулярно-волновой дуализм, что не учитывается в теории.
|
||
|
Последнее изменение этой страницы: 2016-04-20; просмотров: 893; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.156 (0.01 с.) |


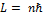




 - энергия излучения фотона
- энергия излучения фотона

 (
(


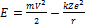




 – Энергия любого стационарного состояния
– Энергия любого стационарного состояния



 -возможные частоты излучения атома водорода всех серий (формула Ридберга)
-возможные частоты излучения атома водорода всех серий (формула Ридберга)



 -теоретические значения частот излучения полностью совпали с экспериментальными значениями
-теоретические значения частот излучения полностью совпали с экспериментальными значениями


