
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Спин электрона. Принцип паули. Распределение электронов по энергетическим уровням в многоэлектронном атоме.Содержание книги
Похожие статьи вашей тематики
Поиск на нашем сайте
Электрон, наряду с массой и зарядом, обладает еще одной характеристикой – свойством, а именно спиновым движением (спином). Спин: - собственный момент импульса частицы (электрона) - обозначается Ls - - Квантуется S – спиновое квантовое число, имеющее только одно значение: ½ (S=1/2) Собственный магнитный момент электрона:
C учетом всех четырех квантовых чисел, число возможных энергетических состояний электрона в атоме водорода и любом другом атоме равно 2n2, где n – главное квантовое число. Энергетический спектр атома водорода. Из решения уравнения Шредингера значения полной энергии электрона в атоме водорода зависят от 4-х квантовых чисел: E=E (n, l, m, s) n – главное квантовое число: 1,2,3… m – магнитное квантовое число: - l, …, 0, …, + l l – орбитальное квантовое число: 0, 1, 2, 3, n-1 s – спиновое квантовое число: ±1/2 Главное квантовое число определяет энергию стационарных состояний: Энергетические уровни с данным числом “n” расщепляются с учетом остальных квантовых чисел на подуровни. Если: n=1, то l=0 – данный уровень не расщепляется n=2, то l=0,1 – данный уровень расщепляется на 2 подуровня n=3, то l=0,1,2 – данный уровень расщепляется на 3 подуровня и т.д. Если атом внести в магнитное внешнее поле, то стационарные уровни расщепятся на ряд подуровней.
С учетом трех квантовых чисел уровень с заданным числом “n” расщепляются на n2 подуровней.
Состояния электрона с одинаковой энергией называются вырожденными. Число различных состояний с одинаковым значением энергии называется кратностью вырождения соответствующего энергетического уровня. С учетом спина, кратность вырождения определяется по формуле: 2 n=1 => кратность вырождения = 2 n=2 => =8 n=3 => =18 n=4 => =32 и т.д. Этим числам соответствует количество электронов, заполняющее соответствующие электронные оболочки. Принято обозначать оболочки так: n=1 оболочка К 1s2, n=2 оболочка L 1s22s6, n=3 оболочка M, n=4 оболочка N, n=5 оболочка O, n=6 оболочка P. Распределение электронов по энергетическим уровням в многоэлектронном атоме.
В сложных атомах, имеющих несколько электронов, каждый и них движется в усредненном электрическом поле ядра и остальных электронов. Заряд ядра для данного электрона будет в той или иной степени экранироваться другими электронами. Усредненное по времени результирующее поле можно считать центрально-симметричным (т.е. зависимым только от r). Но это поле не будет кулоновским (т.е. не пропорционально 1/r2). Тем не менее, решение уравнения Шредингера для электрона, движущегося в таком поле, дает результат, аналогичный результату для водородного атома. Атом любого элемента – нейтрален. Распределение электронов по энергетическим уровням подчиняется принципу Паули, согласно которому в одном и том же атоме не может быть двух электронов, обладающих одинаковой совокупностью всех четырех квантовых чисел. Схемы энергетических уровней всех атомов одинаковы: уровни с заданным главным квантовым числом n расщепляются на подуровни в зависимости от остальных квантовых чисел. Всего дозволенных энергетических состояний 2 Физическое строение атома соответственного положения: Состояние электрона в атоме описывается набором 4х квантовых чисел: n, l, m1(магнитное), ms(спиновое магнитное). Изменить состояние электрона – значит изменить хотя бы одно квантовое число. Электроны в атоме – неразличимые частицы. Они имеют одинаковые свойства: массу, эл.заряд, спин. Электроны тождественны друг другу. По закону квантовой физики, такие частицы различить нельзя, их нельзя пронумеровать и следить за какой-то отдельной частицей нельзя. Неразличимые частицы обязательно должны находиться в разных квантовых состояниях. Исходя из принципа Паули, в одном и том же атоме не может быть двух электронов, обладающих одинаковой совокупностью всех четырех квантовых чисел (т.е. в одном и том же состоянии не может находиться одновременно два электрона). Электроны заполняют энергетические уровни атома, начиная с уровня с наименьшим значением энергии, так как в состоянии равновесия атом должен иметь минимальное значение потенциальной энергии (общее условие равновесия систем). Принцип Паули дает объяснение периодичности повторения свойств атомов: Рассмотрим атом водорода, имеющего один электрон.
Если заряд ядра атома водорода увеличить на 1 и добавить еще один электрон, получится атом гелия. Третий электрон атома лития может занять уровень 2s в L-оболочке. Атом лития, имея один валентный электрон, с точки зрения химических свойств, будет повторять свойства атома водорода, имеющего так же один валентный электрон. Атом неона имеет полностью заполненную L-оболочку, следовательно, по своим свойствам будет подобен Гелию, у которого тоже заполнена оболочка. Поэтому свойства Гелия, Неона и др. инертных газов, объясняются полным заполнением электронами электронных оболочек атома. Периодичность свойств элементов/атомов определяется степенью заполнения электронных оболочек. Отступление от периодичности заполнения электронами электронных подоболочек начинается с 20-го элемента (от z=21 до z=30). Так как подоболочка 3d в этой N-оболочке при данной общей конфигурации оказывается энергетически выше подоболочки 4s. Поэтому сначала заполняется 4s подоболочка, а затем 3d.
|
||||||
|
Последнее изменение этой страницы: 2016-04-20; просмотров: 669; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.218.213.217 (0.011 с.) |

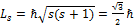

 Во внешнем магнитном поле спиновые моменты принимают две проекции:
Во внешнем магнитном поле спиновые моменты принимают две проекции: 


 Расщепление уровней с учетом магнитного квантового числа называется тонким расщеплением.
Расщепление уровней с учетом магнитного квантового числа называется тонким расщеплением. – Число возможных состояний
– Число возможных состояний



