
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Непредельные углеводороды. Этилен. Ацетилен.
А) Галогенирование СН2=СН2 + Cl2 => CH2Сl-CН2Cl СН2=СН-СН3 + Br2 => CH2Br-CНBr-CH3, эту реакцию можно использовать для определения двойной связи, т.к. происходит обесцвечивание бурого раствора бромной воды при н.у. Б) Гидрирование СН2=СН2 + Н2 => CH3-CН3 СН2=СН-СН3 + H2 => CH3-CН2-CH3 Реакция протекает по ионному механизму в несколько стадий. На первой стадии электрофильная частица (протон) взаимодействует с Ион водорода в реакциях электрофильного присоединения направляется к тому атому углерода при двойной связи, у которого больше отрицательный заряд. Распределение зарядов зависит от влияния заместителей. Если заместитель – углеводородный радикал, то электронная плотность смещена к более удаленному (и более гидрогенизированному) атому С. Если заместитель содержит электроотрицательный атом, то электронная плотность смещается к ближнему атому С. Этим и объясняется правило Марковникова: При присоединении полярных молекул к несимметричным алкенам водород присоединяется к более гидрогенизированному атому углерода при двойной связи. Например: В) Гидрогалогенирование СН2=СН2 + H/:Cl => CH3-CН2Cl СН2=СН-СН3 + HCl => CH3-CНCl-CH3 Г) Гидратация СН2=СН2 + H/-ОН => CH3-CН2ОН СН2=СН-СН3 + H2О => CH3-CНОН-CH3
3) Еще одной реакцией, характерной для непредельных углеводородов, является реакция полимеризации этилена (и др. алкенов). Она протекает в присутствии ионов водорода тоже по этому механизму, просто присоединяется не молекула водорода или воды, а такая же молекула этена: n СН2=СН2 n СН2=СН-R Нахождение в природе: Алкены в небольшом количестве входят в состав нефти. Получение алкенов. 1) В промышленности: реакция дегидрирования этана или другого соответствующего алкана при повышенной температуре в присутствии катализатора (оксида хрома) (крекинг попутного газа). СН3-СН3 → СН2=СН2+Н2 2)В лаборатории чаще получают из этанола (реакция дегидратации при нагревании в присутствии концентрированной серной кислоты) или другого соответствующего спирта, или из дигалоидпроизводных производных путем отщепления галогенов в присутствии активных металлов (магний) или моногалоидных производных путем отщепления галогеноводородов в спиртовом растворе щелочи. СН3-СН2ОН СН3-СН2Cl СН2Cl-СН2Cl
Применение. Алкены используют для получения полимеров, галогенпроизводных и спиртов. 4. Алкадиены или просто диены – это углеводороды, содержащие две двойные связи. Если эти двойные связи разделены двумя и более одинарными связями, тогда эти вещества ведут себя как обычные алкены. Если связи находятся рядом (С=С=С) – образуются т.н. аллены. Но наибольшее практическое значение имеют диены с сопряженными π-связями (разделенными одной σ-связью). В сопряженных диенах π-облака перекрываются между собой, образуя единое электронное облако на четыре атома углерода, двойные связи делокализованы. Поэтому при присоединении одной молекулы галогена реакция может проходить или с одной из двойных связей, или в крайние положения, а двойная связь образуется в центре сопряженной системы. В реакции полимеризации из таких диенов образуются полимеры, имеющие двойные связи. Они обладают повышенной эластичностью, водо- и газонепроницаемостью, называются такие полимеры - каучуки. Большую часть каучуков подвергают процессу вулканизации и превращают в резину. По своему значению для промышленности резина стоит рядом со сталью, углем, нефтью. Первый синтетический каучук (СК-1) синтезировал Сергей Лебедев ((1932 г) из бутадиена-1,3. Сам диен синтезировали из спирта - этанола. nСН2=СН-СН=СН2 → [-СН2-СН=СН-СН2-]n Существуют разные синтетические каучуки. Они превосходят натуральный по механической прочности, износостойкости, устойчивости к агрессивным средам… Но самой высокой эластичностью по-прежнему обладает натуральный каучук. Природный каучук - полимер стереорегулярного строения. Мономером является цис- 2-метилбутадиен-1,3 (изопрен), молекула полимера свернута в спираль, которая может растягиваться. Использование металлоорганических катализаторов позволило синтезировать каучук с таким же стереорегулярным расположением остатков цис- 2-метилбутадиен-1,3 как у натурального. Свойства у него такие же как у натурального, но чтобы их отличать, синтетический «натуральный» каучук называют изопреновым. 5. Алкины – углеводороды с одной тройной связью. Общая формула алкинов - CnH2n-2. Получение. 1) В лабораториях и промышленности ацетилен чаще всего получают из карбида кальция. Если кусочек карбида поместить в воду начинает выделяться газ. СаС2 + H2О → С2Н2 ↑+ Са(ОН)2 Но для получения карбида кальция надо затратить много энергии (реакция идет при 2000оС) СаО + 3С → СаС2 + СО Поэтому в промышленности для получения ацетилена стали использовать метан (термическое разложение при 1500оС, дегидрирование, см.выше). 5. Применение. Наибольшее применение из всех алкинов имеет ацетилен 1) сварка и резка металлов; 2) органический синтез: получение винилацетилена, а из него хлоропрена (каучук); получение галогенпроизводных, например, растворителя 1,1,2-трихлорэтена или хлорэтена (винилхлорида) из которого получают полимер поливинилхлорид (искусственная кожа, клеенка, изоляция проводов); получение уксусного альдегида, а из него уксусной кислоты. Задания для самостоятельной работы. 1. Прочитайте текст, найдите ответы на вопросы. 1) В чем особенность строения алкенов? 2) Как образуется двойная связь? 3) Какие реакции характерны для алкенов? Можно ли назвать алкены химически инертными? Почему? 4) Какие виды изомерии характерны для алкенов? 5) Что такое алкадиены? Приведите пример важнейшего природного соединения, которое относится к алкадиенам. 6) В чем особенность строения алкинов? 7) Как образуется тройная связь? 8) Какие реакции характерны для алкинов? Можно ли алкины назвать химически инертными? Почему? 9) Как часто встречаются непредельные углеводороды в природе? Почему? 10) Как получают непредельные углеводороды в промышленности и лаборатории? 2. Выполните упражнения. Упр. №1 Напишите структурные формулы. Какие из этих веществ относятся к алкенам? а) 3,3-диметилгексен-1; б) 2-метил-3-этилпентен-2; в) 3-метилбутан; г) хлорэтан; д) 1,3-дибромпропен; е) 4-метил-5-хлор-гексин-2; ж) пентен-1-ин-4; з) 2-метилбутадиен1,3. Упр. №2 Запишите уравнения реакций. Назовите образовавшиеся вещества, укажите условия реакций. а) хлорирования этена; б) гидрирования пропина; в) гидратации бетена-1; г) полимеризации пропена. д) бромирование этина; е) дегидрогалогенирование 1-хлорпропана; ж) дегалогенирование 1,2-дибромпентана; з) взаимодействие хлороводорода с бутеном-1.
Непредельные углеводороды. Этилен. Ацетилен. План. 1. Номенклатура алкенов. Изомерия двойной связи. 2. Состав и строение молекулы алкенов на примере этилена. 3. Свойства этилена и его гомологов. Понятие о полимерах. 4. Получение и применение. алкенов 5. Понятие о алкадиенах. Каучук натуральный и синтетический. 6. Номенклатура алкинов. Изомерия алкинов. 7. Состав и строение молекулы алкинов на примере ацетилена. 8. Свойства ацетилена и его гомологов. 9. Получение и применение.
1. Непредельными называют углеводороды, в которых есть хотя бы одна кратная (двойная или тройная) связь. Различают несколько гомологических рядов непредельных углеводородов: алкены, алкины, алкадиены и т.д. Алкены – углеводороды, в молекулах которых есть одна двойная связь. Общая формула - CnH2n.
Номенклатура и изомерия алкенов. Наличие двойной связи в молекуле указывается в названии заменой суффикса –ан в названии соответствующего алкана на суффикс –ен, после суффикса цифрой указывают номер атома углерода (меньший), около которого находится двойная связь. Например: СН3-СН2-СН=СН-СН3 –пентен-2.
Кроме изомерии углеродного скелета (см. предыдущую лекцию) для алкенов существует изомерия положения кратной связи. Например: CH3-CH2-CH=CH-CH3 u CH2=CH-CH2-CH2-CH3 Т.е. первая формула это пентен-2, а вторая – пентен-1. Что касается непредельных радикалов, то чаще всего встречается –СН=СН2. Он называется винил.
Т.е. порядок соединения атомов в молекуле этих изомеров одинаков (и у них одинаковые не только молекулярные, но и структурные формулы!), но в пространстве замещающие группы в молекулах изомеров располагаются по разному. В цис-изомерах заместители у разных атомов углерода находятся по одну сторону некоторой плоскости, в транс-изомерах заместители находятся по разные стороны некоторой плоскости. Например: цис-бутен-2 и транс-бутен-2
2.Строение этена. (Традиционное название этого вещества - этилен.) Простейший алкен имеет состав С2Н4. Как же тогда сохраняется 4-валентность углерода?
(С-С и С-Н). Связи направлены к вершинам правильного треугольника и угол между ними – 120о.
Структурную формулу этена записывают обычно СН2=СН2. Аналогичное строение имеют все остальные члены гомологического ряда этена. У них у всех два соседних атома углерода находятся в состоянии sp2-гибридизации и между ними образуется двойная связь (остальные все атомы – в sp3). Надо помнить, что несмотря на то что в структурной формуле мы рисует одинаковые черточки, это связи разные.
3. Характерные свойства алкенов. По своим физическим свойствам алкены - это вещества без цвета и запаха, с низкой температурой кипения и плавления (даже более низкой, чем соответствующие алканы). Этилен (этен) – газ, пропен и бутен – тоже, но с увеличением молекулярной массы гомологов температура кипения и плавления будет повышаться, и среди алкенов появятся жидкости (С5-С15) и твердые вещества (как и у алканов). В воде алкены нерастворимы, но растворимы в органических растворителях. Химические свойства. Алкены химически активны. 1) Легко окисляются. Горят на воздухе светящимся пламенем. СН2=СН2 + О2 → СО2+ H2О При мягком окислении (+ разб. раствор марганцовки при н.у.) из них образуются двухатомные спирты. СН2=СН2 + KMnO4 + H2О => СН2OH-СН2OH + MnO2↓ +KOH, эту реакцию можно использовать как качественную реакцию на двойную связь, т.к. исчезает характерная окраска раствора марганцовки и выпадает бурый осадок оксида марганца.
2) Характерной реакцией алкенов является реакция присоединения АЕ. А) Галогенирование СН2=СН2 + Cl2 => CH2Сl-CН2Cl СН2=СН-СН3 + Br2 => CH2Br-CНBr-CH3, эту реакцию можно использовать для определения двойной связи, т.к. происходит обесцвечивание бурого раствора бромной воды при н.у. Б) Гидрирование СН2=СН2 + Н2 => CH3-CН3 СН2=СН-СН3 + H2 => CH3-CН2-CH3 Реакция протекает по ионному механизму в несколько стадий. На первой стадии электрофильная частица (протон) взаимодействует с Ион водорода в реакциях электрофильного присоединения направляется к тому атому углерода при двойной связи, у которого больше отрицательный заряд. Распределение зарядов зависит от влияния заместителей. Если заместитель – углеводородный радикал, то электронная плотность смещена к более удаленному (и более гидрогенизированному) атому С. Если заместитель содержит электроотрицательный атом, то электронная плотность смещается к ближнему атому С. Этим и объясняется правило Марковникова: При присоединении полярных молекул к несимметричным алкенам водород присоединяется к более гидрогенизированному атому углерода при двойной связи. Например: В) Гидрогалогенирование СН2=СН2 + H/:Cl => CH3-CН2Cl СН2=СН-СН3 + HCl => CH3-CНCl-CH3 Г) Гидратация СН2=СН2 + H/-ОН => CH3-CН2ОН СН2=СН-СН3 + H2О => CH3-CНОН-CH3
3) Еще одной реакцией, характерной для непредельных углеводородов, является реакция полимеризации этилена (и др. алкенов). Она протекает в присутствии ионов водорода тоже по этому механизму, просто присоединяется не молекула водорода или воды, а такая же молекула этена: n СН2=СН2 n СН2=СН-R Нахождение в природе: Алкены в небольшом количестве входят в состав нефти. Получение алкенов. 1) В промышленности: реакция дегидрирования этана или другого соответствующего алкана при повышенной температуре в присутствии катализатора (оксида хрома) (крекинг попутного газа). СН3-СН3 → СН2=СН2+Н2 2)В лаборатории чаще получают из этанола (реакция дегидратации при нагревании в присутствии концентрированной серной кислоты) или другого соответствующего спирта, или из дигалоидпроизводных производных путем отщепления галогенов в присутствии активных металлов (магний) или моногалоидных производных путем отщепления галогеноводородов в спиртовом растворе щелочи. СН3-СН2ОН СН3-СН2Cl СН2Cl-СН2Cl
Применение. Алкены используют для получения полимеров, галогенпроизводных и спиртов. 4. Алкадиены или просто диены – это углеводороды, содержащие две двойные связи. Если эти двойные связи разделены двумя и более одинарными связями, тогда эти вещества ведут себя как обычные алкены. Если связи находятся рядом (С=С=С) – образуются т.н. аллены. Но наибольшее практическое значение имеют диены с сопряженными π-связями (разделенными одной σ-связью). В сопряженных диенах π-облака перекрываются между собой, образуя единое электронное облако на четыре атома углерода, двойные связи делокализованы. Поэтому при присоединении одной молекулы галогена реакция может проходить или с одной из двойных связей, или в крайние положения, а двойная связь образуется в центре сопряженной системы. В реакции полимеризации из таких диенов образуются полимеры, имеющие двойные связи. Они обладают повышенной эластичностью, водо- и газонепроницаемостью, называются такие полимеры - каучуки. Большую часть каучуков подвергают процессу вулканизации и превращают в резину. По своему значению для промышленности резина стоит рядом со сталью, углем, нефтью. Первый синтетический каучук (СК-1) синтезировал Сергей Лебедев ((1932 г) из бутадиена-1,3. Сам диен синтезировали из спирта - этанола. nСН2=СН-СН=СН2 → [-СН2-СН=СН-СН2-]n Существуют разные синтетические каучуки. Они превосходят натуральный по механической прочности, износостойкости, устойчивости к агрессивным средам… Но самой высокой эластичностью по-прежнему обладает натуральный каучук. Природный каучук - полимер стереорегулярного строения. Мономером является цис- 2-метилбутадиен-1,3 (изопрен), молекула полимера свернута в спираль, которая может растягиваться. Использование металлоорганических катализаторов позволило синтезировать каучук с таким же стереорегулярным расположением остатков цис- 2-метилбутадиен-1,3 как у натурального. Свойства у него такие же как у натурального, но чтобы их отличать, синтетический «натуральный» каучук называют изопреновым. 5. Алкины – углеводороды с одной тройной связью. Общая формула алкинов - CnH2n-2.
|
||||
|
Последнее изменение этой страницы: 2016-09-20; просмотров: 117; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.134.149 (0.01 с.) |
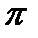 -электронами двойной связи и образует
-электронами двойной связи и образует  -связи между этим водородом и одним из атомов углерода. На второй стадии карбкатион взаимодействует с анионом и образуется вторая
-связи между этим водородом и одним из атомов углерода. На второй стадии карбкатион взаимодействует с анионом и образуется вторая  [-CH2-CH2-]n – полиэтилен, твердое полупрозрачное бесцветное вещество, жирное на ощупь.
[-CH2-CH2-]n – полиэтилен, твердое полупрозрачное бесцветное вещество, жирное на ощупь.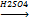 СН2=СН2+Н2О
СН2=СН2+Н2О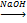 СН2=СН2+НCl
СН2=СН2+НCl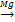 СН2=СН2+ Cl2
СН2=СН2+ Cl2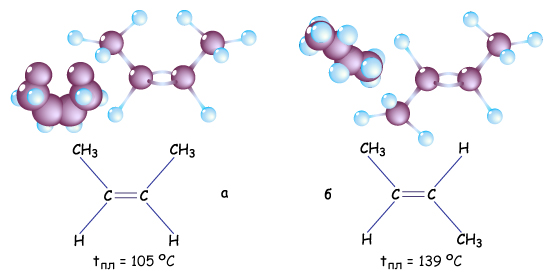 Кроме того у некоторых алкенов возможна и пространственная изомерия (цис-транс-изомерия).
Кроме того у некоторых алкенов возможна и пространственная изомерия (цис-транс-изомерия).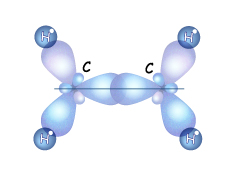 Атомы углерода в молекуле этена находятся в состоянии sp2-гибридизации.
Атомы углерода в молекуле этена находятся в состоянии sp2-гибридизации.
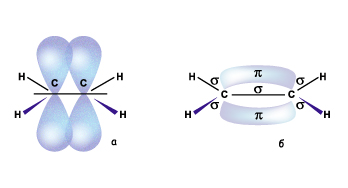 Эти треугольники образованные связями двух атомов углерода лежат в одной плоскости.
Эти треугольники образованные связями двух атомов углерода лежат в одной плоскости. 


