
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Агрегатное состояние веществаСодержание книги
Поиск на нашем сайте
В этой работе показана причина существования вещества в нескольких агрегатных состояниях. Дискретное строение вещества известно очень давно. Также очень давно известно, что свойства веществ определяются взаимодействием его молекул, но это древнее знание не используется в современной физике для определения агрегатного состояния вещества. Для определения агрегатного состояния вещества чаще всего используют или перечисление его внешних признаков вещества в различных агрегатных состояниях, или расплывчатые критерии, по которым нельзя определить, в каком агрегатном состоянии находится вещество. Максимум, что можно найти в учебниках по физике - это голословные, весьма размытые декларации типа «Существование у вещества нескольких агрегатных состояний обусловлено различиями в тепловом движении его молекул (атомов) и в их взаимодействии». При этом, вывести точные критерии агрегатного состояния вещества не очень сложно. Начнём с определений. «Агрегатные состояния вещества, состояния одного и того же вещества (например, воды, железа, серы), переходы между которыми сопровождаются скачкообразным изменением ряда физических свойств (плотности, энтропии и др.). Обычно рассматривают газообразное, жидкое и твёрдое агрегатные состояния (иногда ещё и плазменное). Существование у вещества нескольких агрегатных состояний обусловлено различиями в тепловом движении его молекул (атомов) и в их взаимодействии». [2] Ни в одном физическом определении не раскрыто, какое именно взаимодействие молекул определяет агрегатные состояния вещества. Сейчас для определения агрегатных состояний вещества используют приблизительные критерии, созданные исключительно для того, чтобы студенты задавали меньше вопросов, поскольку однозначно определить агрегатное состояние вещества по этим критериям невозможно. «Элементарная работа
Из анализа качественной зависимости потенциальной энергии взаимодействия молекул от расстояния между ними, (рис. 1) следует, что если молекулы находятся друг от друга на расстоянии, на котором межмолекулярные силы взаимодействия не действуют, ( Тогда, согласно (1), потенциальная энергия взаимодействия уменьшается, достигая минимума при Потенциальная энергия начинает тоже резко возрастать и становится положительной. Из данной потенциальной кривой следует, что система из двух взаимодействующих молекул в состоянии устойчивого равновесия ( Критерием различных агрегатных состояний вещества является соотношение между величинами Если Таким образом, любое вещество в зависимости от температуры может находиться в газообразном, жидком или твердом агрегатном состоянии, причём температура перехода из одного агрегатного состояния в другое зависит от значения Привязка агрегатного состояния вещества только к температуре, без учёта других факторов, физически не корректна. Агрегатное состояние вещества зависит также и от концентрации молекул, и от давления. Например, вода, в зависимости от давления, может находиться в жидком или газообразном состоянии в диапазоне температур от
|
||
|
Последнее изменение этой страницы: 2021-07-18; просмотров: 180; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.011 с.) |

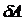 силы
силы 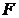 при увеличении расстояния между молекулами на
при увеличении расстояния между молекулами на 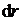 совершается за счет уменьшения взаимной потенциальной энергии молекул, т.е.
совершается за счет уменьшения взаимной потенциальной энергии молекул, т.е.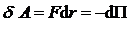 (1)
(1)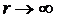 ), то
), то 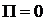 . При постепенном сближении молекул между ними появляются силы притяжения (
. При постепенном сближении молекул между ними появляются силы притяжения ( 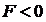 ), которые совершают положительную работу (
), которые совершают положительную работу ( 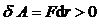 ).
).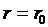 . При
. При 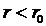 с уменьшением
с уменьшением 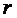 силы отталкивания (
силы отталкивания ( 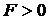 ) резко возрастают и совершаемая работа против них отрицательна (
) резко возрастают и совершаемая работа против них отрицательна ( 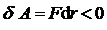 ).
).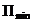 и
и 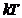 .
. 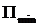 - наименьшая потенциальная энергия взаимодействия молекул определяет работу, которую нужно совершить против сил притяжения для того, чтобы разъединить молекулы, находящиеся в равновесии (
- наименьшая потенциальная энергия взаимодействия молекул определяет работу, которую нужно совершить против сил притяжения для того, чтобы разъединить молекулы, находящиеся в равновесии ( 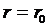 );
); 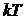 определяет удвоенную среднюю энергию, приходящуюся на одну степень свободы хаотического (теплового) движения молекул.
определяет удвоенную среднюю энергию, приходящуюся на одну степень свободы хаотического (теплового) движения молекул.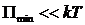 , то вещество находится в газообразном состоянии, так как интенсивное тепловое движение молекул препятствует соединению молекул, сблизившихся до расстояния
, то вещество находится в газообразном состоянии, так как интенсивное тепловое движение молекул препятствует соединению молекул, сблизившихся до расстояния 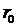 , т.е. вероятность образования агрегатов из молекул достаточно мала. Если
, т.е. вероятность образования агрегатов из молекул достаточно мала. Если 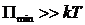 , то вещество находится в твердом агрегатном состоянии, так как молекулы, притягиваясь друг к другу, не могут удалиться на значительные расстояния и колеблются около положений равновесия, определяемого расстоянием
, то вещество находится в твердом агрегатном состоянии, так как молекулы, притягиваясь друг к другу, не могут удалиться на значительные расстояния и колеблются около положений равновесия, определяемого расстоянием 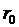 . Если
. Если 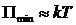 , то вещество находится в агрегатном состоянии жидкости, так как в результате теплового движения молекулы перемещаются в пространстве, обмениваясь местами, но не расходясь на расстояние, превышающее
, то вещество находится в агрегатном состоянии жидкости, так как в результате теплового движения молекулы перемещаются в пространстве, обмениваясь местами, но не расходясь на расстояние, превышающее 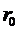 .
.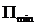 для данного вещества. Например, у инертных газов
для данного вещества. Например, у инертных газов 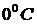 до
до 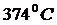 .
.


