
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Третье агрегатное состояние вещества - газСодержание книги
Поиск на нашем сайте
Существующее физическое определение агрегатного состояния газа является описательным, и не раскрывает причину существования вещества в этом агрегатном состоянии. «Газ - агрегатное состояние вещества, в котором кинетическая энергия теплового движения его частиц (молекул, атомов, ионов) значительно превосходит потенциальную энергию взаимодействий между ними, в связи с чем частицы движутся свободно, равномерно заполняя в отсутствие внешних полей весь предоставленный им объем».[2] В молекулярной физике есть приблизительный критерий, по которому это агрегатное состояние нельзя однозначно определить. «Если Привязка критерия агрегатного состояния газа только к температуре не даёт возможности однозначно определить это агрегатное состояние, так как не учитываются другие важные физические факторы, влияющие на агрегатное состояние - давление и концентрация молекул. Например, для воды температура фазового перехода жидкость - пар при давлении Агрегатное состояние вещества - газ принципиально отличается от твёрдого и жидкого агрегатных состояний вещества тем, что на графике изменения потенциальной энергий от расстояния, атомы (молекулы) вещества в этом агрегатном состоянии не находятся в потенциальной яме. В агрегатном состоянии газа свойства вещества определяются только графиком потенциального барьера. Поскольку в газе нет равновесного положения молекул, в газе нельзя рассматривать взаимодействие двух соседних молекул, совершающих регулярные осцилляции. В газе и паре необходимо рассматривать взаимодействие как минимум трёх молекул, причём одна молекула (№2) поочерёдно сталкивается с разными молекулами. При этом взаимодействие молекул носит случайный характер, а движение – хаотично. На (рис. 6) молекула №2 движется от молекулы №1, с которой уже произошло упругое столкновение, до молекулы №3, с которой столкновение предстоит. Величина свободного пробега молекулы №2 составляет Из графика хорошо видно макроскопическое свойство газа практически неограниченного расширения. При рассмотрении графика (рис.6) видно, что потенциальный барьер достаточно крутой, следовательно, газ может выдерживать значительное давление, но при этом происходит уменьшение расстояния между молекулами. На графике видно, что при уменьшении объема пара меньше критического, возможно попадание молекул в потенциальную яму. Этот физический феномен отличает состояние пара от состояния газа, в котором вещество ни при каком давлении не переходит в состояние жидкости.
Рис. 6 Взаимодействие молекул в газообразном агрегатном состоянии вещества.
График на рисунке 6 позволяет понять физический принцип существования вещества в агрегатном состоянии газа и вывести его физическое определение. «Газ - это такое состояние вещества, при котором его атомы (молекулы) не находятся в потенциальной яме». При этом следует помнить, что есть два различных состояния газа – пар и газ. В паре есть силы отталкивания и силы сжатия. Силы отталкивания в паре возникают от движения молекул, связанных с кинетической энергией. Силы притяжения возникают от потенциальной энергии взаимодействия молекул. Эти силы называются силами Ван – дер – Ваальса. Наличие этих сил позволяет веществу при сжатии перейти из газообразного состояния вещества в жидкость. Если при чтении возникают проблемы с открытием формул и рисунков, белые пятна молекулярной физики можно прочитать на http://sciteclibrary.ru/rus/catalog/pages/9456.html
ЛИТЕРАТУРА
1. Трофимова Т. И. Курс Физики. «Высшая школа». М.,1997. 2.Советский энциклопедический словарь. М., «Советская энциклопедия.» 1985. 3. Чертов А.Г. Физические величины. М., Высшая школа. 1990. 4. Дрюков В.М. Илюхина Н.И. Проектирование новых физических технологий. Вопросы оборонной техники. Научно - технический сборник. № 1-2. М:, Н.Т.Ц. «Информтехника» 1995. 5. Дрюков В.М. О чём молчат физики. Тула. 2004.
|
||
|
Последнее изменение этой страницы: 2021-07-18; просмотров: 141; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.008 с.) |

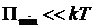 , то вещество находится в газообразном состоянии, так как интенсивное тепловое движение молекул препятствует соединению молекул, сблизившихся до расстояния
, то вещество находится в газообразном состоянии, так как интенсивное тепловое движение молекул препятствует соединению молекул, сблизившихся до расстояния  , т.е. вероятность образования агрегатов из молекул достаточно мала». [1]
, т.е. вероятность образования агрегатов из молекул достаточно мала». [1]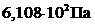 равняется
равняется 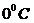 , а при давлении
, а при давлении 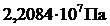 -
-  . Это означает, что в диапазоне температур от 0 до 374 градусов вода может находиться как в жидком, так и в газообразном состоянии, в зависимости от давления. Любой критерий, привязанный к температуре, не сможет однозначно ответить на основной вопрос, для которого он был выведен – в каком агрегатном состоянии находится вода. Такие же проблемы существуют и для всех остальных веществ.
. Это означает, что в диапазоне температур от 0 до 374 градусов вода может находиться как в жидком, так и в газообразном состоянии, в зависимости от давления. Любой критерий, привязанный к температуре, не сможет однозначно ответить на основной вопрос, для которого он был выведен – в каком агрегатном состоянии находится вода. Такие же проблемы существуют и для всех остальных веществ. . После столкновения с молекулой №3 молекула №2 будет двигаться к другой молекуле (№4) и т.д.
. После столкновения с молекулой №3 молекула №2 будет двигаться к другой молекуле (№4) и т.д.



