
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определение среднего коэффициента активностиСодержание книги
Поиск на нашем сайте Электролита методом потенциометрии Цель работы Усвоить теоретические сведения о природе электрохимического потенциала, влиянии ряда факторов на его величину; освоить методику экспериментального определения величины ЭДС гальванического элемента, составленного из стеклянного и хлоридсеребряного электродов в растворах хлороводородной кислоты; определить стандартную величину ЭДС используемого гальванического элемента и рассчитать значения среднего коэффициента активности растворов.
Вопросы коллоквиума 1. Физический смысл величины электродного потенциала. Стандартный электродный потенциал. Зависимость электродного потенциала от концентрации раствора электролита. Уравнение Нернста. 2. Гальванический элемент. Зависимость ЭДС гальванического элемента от концентрации электролита. Связь величины ЭДС гальванического элемента с термодинамическим потенциалом. 3. Типы электродов. 4. Примеры химических и концентрационных цепей. 5. Применение потенциометрического метода для определения коэффициента активности раствора электролита.
Приборы и реактивы
1. Учебно-лабораторный комплекс «Химия» в следующей комплектации: – центральный контроллер, – модуль «Электрохимия» в комплекте со стаканчиком (50см3), датчиком температуры, стеклянным и хлоридсеребряным электродами и шнурами для присоединения электродов; 2. Раствор соляной кислоты с известной концентрацией (0,1М), дистиллированная вода, раствор нитрата серебра (примерно 0,01М); 3. Две пипетки на 10 см3, лабораторная посуда. Методика выполнения работы и её обоснование Для определения среднего коэффициента активности электролита необходимо составить элемент, состоящий из электродов обратимых относительно катиона и аниона исследуемого электролита. Кроме того, чтобы исключить возникновение диффузионного потенциала, элемент не должен содержать жидкостной границы. Для определения среднего коэффициента активности раствора соляной кислоты можно использовать гальванический элемент, состоящий из хлоридсеребряного (ХСЭ) и стеклянного электродов. Ag | AgCl | HCl(aq) | стекло | HCl(0,1M) | AgCl | Ag, ЭДС этого гальванического элемента будет:
После небольших преобразований получим (3.1)
Для предельно разбавленного раствора
Обозначим Зная значение стандартной величины ЭДС, можно рассчитать средний коэффициент активности раствора соляной кислоты, используя уравнение (3.1).
Порядок выполнения работы 1. Перед проведением первого опыта поверхность серебряного электрода осторожно, но тщательно очищают лезвием от оксидов или сульфидов серебра, которые могли образоваться при хранении электродов. Вместо механической очистки можно обработать электрод концентрированным раствором аммиака (несколько минут). 2. Тщательно вымытый стаканчик на 50 см3 устанавливают в штатив модуля и помещают в него с помощью пипетки 20 см3 раствора соляной кислоты. В стаканчик вносят несколько капель раствора нитрата серебра для создания раствора насыщенного относительно ионов серебра (I) (это необходимо для получения хлоридсеребряного электрода, обратимого относительно хлорид-ионов). Далее в стаканчике устанавливают: серебряный и стеклянный электроды и один термодатчик 3. Подключение электродов и термодатчика производят согласно приложению. 4. После установления равновесия (3–5 минут) производят измерение ЭДС гальванического элемента и заносят полученное значение в таблицу. 5. Производят разбавление раствора соляной кислоты в два раза. Для этого, отбирают пипеткой 10 см3 раствора и помещают вместо него 10 см3 дистиллированной воды (целесообразно использовать две пипетки – одну для раствора, другую для воды). После установления равновесия (3–5 минут) производят измерение ЭДС гальванического элемента и заносят полученное значение в таблицу. 6. Повторяют разбавление с последующим измерением ЭДС 2–3 раза (согласно п.5). 7. Далее строят график в координатах у - С 1/2 и, экстраполируя зависимость до нулевой концентрации, определяют значение Е 0. 8. Вычисляют значения ln f ±и f ± для различных концентраций раствора HCl и данные заносят в таблицу и проводят сопоставление со справочными величинами.
Рекомендуемый вид таблицы
Работа № 4
|
|||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-11; просмотров: 238; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.214 (0.006 с.) |


 Учитывая, что Е° = Е°ст -Е°хсэ, получим
Учитывая, что Е° = Е°ст -Е°хсэ, получим
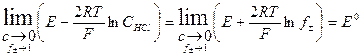
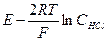 = y. Согласно теории Дебая - Хюккеля для разбавленных растворов должна наблюдаться прямолинейная зависимость в координатах у – C 1/2 . Таким образом, экстраполируя зависимость до нулевой концентрации, мы можем определить значение стандартной ЭДС используемого гальванического элемента.
= y. Согласно теории Дебая - Хюккеля для разбавленных растворов должна наблюдаться прямолинейная зависимость в координатах у – C 1/2 . Таким образом, экстраполируя зависимость до нулевой концентрации, мы можем определить значение стандартной ЭДС используемого гальванического элемента.


