
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Методика выполнения работы и ее обоснованиеСодержание книги
Поиск на нашем сайте
Лабораторной работе должен предшествовать опыт по определению постоянной сосуда для электрохимических измерений. Если работы выполняются на одной установке в течение одного лабораторного занятия, то достаточно этот опыт провести один раз. Определение постоянной сосуда (j) Постоянной сосуда является отношение расстояния между электродами (l) к площади каждого из электродов (S), используемых в электрохимической ячейке для измерения электропроводности раствора (L). Она определяется экспериментально. Для этого измеряют электрическую проводимость раствора (L), удельная электрическая проводимость которого известна. Обычно для этой цели используется 0,01 М раствор KCl. Значение k для этих растворов для заданной температуры берут из приложения. Тогда, для полученных значений k и R рассчитывают постоянную сосуда (j) по уравнению для удельной электропроводности k k = где Отсюда j = Сосуд для измерения вместе с электродами промывают дистиллированной водой и исследуемым раствором. Затем в сосуд помещают 20 см3 0,01 М раствора KCl, при этом электроды должны быть полностью покрыты раствором. Электроды сосуда подсоединяют к измерительной цепи и определяют его электрическую проводимость (L), после чего рассчитывают постоянную сосуда по уравнению (1.2). К равновесию, которое устанавливается в растворе слабого электролита между ионами и молекулами, можно применить законы химического равновесия и записать выражение константы равновесия. Например, для диссоциации уксусной кислоты CH3COOH «CH3COO– + H+ константа равновесия, выраженная через молярные концентрации реагентов имеет вид K = Константа равновесия процесса диссоциации слабого электролита называется константой диссоциации. Величина K зависит от природы электролита и растворителя, а также от температуры. Она характеризует способность данного электролита распадаться на ионы в растворе. Чем больше K, тем полнее диссоциирует электролит в растворе. Выражение для константы диссоциации слабого электролита через его начальную концентрацию (С) и степень диссоциации (a) имеет вид
K = Это уравнение для константы диссоциации выражает закон разведения Оствальда. Степень диссоциации электролита определяют по уравнению a = где l – молярная электропроводность раствора, l¥ – молярная электропроводность электролита при бесконечном разведении. Молярная электрическая проводимость l связана с удельной электрической проводимостью k соотношением l = Величину l¥ рассчитывают по справочным данным по уравнению l¥ = l¥+ + l¥–, (1.6) где l¥+ и l¥– – подвижности ионов при предельном разбавлении. Экспериментальные данные зависимости электропроводности разбавленного слабого электролита от его концентрации позволяют графически определять величины l¥ и K. Для этого уравнение (1.3) с использованием (1.4) приводят к линейному виду в координатах (
Построив график в указанных координатах и продолжив прямую линию графика до пересечения с осью ординат, находят значение l¥ как величину, обратную величине отрезка ординаты, отсекаемой линией графика, а K определяют из уравнения tg b = tg b определяется из треугольника как отношение противолежащего катета к прилежащему в масштабах осей графика (b – острый угол наклона линии зависимости к оси абсцисс).
Порядок выполнения работы
1. Определяют константу прибора (j) по методике, описанной выше. 2. В сосуд с электродами, отмытый дистиллированной водой, наливают 20 см3 указанного преподавателем раствора слабого электролита и измеряют его электропроводность (L). Результат заносят в таблицу. 3. Затем из сосуда отбирают 10 см3 дистиллированной воды, выдержанной при той же температуре, что и исследуемый раствор, т.е. разбавляют раствор в 2 раза. Определяют электропроводность полученного раствора. Эту операцию последовательного разбавления повторяют 4 раза, каждый раз измеряя электропроводность полученного раствора. Результаты заносят в таблицу. 4. Рассчитывают удельную электрическую проводимость (k) раствора для каждой из концентраций по уравнению (1.1).
5. Рассчитывают молярную электрическую проводимость (l) раствора для каждой концентрации исследуемого раствора по уравнению (1.5). 6. По уравнению (1.4) определяют степень диссоциации (a) для каждой концентрации исследуемого раствора. Молярную электрическую проводимость раствора электролита при его бесконечном разведении (l¥) рассчитывают по уравнению (1.6), взяв значения подвижностей ионов электролита в предельно разбавленном растворе (l¥+ и l¥–) из приложения. 7. Рассчитывают константу диссоциации (K) для каждой концентрации исследуемого раствора по уравнению (1.3). 8. Строят графики зависимости a, k и l от концентрации электролита в растворе. Анализируют, соответствует ли их характер теоретическим представлениям. 9. В соответствии с уравнением (1.7) строят график в координатах (
Рекомендуемый вид таблицы
Исследуемый раствор:
Работа № 2
|
||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-11; просмотров: 82; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.17.77.29 (0.007 с.) |

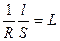 j, (1.1)
j, (1.1)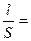 j – постоянная сосуда.
j – постоянная сосуда.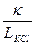 , см–1. (1.2)
, см–1. (1.2)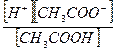 .
.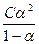 . (1.3)
. (1.3)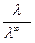 , (1.4)
, (1.4)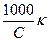 . (1.5)
. (1.5)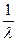 – l С):
– l С):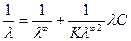 . (1.7)
. (1.7)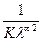 .
.


