Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Учебно-методические материалыСодержание книги
Поиск на нашем сайте
Содержание Общие методические указания…………………………………………………..4 Вопросы коллоквиума к разделу «Электрохимия»…………………………4 Учебно-методические материалы……………………………………………5 Лабораторные работы…………………………………………………………6 Работа № 1 Определение константы и степени диссоциации слабого электролита………………………………………………………6 Работа № 2 Определение растворимости и произведения растворимости малорастворимой соли………………………..10 Работа № 3 Определение среднего коэффициента активности электролита методом потенциометрии………………………..13 Работа № 4 Определение значений водородного показателя (рН) водных растворов……………………………………………….15 Работа № 5 Определение ЭДС гальванического элемента и потенциалов отдельных электродов в зависимости от концентрации растворов…………………………………….19 Приложения …………………………………………………………………..24
Общие методические указания
Физическая химия относится к числу фундаментальных дисциплин и является теоретической основой для повседневной практической деятельности современного химика. Изучение физической химии обеспечивает развитие и углубление знаний по химическим законам природы и является составной частью подготовки специалистов по фундаментальным наукам. Содержание курса обеспечивает формирование у студентов навыков анализа, управления и интенсификации хода химико-технологических процессов, обоснование выбора типа аппаратуры для проведения технологических процессов. Полученные при изучении курса сведения необходимы для успешной специализации выпускников ПГТУ как в области конкретных технологий, создания и аппаратурного оформления новых технологических процессов и их автоматизации, так и для выполнения научно-исследовательских работ. Предметом изучения и основными задачами физической химии являются предсказание временного хода химического процесса и конечного результата (состояния равновесия) в различных условиях на основании данных о строении и свойствах частиц веществ, составляющих изучаемую систему. Программа изучения дисциплины должна обеспечить приобретение знаний, умений и навыков в соответствии с ГОСами высшего профессионального образования. Основные виды учебных занятий по курсу физической химии слагаются из следующих элементов: посещение лекций и изучение лекционного материала; выполнение индивидуальных расчетных заданий; выполнение лабораторного практикума; индивидуальные консультации; сдача зачета по лабораторному практикуму; сдача экзамена по всему курсу. Электрохимия – это раздел физической химии, в котором изучают физико-химические свойства ионных систем, а также процессы и явления на границах раздела фаз с участием заряженных частиц (электронов или ионов) и молекул растворителя. Электрохимия состоит из двух частей. Теория растворов электролитов занимается изучением как равновесных, так и неравновесных свойств этих однофазных систем. Электрохимическая термодинамика и кинетика изучает общие условия равновесия на заряженных границах раздела фаз, строение этих границ, механизм и кинетические закономерности перехода заряженных частиц через межфазные поверхности.
Вопросы коллоквиума к разделу «Электрохимия»
1. Основные положения теории электролитической диссоциации 2. Сильные и слабые электролиты. Средний коэффициент активности. Правило ионной силы. 3. Степень и константа диссоциации слабых электролитов. Закон разведения Оствальда. 4. Теория растворов сильных электролитов. Предельный закон Дебая–Хюккеля. 5. Электрическая проводимость растворов электролитов. Удельная и молярная электрические проводимости. 6. Зависимость электрической проводимости растворов слабых и сильных электролитов от концентрации электролита. 7. Электрофоретическое и релаксационное торможение в растворах сильных электролитов. 8. Подвижность ионов и числа переноса. 9. Скачки потенциалов на границах фаз. Двойной электрический слой. 10. ЭДС гальванического элемента. Вывод уравнения Нернста. 11. Методы измерения ЭДС. Зависимость ЭДС от температуры. 12. Типы электродов, используемых в потенциометрии. Определение потенциала электрода. 13. Электрохимические цепи. Связь ЭДС электрохимического элемента с термодинамическими параметрами системы. 14. Элементы кинетики электрохимических реакций. Перенапряжение. Уравнение Тафеля.
Литература основная 1. Стромберг А.Г., Семченко Д.П. Физическая химия. М.: Высш. шк., 2003. 527 с. 2. Жуховицкий А.А., Шварцман Л.А. Физическая химия. М.: Металлургия, 2001. 668 с. 3. Вольхин В.В. Общая химия. В 3-х кн. Кн. 1. Основной курс. Пермь: Перм. гос. техн. ун-т, 2006. 464 с. 4. Краснов К.С., Воробьев Н.К., Годнев И.Н. и др. Физическая химия. В 2-х кн. Кн. 2. Электрохимия. Химическая кинетика и катализ. М.: Высш. шк., 2001. 319 с. 5. Каретников Г.С., Кудряшов И.В. Сборник примеров и задач по физической химии. М.: Высш. шк., 1998. 527 с. 6. Еремин В.В., Каргов С.И., Успенская И.А. и др. Задачи по физической химии. М.: Экзамен, 2003. 320 с. 7. Практикум по физической химии. Под ред. Горбачева С.В., М.: Высш. шк., 1995. 8. Голиков Г.А. Руководство по физической химии. М.: Высш. шк., 1988. 383 с. 9. Краткий справочник физико-химических величин. Под ред. Равделя А.А., Пономаревой А.М. СПб.: Специальная литература, 1998. 232 с. 10. Методические руководства к лабораторным работам. Колл. препод. кафедры АФХ, Пермь: Перм. гос. техн. ун-т, 1988–1998.
Литература дополнительная 1. Фролов Ю.Г., Белик В.В. Физическая химия. М.: Химия, 1993. 464 с. 2. Киреев В.Д. Курс физической химии. М.: Химия, 1985. 3. Курс физической химии. т. 3. Под ред. Герасимова Я.И. М.: Химия, 1973. 416 с. 4. Эткинс П. Физическая химия. т. 2, М.: Мир, 1980. 584 с. 5. Даниэльс Ф., Олберти Р. Физическая химия. М.: Мир, 1978. 645 с. 6. Практикум по физической химии. Под ред. Мищенко К.П. Л.: Химия, 1988. 7. Антропов Л.И. Теоретическая электрохимия. М.: Высш. шк., 1984. 519 с. 8. Багоцкий В.С. Основы электрохимии. М.: Химия, 1988. 400 с. 9. Корыта И., Дворжак И., Богачкова В. Электрохимия. М.: Мир, 1977. 472 с.
Лабораторные работы
Работа № 1
Цель работы
Исследовать электрические свойства растворов слабых электролитов, рассчитать удельную и молярную электрические проводимости, степень диссоциации и константу диссоциации электролита в растворе. Проверить, подчиняется ли раствор данного вещества закону разведения Оствальда.
Вопросы коллоквиума
1. Растворы электролитов. Теория электролитической диссоциации. Сильные и слабые электролиты. Закон Оствальда. 2. Удельная электрическая проводимость. Зависимость удельной электрической проводимости сильных и слабых электролитов от концентрации и температуры. 3. Эквивалентная и молярная электропроводности. Зависимость эквивалентной и молярной электропроводностей сильных и слабых электролитов от концентрации. Электропроводность при бесконечном разведении. 4. Определение постоянной электрохимического сосуда при измерении сопротивления раствора. 5. Кондуктометрия и ее практическое применение. 6. Порядок выполнения работы и обработки экспериментальных данных.
Приборы и реактивы
1. Учебно – лабораторный комплекс «Химия» в комплектации: – центральный контроллер; – модуль «электрохимия» в комплекте с двумя стаканами (50 см3), двумя электродами в одной обойме для кондуктометрических измерений; 0,01 М раствор KCl; 2. Растворы слабых электролитов с концентрацией 0,01 М (уксусная кислота, муравьиная кислота, гидроксид аммония); 3. Мерный цилиндр на 25 см3; 4. Пипетки на 10 и 20 см3; 5. Дистиллированная вода; 6. Лабораторная посуда.
Порядок выполнения работы
1. Определяют константу прибора (j) по методике, описанной выше. 2. В сосуд с электродами, отмытый дистиллированной водой, наливают 20 см3 указанного преподавателем раствора слабого электролита и измеряют его электропроводность (L). Результат заносят в таблицу. 3. Затем из сосуда отбирают 10 см3 дистиллированной воды, выдержанной при той же температуре, что и исследуемый раствор, т.е. разбавляют раствор в 2 раза. Определяют электропроводность полученного раствора. Эту операцию последовательного разбавления повторяют 4 раза, каждый раз измеряя электропроводность полученного раствора. Результаты заносят в таблицу. 4. Рассчитывают удельную электрическую проводимость (k) раствора для каждой из концентраций по уравнению (1.1). 5. Рассчитывают молярную электрическую проводимость (l) раствора для каждой концентрации исследуемого раствора по уравнению (1.5). 6. По уравнению (1.4) определяют степень диссоциации (a) для каждой концентрации исследуемого раствора. Молярную электрическую проводимость раствора электролита при его бесконечном разведении (l¥) рассчитывают по уравнению (1.6), взяв значения подвижностей ионов электролита в предельно разбавленном растворе (l¥+ и l¥–) из приложения. 7. Рассчитывают константу диссоциации (K) для каждой концентрации исследуемого раствора по уравнению (1.3). 8. Строят графики зависимости a, k и l от концентрации электролита в растворе. Анализируют, соответствует ли их характер теоретическим представлениям. 9. В соответствии с уравнением (1.7) строят график в координатах (
Рекомендуемый вид таблицы
Исследуемый раствор:
Работа № 2 Цель работы Определить растворимость и произведение растворимости соли, используя данные, полученные методом кондуктометрии.
Вопросы коллоквиума 1. Растворы электролитов. Теория электролитической диссоциации. Сильные и слабые электролиты. Закон Оствальда. 2. Удельная электрическая проводимость. Зависимость удельной электрической проводимости сильных и слабых электролитов от концентрации и температуры. 3. Эквивалентная и молярная электропроводность. Электропроводность при бесконечном разведении. Подвижности ионов. 4. Активность электролита. Коэффициент активности. Ионная сила раствора. 5. Кондуктометрический метод анализа. Определение растворимости электролита.
Приборы и реактивы 1. Учебно – лабораторный комплекс «Химия» в комплектации: – центральный контроллер; – модуль «электрохимия» в комплекте с двумя стаканами (50 см3), двумя электродами в одной обойме для кондуктометрических измерений; 2. 0,01 М раствор KCl; 3. Насыщенные растворы малорастворимых солей щелочноземельных элементов (CaSO4, CaCO3, BaSO4, BaCO3 и др.); 4. Мерный цилиндр на 25 см3; 5. Бидистиллированная вода; 6. Лабораторная посуда.
Порядок выполнения работы 1. Определяют константу прибора j по методике, описанной выше. 2. Определяют удельную электропроводность воды. Для этого 20 см3 дважды перегнанной воды помещают в сосуд для кондуктометрических измерений. Измеряют электропроводность воды и рассчитывают ее удельную электропроводность (kводы) по уравнению (2.7). 3. Измеряют электропроводность насыщенного раствора соли. Для этого раствор слегка взбалтывают; 20 см3 мутного, но без осадка, раствора переносят в измерительный сосуд. Дождавшись осветления раствора, производят измерение его сопротивления. Рассчитывают удельную электропроводность раствора соли (kсоли) по уравнению (2.7), растворимость соли по уравнению (2.3) и произведение растворимости по уравнению (2.6). 4. Экспериментальные и расчетные данные заносят в таблицу. Полученный результат сопоставляют со справочным значением произведения растворимости данной соли.
Рекомендуемый вид таблицы Электролит: Температура опыта:
Работа № 3 Цель работы Усвоить теоретические сведения о природе электрохимического потенциала, влиянии ряда факторов на его величину; освоить методику экспериментального определения величины ЭДС гальванического элемента, составленного из стеклянного и хлоридсеребряного электродов в растворах хлороводородной кислоты; определить стандартную величину ЭДС используемого гальванического элемента и рассчитать значения среднего коэффициента активности растворов.
Вопросы коллоквиума 1. Физический смысл величины электродного потенциала. Стандартный электродный потенциал. Зависимость электродного потенциала от концентрации раствора электролита. Уравнение Нернста. 2. Гальванический элемент. Зависимость ЭДС гальванического элемента от концентрации электролита. Связь величины ЭДС гальванического элемента с термодинамическим потенциалом. 3. Типы электродов. 4. Примеры химических и концентрационных цепей. 5. Применение потенциометрического метода для определения коэффициента активности раствора электролита.
Приборы и реактивы
1. Учебно-лабораторный комплекс «Химия» в следующей комплектации: – центральный контроллер, – модуль «Электрохимия» в комплекте со стаканчиком (50см3), датчиком температуры, стеклянным и хлоридсеребряным электродами и шнурами для присоединения электродов; 2. Раствор соляной кислоты с известной концентрацией (0,1М), дистиллированная вода, раствор нитрата серебра (примерно 0,01М); 3. Две пипетки на 10 см3, лабораторная посуда. Методика выполнения работы и её обоснование Для определения среднего коэффициента активности электролита необходимо составить элемент, состоящий из электродов обратимых относительно катиона и аниона исследуемого электролита. Кроме того, чтобы исключить возникновение диффузионного потенциала, элемент не должен содержать жидкостной границы. Для определения среднего коэффициента активности раствора соляной кислоты можно использовать гальванический элемент, состоящий из хлоридсеребряного (ХСЭ) и стеклянного электродов. Ag | AgCl | HCl(aq) | стекло | HCl(0,1M) | AgCl | Ag, ЭДС этого гальванического элемента будет:
После небольших преобразований получим (3.1)
Для предельно разбавленного раствора
Обозначим Зная значение стандартной величины ЭДС, можно рассчитать средний коэффициент активности раствора соляной кислоты, используя уравнение (3.1).
Порядок выполнения работы 1. Перед проведением первого опыта поверхность серебряного электрода осторожно, но тщательно очищают лезвием от оксидов или сульфидов серебра, которые могли образоваться при хранении электродов. Вместо механической очистки можно обработать электрод концентрированным раствором аммиака (несколько минут). 2. Тщательно вымытый стаканчик на 50 см3 устанавливают в штатив модуля и помещают в него с помощью пипетки 20 см3 раствора соляной кислоты. В стаканчик вносят несколько капель раствора нитрата серебра для создания раствора насыщенного относительно ионов серебра (I) (это необходимо для получения хлоридсеребряного электрода, обратимого относительно хлорид-ионов). Далее в стаканчике устанавливают: серебряный и стеклянный электроды и один термодатчик 3. Подключение электродов и термодатчика производят согласно приложению. 4. После установления равновесия (3–5 минут) производят измерение ЭДС гальванического элемента и заносят полученное значение в таблицу. 5. Производят разбавление раствора соляной кислоты в два раза. Для этого, отбирают пипеткой 10 см3 раствора и помещают вместо него 10 см3 дистиллированной воды (целесообразно использовать две пипетки – одну для раствора, другую для воды). После установления равновесия (3–5 минут) производят измерение ЭДС гальванического элемента и заносят полученное значение в таблицу. 6. Повторяют разбавление с последующим измерением ЭДС 2–3 раза (согласно п.5). 7. Далее строят график в координатах у - С 1/2 и, экстраполируя зависимость до нулевой концентрации, определяют значение Е 0. 8. Вычисляют значения ln f ±и f ± для различных концентраций раствора HCl и данные заносят в таблицу и проводят сопоставление со справочными величинами.
Рекомендуемый вид таблицы
Работа № 4 Цель работы Усвоить теоретические положения, лежащие в основе потенциометрического метода измерения ЭДС, связь между термодинамическими соотношениями ЭДС электрохимических цепей и физико-химическими параметрами растворов и химических реакций; освоить методики экспериментального определения величины ЭДС гальванических элементов, составленных из стеклянного и хлоридсеребряного электродов, хингидронного и хлоридсеребряного электродов; определить величины ЭДС используемых гальванических элементов и применить эти гальванические элементы для определения рН растворов.
Вопросы коллоквиума 1. Водородный показатель среды – рН. Определение рН сильных и слабых электролитов. 2. Понятие электродного потенциала. Стандартный электродный потенциал. 3. Типы электродов. 4. Зависимость электродного потенциала от внешних факторов. Уравнение Нернста (вывод и расчеты по уравнению). 5. Гальванический элемент. ЭДС гальванического элемента. 6. Химические и концентрационные цепи. 7. Потенциометрия. Применение потенциометрического метода для определения характеристик растворов.
Приборы и реактивы
1. Учебно-лабораторный комплекс «Химия» в следующей комплектации: – центральный контроллер, – модуль «Электрохимия» в комплекте со стаканчиком (50см3), датчиком температуры, стеклянным, хлоридсеребряным, платиновым или золотоуглеродистым электродами и шнурами для присоединения электродов; 2. Буферный раствор с известным значением рН и растворы, рН которых требуется определить, хингидрон, дистиллированная вода.
Порядок выполнения работы
1. Тщательно вымытый стаканчик на 50 см3 устанавливают в штатив модуля и наливают в него примерно 40 см3 заранее приготовленного буферного раствора (рекомендуется стаканчик и электроды предварительно ополоснуть буферным раствором). Стаканчик закрывают крышкой и устанавливают стеклянный и хлоридсеребрянный электроды и термодатчик. 2. Подключают электроды и термодатчик. 3. После установления равновесия (равновесие устанавливается в течение 3–5 минут) производят измерение ЭДС составленного гальванического элемента. 4. Повторяют опыт с другими приготовленными растворами. Полученные данные заносят в таблицу. 5. Заменяют стеклянный электрод на платиновый или золотоуглеродистый и повторяют всю серию опытов (согласно п. 1–4) с той лишь разницей, что в каждый раствор добавляют небольшое количество хингидрона. (Время установления равновесия после добавления хингидрона составляет примерно 2–3 минуты). 6. Проводят расчет значений pH растворов, полученных двумя способами и сравнивают результаты расчетов между собой.
Рекомендуемый вид таблицы
Работа № 5
Цель работы Усвоить теоретические сведения о природе электрохимического потенциала, влиянии ряда факторов на его величину; освоить методику экспериментального определения величины ЭДС гальванического элемента и потенциалов отдельных электродов; изучить зависимость потенциала электрода от концентрации электролита; сравнить полученные данные с теоретическими расчетами.
Вопросы коллоквиума 1. Причины возникновения скачка потенциала на границе проводник первого рода – электролит. 2. Физический смысл величины электродного потенциала. Стандартный электродный потенциал. Связь величины ЭДС гальванического элемента с термодинамическим потенциалом. 3. Зависимость электродного потенциала и ЭДС гальванического элемента от концентрации электролита (уравнение Нернста). Вывод уравнения Нернста. 4. Типы электродов. 5. Концентрационные гальванические элементы.
Приборы и реактивы
1. Потенциометр постоянного тока P 363; 2. Насыщенный раствор KCl; 3. Соли для приготовления электролита (CuSO4 ∙5H2O, ZnSO4∙7H2O); 4. Сосуды для электродов – 2шт., электроды (медный и цинковый) с присоединенными к ним проводниками – 2 шт.; 5. Мерные цилиндры на 100 см3 – 2 шт., лабораторная посуда. Порядок выполнения работы
1. В соответствии полученным заданием готовят исходные растворы электролитов для полуэлементов гальванической ячейки. На аналитических весах взвешивают заданное количество соли, помещают ее в колбу или стакан и заливают рассчитанным и отмеренным мерным цилиндром количеством дистиллированной воды. Перемешивая стеклянной палочкой, растворяют соль и получают раствор. 2. Берут электроды и зачищают их наждачной бумагой. Промывают водой. 3. Взяв ячейку полуэлемента в левую руку таким образом, чтобы сильфон ячейки был сверху, а сосуд наклонен отверстием ячейки вправо, заливают раствор электролита на ¾ объема ячейки. Не изменяя положение ячейки, вставляют электрод в ячейку и небольшим усилием, покручивая под углом, вводят пробку в ячейку. Чтобы убедиться что пробка хорошо закрывает ячейку, наклоняют ее и, смотрят, весь ли периметр пробки смочен раствором. После этого полуэлемент ставят вертикально и подносят носик сильфона к цилиндру. 4. Если сильфон полуэлемента не заполнен электролитом, посредством зажима необходимо разгерметизировать ячейку и ввести небольшое количество воздуха. Разряжение в сосуде уменьшится, и сильфон будет наполнен раствором. Полуэлемент устанавливают в подставку таким образом, чтобы сильфон был погружен в стакан с хлористым калием, и носик его находился в растворе хлористого калия. Таким же образом готовят второй полуэлемент. 5. Присоединяют клеммы проводников от электродов к потенциометру, пользуясь руководством для работы с потенциометром. 6. При определении потенциалов отдельных электродов составляют гальванический элемент полуэлемента исследуемого и вспомогательного электродов. Вспомогательный электрод помещают в стакан с хлористым калием. 7. Подсоединяют проводники измеряемого и вспомогательного электродов к клеммам X1, (убрав один из электродов от клеммы) и проводят измерение ЭДС вновь собранного гальванического элемента (измеряемый электрод – вспомогательный электрод). 8. Закончив все измерения с данной концентрацией электролита в полуэлементах, отсоединяют от клеммы X1 тот полуэлемент, в котором необходимо сменить электролит. 9. Промывают электрод водой, зачищают снова наждачной бумагой и еще раз промывают. 10. Готовят новый раствор электролита путем разбавления исходного и, аналогично п.3, готовят полуэлемент с другой концентрацией электролита. 11. Собирают из полуэлементов гальваническую ячейку и измеряют ЭДС этого гальванического элемента. 12. Полученные при измерении потенциалы отдельных электродов относительно хлоридсеребряного электрода (ХСЭ) пересчитывают относительно водородного электрода. Если исследуемый электрод подсоединен к клемме “+”, а хлоридсеребряный к “–“, то выполняется уравнение
где Если исследуемый электрод присоединен к клемме “–“, а ХСЭ электрод к клемме “+ ‘’, то выполняется уравнение
13. По уравнению Нернста рассчитывают потенциалы отдельных электродов для различных концентраций с учетом активностей ионов в растворе. 14. Зная рассчитанные значения потенциалов отдельных электродов, рассчитывают ЭДС гальванического элемента для различных концентраций E расч. = E катода – E анода. 15. Данные заносят в таблицу.
Рекомендуемый вид таблицы
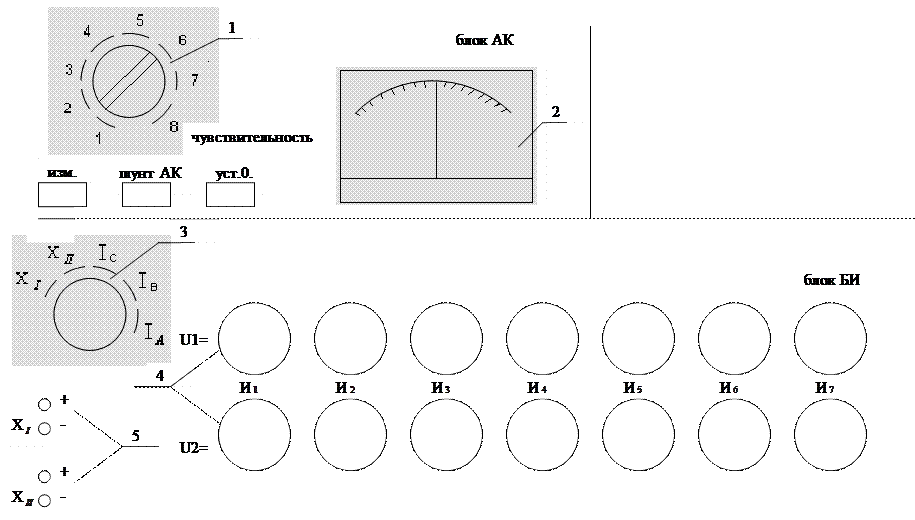
Рис. Схема потенциометра:1–переключатель чувствительности; 2 – выходной прибор; 3 – переключатель рода работы; 4 – декадные переключатели; 5 – клеммы. Приложения В водных растворах
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-11; просмотров: 118; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.44.46 (0.018 с.) |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

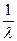 – l С). Определяют из графика l¥ и K. Анализируя значения K для каждой из концентраций раствора, решают вопрос о зависимости или независимости K от концентрации раствора. Сравнивают среднее значение K со справочным.
– l С). Определяют из графика l¥ и K. Анализируя значения K для каждой из концентраций раствора, решают вопрос о зависимости или независимости K от концентрации раствора. Сравнивают среднее значение K со справочным.
 Учитывая, что Е° = Е°ст -Е°хсэ, получим
Учитывая, что Е° = Е°ст -Е°хсэ, получим
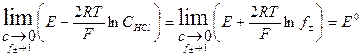
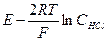 = y. Согласно теории Дебая - Хюккеля для разбавленных растворов должна наблюдаться прямолинейная зависимость в координатах у – C 1/2 . Таким образом, экстраполируя зависимость до нулевой концентрации, мы можем определить значение стандартной ЭДС используемого гальванического элемента.
= y. Согласно теории Дебая - Хюккеля для разбавленных растворов должна наблюдаться прямолинейная зависимость в координатах у – C 1/2 . Таким образом, экстраполируя зависимость до нулевой концентрации, мы можем определить значение стандартной ЭДС используемого гальванического элемента.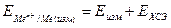 ,
,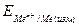 – потенциал электрода относительно стандартного водородного электрода;
– потенциал электрода относительно стандартного водородного электрода;  – потенциал хлоридсеребряного электрода относительно стандартного водородного электрода. Потенциал ХСЭ электрода принимают равным 197мВ.
– потенциал хлоридсеребряного электрода относительно стандартного водородного электрода. Потенциал ХСЭ электрода принимают равным 197мВ. 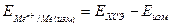 .
.