
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Методика выполнения работы и ее обоснованиеСодержание книги
Поиск на нашем сайте
Растворимость соли C (моль×дм–3) – это ее равновесная молярная концентрация в насыщенном растворе. В случае малорастворимой соли ее растворимость в единицах молярной концентрации можно рассчитать, измерив электрическую проводимость насыщенного раствора такой соли по уравнению: C = Молярная электрическая проводимость такого раствора (l) практически равна молярной проводимости его при бесконечном разведении (l¥), вследствие малой концентрации электролита в растворе. Величину l¥ можно рассчитать по справочным данным, используя уравнение l¥ = l+¥ + l–¥ (2.2) Вместо удельной электрической проводимости соли (kсоли) используют разность (kр–ра – kводы), так как проводимости воды (kводы) и раствора (kр–ра) в этом случае соизмеримы. Таким образом, определив величину l¥ и удельные электрические проводимости воды и раствора исследуемой соли, можно вычислить растворимость соли по уравнению C = Зная растворимость соли, определяют ее произведение растворимости (KS), то есть константу равновесия гетерогенной реакции растворения малорастворимой соли: Mn+An– (тв.) «n+Mz+(aq) + n–Az–(aq). (2.4) Константа равновесия такой реакции, называемая произведением растворимости соли, равна: KS = a + n+× a – n–, (2.5) где a + и a – – активности катиона и аниона в растворе, n+ и n– – число катионов и анионов в составе электролита. Если в растворе отсутствуют электролиты, содержащие ионы исследуемой соли и практически полностью отсутствуют другие электролиты, то, учитывая малую растворимость соли, можно перейти от активностей компонентов к их концентрациям. Тогда из уравнения (2.5) получаем: KS = C + n+× C – n–. Исходя из (2.4) концентрация катионов C + = n+ C и анионов C – = n– C. Тогда получаем: KS = C nn+n+n–n–, (2.6) где n+ + n– = n, С – молярная концентрация соли в исследуемом растворе (растворимость соли). Таким образом, произведение растворимости малорастворимой соли определяется концентрацией насыщенного раствора этой соли и числом ее ионов в растворе. Например: 1. AgCl «Ag+ + Cl–; n+ = 1; n– = 1; n = 2; KS = C 2×11×11 = C 2. 2. MgSO4 «Mg2+ + SO4 2–; n+ = 1; n– = 1; n = 2; KS = C 2×11×11 = C 2. 3. CaCl2 «Ca2+ + 2Cl–; n+ = 1; n– = 2; n = 3; KS = C 3×22×11 = 4 C 3. 4. Ca3(PO4)2 «3Ca2+ + 2PO4 2–; n+ = 3; n– = 2; n = 5; KS = C 5×33×22 = 108 C 5.
Лабораторной работе должен предшествовать опыт по определению постоянной сосуда для электрохимических измерений. Если работы выполняются на одной установке в течение одного лабораторного занятия, то достаточно этот опыт провести один раз. Определение постоянной сосуда (j) Постоянной сосуда является отношение расстояния между электродами (l) к площади каждого из электродов (S), используемых в электрохимической ячейке для измерения электропроводности раствора (L). Она определяется экспериментально. Для этого измеряют электрическую проводимость раствора (L), удельная электрическая проводимость которого известна. Обычно для этой цели используется 0,01 М раствор KCl. Значение k для этих растворов для заданной температуры берут из приложения. Тогда, для полученных значений k и R рассчитывают постоянную сосуда (j) по уравнению для удельной электропроводности k k = где Отсюда j = Сосуд для измерения вместе с электродами промывают дистиллированной водой и исследуемым раствором. Затем в сосуд помещают 20 см3 0,01 М раствора KCl, при этом электроды должны быть полностью покрыты раствором. Электроды сосуда подсоединяют к измерительной цепи и определяют его электрическую проводимость (L), после чего рассчитывают постоянную сосуда по уравнению (2.8).
Порядок выполнения работы 1. Определяют константу прибора j по методике, описанной выше. 2. Определяют удельную электропроводность воды. Для этого 20 см3 дважды перегнанной воды помещают в сосуд для кондуктометрических измерений. Измеряют электропроводность воды и рассчитывают ее удельную электропроводность (kводы) по уравнению (2.7). 3. Измеряют электропроводность насыщенного раствора соли. Для этого раствор слегка взбалтывают; 20 см3 мутного, но без осадка, раствора переносят в измерительный сосуд. Дождавшись осветления раствора, производят измерение его сопротивления. Рассчитывают удельную электропроводность раствора соли (kсоли) по уравнению (2.7), растворимость соли по уравнению (2.3) и произведение растворимости по уравнению (2.6). 4. Экспериментальные и расчетные данные заносят в таблицу. Полученный результат сопоставляют со справочным значением произведения растворимости данной соли.
Рекомендуемый вид таблицы Электролит: Температура опыта:
Работа № 3
|
||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-11; просмотров: 82; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.188.218.134 (0.006 с.) |

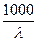 kсоли. (2.1)
kсоли. (2.1) 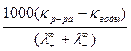 , моль×дм–3. (2.3)
, моль×дм–3. (2.3)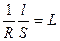 j, (2.7)
j, (2.7)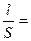 j – постоянная сосуда.
j – постоянная сосуда.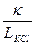 , см–1. (2.8)
, см–1. (2.8)


