
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Методика выполнения работы и её обоснованиеСодержание книги
Поиск на нашем сайте
В настоящее время кислотность среды принято выражать с помощью водородного показателя (рН). Водородный показатель это отрицательный десятичный логарифм активности иона водорода в растворе. рН = – lg а н+ (4.1) Так как ионное произведение воды Kw = а н+∙ а он-=10-14 при 298 K, то при значениях рН меньше 7 ионов водорода будет больше, чем гидроксид-ионов, следовательно, среда кислая. Если же значение рН больше 7, то соответственно, среда щелочная. Измерение водородного показателя методом потенциометрии осуществляется при помощи электродов, потенциал которых зависит от активности иона водорода в растворе. Наиболее распространенными для этой цели в лабораторной практике являются стеклянный и хингидронный электроды. Стеклянный электрод – ионселективный электрод, избирательный по отношению к ионам водорода, находящимся в растворе. Потенциал стеклянного электрода зависит от активности ионов водорода следующим образом: E ст = E 0ст + где b = RT ln10/ F. Для определения рН некоторого раствора составляют цепь, состоящую из стеклянного электрода, погруженного в исследуемый раствор, и электрода сравнения, потенциал которого сохраняется постоянным в ходе эксперимента. В современной практике в качестве электрода сравнения обычно используется хлоридсеребряный электрод (ХСЭ). Ag | AgCl | исследуемый раствор | стекло | HCl(0,1M) | AgCl | Ag, Тогда мы можем записать ЭДС всей цепи E = E ст – E хсэ = E 0ст – b pH – E хсэ (4.2) Следовательно, потенциал такого элемента будет линеен относительно значения рН. Зная потенциал элемента, содержащего раствор с известным значением рН, можно рассчитать значения всех постоянных величин, входящих в уравнение. В нашем случае – это стандартный потенциал стеклянного электрода и потенциал ХСЭ. Обозначим их разницу как Е1 и выразим через потенциал элемента и значение рН раствора. E 1 = E 0 ст – E хсэ = E + b pH. (4.3) Экспериментально определив Е1, мы сможем определить рН любого другого раствора с неизвестным значением рН по формуле pH = Для экспериментального определения Е1 используют буферные растворы с приписанными значениями рН. Составы буферных растворов и приписанное им значение рН можно найти в справочной литературе. Промышленностью выпускаются стандарт-титры для приготовления буферных растворов.
Применяемые для рН-метрии стеклянные электроды имеют линейную характеристику в довольно широких диапазонах температур и значений рН. В настоящее время измерение значений рН с помощью стеклянного электрода получило наибольшее распространение в лабораторной практике. Однако, наряду с достоинствами стеклянный электрод имеет ряд недостатков. Главный его недостаток – это хрупкость (поэтому обращайтесь со стеклянным электродом предельно осторожно). Сопротивление стеклянного электрода достаточно велико (от десятков до сотен МОм), поэтому при работе с ним необходимо использовать потенциометры с высоким входным сопротивлением. Другим электродом, широко используемым для измерений значений рН, является хингидронный электрод. Этот окислительно-восстановительный электрод представляет собой раствор, насыщенный хингидроном (эквимолярным соединением хинона – C6H4O2 и гидрохинона – C6H4(OH)2), с погруженным в него инертным материалом – проводником первого рода (обычно это платина или золото). Схематично этот электрод записывается C6H4O2, C6H4(OH)2, H+ïPt. На нем протекает реакция C6H4O2 + 2H+ + 2e «C6H4(OH)2, и его потенциал будет E хг = E 0хг + В кислых растворах хингидрон диссоциирует по уравнению C6H4O2× C6H4(OH)2 «C6H4O2 + C6H4(OH)2. Тогда концентрации хинона и гидрохинона в растворе будут равными и, так как их коэффициенты активностей будут близки, то соотношение их активностей будет равно 1, а уравнение для его потенциала несколько сократится E хг = E 0хг + Для определенияpH растворов составляют цепь, состоящую из хингидронного электрода (хингидрон добавляют прямо в исследуемый раствор), и электрода сравнения (как правило ХСЭ). Уравнение для ЭДС такой цепи будет подобно выражению (4.2), полученному для стеклянного электрода E = E хг – E хсэ = E 0хг – b pH – E хсэ (4.5) Порядок определения значений pH растворов аналогичен описанному выше (в случае стеклянного электрода). Сначала следует определить постоянную часть выражения (4.5) по буферному раствору с известным значением pH
E 1 = E 0хг – E хсэ = E + b pH. (4.6) Далее мы сможем определить неизвестный pH другого раствора по формуле (4.4). Хингидронный электрод имеет ряд достоинств. Он прост по устройству и приходит к равновесию быстрей, чем стеклянный электрод. Его можно применять на воздухе. Он применим во многих неводных и смешанных средах, включая водно-этанольные растворители, ацетон, фенолы и муравьиную кислоту. Основной недостаток хингидронного электрода в том, что измерения с ним ограничены растворами со значением pH меньше 8. Он дает неверные значения в присутствии белков, некоторых окислителей и при высоких концентрациях солей. Для проведения работы следует приготовить буферный раствор с известным значением pH (лучше со значением около 4) и ряд растворов с различными значениями pH в диапазоне от 1 до 7 (растворы можно приготовить разбавлением растворов сильных кислот – серной или соляной).
Порядок выполнения работы
1. Тщательно вымытый стаканчик на 50 см3 устанавливают в штатив модуля и наливают в него примерно 40 см3 заранее приготовленного буферного раствора (рекомендуется стаканчик и электроды предварительно ополоснуть буферным раствором). Стаканчик закрывают крышкой и устанавливают стеклянный и хлоридсеребрянный электроды и термодатчик. 2. Подключают электроды и термодатчик. 3. После установления равновесия (равновесие устанавливается в течение 3–5 минут) производят измерение ЭДС составленного гальванического элемента. 4. Повторяют опыт с другими приготовленными растворами. Полученные данные заносят в таблицу. 5. Заменяют стеклянный электрод на платиновый или золотоуглеродистый и повторяют всю серию опытов (согласно п. 1–4) с той лишь разницей, что в каждый раствор добавляют небольшое количество хингидрона. (Время установления равновесия после добавления хингидрона составляет примерно 2–3 минуты). 6. Проводят расчет значений pH растворов, полученных двумя способами и сравнивают результаты расчетов между собой.
Рекомендуемый вид таблицы
Работа № 5
|
||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-11; просмотров: 88; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.143.221.115 (0.009 с.) |
|||||||||||||||||||||||||||||||||||

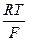 ln а н+ = E 0ст– b pH,
ln а н+ = E 0ст– b pH,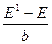 . (4.4)
. (4.4)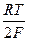 ln
ln 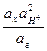 .
.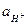 = E 0хг– b pH.
= E 0хг– b pH.


