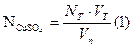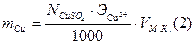Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Правила техники безопасности:. 1.Правила работы с реактивами.
1.Правила работы с реактивами. 2.Правила работы с химической посудой
Методические указания к выполнению лабораторной работы: Иодометрия -метод количественного объемного анализа, в основе которого лежит реакция восстановления свободного йода в йод-ион или окисления йод-иона в свободный иод. Направление реакции зависит от окислительной способности вступающих в реакцию с йодом веществ: например с Na2S2O3 реакция идет слева направо, с КМп04, К2Сг2О7-справа налево. Уравнение реакции:
2KMnO4 + 10KI + 8H2SO4 = 5I2 ↓ +2MnSO4 + 6K2SO4 +8H2O
Ход работы:
1. В коническую колбу, наливаем последовательно пипеткой, точный объем титрованного раствора KMnO4, 30-40мл 2н. раствора серной кислоты и 15мл 10%-ного раствора KI. 2. Смесь выдерживают 2-3 мин., после чего добавляем 100-150мл воды. 3. Производим титрование тиосульфатом натрия сначала без индикатора до получения бледно-желтой окраски раствора, а затем, добавляем 2-3мл раствора крахмала, до полного обесцвечивания раствора.
Результаты титрования записываем в таблицу:
| |||||||||||||||||||||||
|
| ||||||||||||||||||||||||
| Изм | Лист | № докум. | Подп. | Дата | ||||||||||||||||||||
| Разраб. | Лит. | Лист | Листов | |||||||||||||||||||||
| Пров. | ||||||||||||||||||||||||
|
| ||||||||||||||||||||||||
| Н. контр. | ||||||||||||||||||||||||
| Утв. | ||||||||||||||||||||||||
Расчет:
Контрольные вопросы 1. Какие стандартные растворы и какой индикатор, применяют в йодометрии? 2. Составить уравнение реакции между Na2S2O3 и I2. Какой окислительно-восстановительный процесс происходит при этом? 3. Чему равен грамм эквивалент Na2S2O3 в его реакции с йодидом? 4. Каким методом определяют нормальность растворов тиосульфата и йодида? 5. Как определяют содержание окислителей, методом йодометрии? 6. Как определяют содержание восстановителей методом йодометрии? 7. Почему при йодометрическом определении окислителей KI добавляют в избытке? 8. Почему перед титрованием кислых растворов тиосульфатом необходимо разбавлять их большим количеством воды? | ||||||||||||||||||||||||
| Лист | ||||||||||||||||||||||||
| Изм | Лист | № докум. | Подп. | Дата | ||||||||||||||||||||
|
Лабораторная работа № 27 Определение меди в растворе методом иодометрии Цель: Ознакомиться с методом йодометрии, научиться определять медь (II) – окислитель, методом титрования заместителя, используя для фиксирования конечной точки титрования специфический индикатор крахмал. Определить массу меди в контрольном растворе. Посуда и реактивы: Мерная колба с исследуемым раствором медного купороса, 2н. уксусная кислота, 25%-ного раствора KI, 0,1н. раствора тиосульфата натрия, 0,5%-ного раствора крахмала. Задание: Выполните опыты, оформите отчет. Правила техники безопасности: 1.Правила работы с реактивами. 2.Правила работы с химической посудой
Методические указания к выполнению лабораторной работы: Определение меди (II) основано на реакции окисления йодида калия ионами Cu2+ и последующим титровании выделившегося йода раствором тиосульфата натрия. Этот метод определения относится к группе методов титриметрического анализа, называемых методами титрования заместителя. В данном случае медь замещается йодом. Уравнение реакции: 2CuSO4 + 4KI = 2CuI + I2↓+ 2K2SO4 2Na2S2O3 + I2 = 2NaI + Na2S4O6 Ход работы: 1. Доводим полученный раствор в мерной колбе до метки. 2. Отбираем пипеткой точный объем исследуемого раствора в коническую колбу 3. Заполняем бюретку 0,1н. раствором тиосульфата натрия. 4. В коническую колбу добавляем 3-4мл. 2н. уксусной кислоты. 5. Производим титрование, после 5 минутного содержания конической колбы с содержимым в темном месте, накрыв колбу стеклом. 6. После окончания реакции содержимое в колбе оттитровываем раствором тиосульфата натрия.
| ||||||||||||||||||||||||
|
| ||||||||||||||||||||||||
| Изм | Лист | № докум. | Подп. | Дата | ||||||||||||||||||||
| Разраб. | Лит. | Лист | Листов | |||||||||||||||||||||
| Пров. | ||||||||||||||||||||||||
|
| ||||||||||||||||||||||||
| Н. контр. | ||||||||||||||||||||||||
| Утв. | ||||||||||||||||||||||||
7. Титрование производим до соломенной окраски раствора, не обращая внимание, на выпавший осадок. 8. После проявления соломенного окрашивания к раствору добавляем 1-2мл. раствора крахмала, раствор окрашивается в синий цвет. Титруем до бесцветной окраски.
Результаты титрования заносим в таблицу:
Рассчитываем нормальную концентрацию и массу меди в растворе.
Контрольные вопросы 1. Суть йодометрического метода. 2. Какое вещество является окислителем и восстановителем, в окислительно-восстановительном процессе. 3. Напишите уравнение реакции процесса. 4. Какой применяется индикатор, его особенности. 5. Какой переход окраски необходимо предусмотреть. 6. Расчетная формула нормальности и массы меди в растворе. 7. Ход данной работы. 8. Техника безопасности, предусматриваемая в работе. | ||||||||||||||||||||||||
| Лист | ||||||||||||||||||||||||
| Изм | Лист | № докум. | Подп. | Дата | ||||||||||||||||||||
|
Лабораторная работа № 28
|
||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 132; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.35.148 (0.01 с.) |
||||||||||||||||||||||||