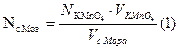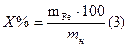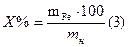Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Правила техники безопасности:
1.Правила работы с реактивами. 2.Правила работы с химической посудой. Методические указания к выполнению лабораторной работы: Уравнение реакции: 10(NH4)2Fe(SO4)2 + 2KMnO4 + 8H2SO4 = 5Fe2 (SO4)3 + 2MnSO4 + K2SO4 + 10(NH4)2 SO4 + 8H2O Соль Мора является двойной солью сульфатов железа (II) и аммония FeSO4 (NH4)2 SO4 ∙6H2 O. Так как сульфат аммония не участвует в реакции с перманганатом, то уравнение реакции взаимодействия можно написать только с FeSO4: 10 FeSO4 +2KMnO4 +8H2 SO4 =5Fe2 (SO4)3 +K2 SO4 +2MnSO4 +8H2 O
Ход работы:
1. Доливаем до метки контрольные раствор в мерной колбе, тщательно перемешиваем. 2. Заполняем бюретку титрованным раствором KMnO4. 3. Отбираем пипеткой из мерной колбы точный объем раствора в коническую колбу. 4. Добавляем в коническую колбу мензуркой столько же 2н. серной кислоты. 5. Производим титрование раствора титрованным раствором KMnO4 до устойчивой розовой окраски.
| ||||||||||||||||||||||||||
|
| |||||||||||||||||||||||||||
| Изм | Лист | № докум. | Подп. | Дата | |||||||||||||||||||||||
| Разраб. | Лит. | Лист | Листов | ||||||||||||||||||||||||
| Пров. | |||||||||||||||||||||||||||
|
| |||||||||||||||||||||||||||
| Н. контр. | |||||||||||||||||||||||||||
| Утв. | |||||||||||||||||||||||||||
Результаты титрования записываем в таблицу:
По среднему значению титра рассчитываем нормальность, массу соли Мора, процентное содержание железа:
ІІ. Определяем железа методом отдельных навесок. 1. Навеску рассчитываем на объем выбранной пипетки. 2. Взвешиваем три навески на аналитических весах (по разности) и количественно переносим в конические колбы, которые надписаны. 3. В каждую колбу добавляем 30-40мл 2н. серной кислоты и примерно 20мл воды. 4. Титруем титрованным раствором KMnO4 до появления розовой окраски. 5. Титрование начинаем с колбы, где меньше навеска. РАСЧЕТЫ: производим для каждой навески.
Масса железа в навеске составит:
Контрольные вопросы 1. Что называется восстановителем, какова его роль в химической реакции. 2. Что представляет собой соль Мора? Особенности двойных солей. 3. Что представляет собой кривая титрования соли Мора перманганатом калия?
4. Можно ли проводить работу в других средах? Почему выбрали кислоту? 5. Написать уравнение химической реакции. 6. Ход анализа соли Мора. 7. Расчет титра, массы, и процентного содержания этими методами. 8. Техника безопасности соблюдаемая при работе. 9. В чем преимущество и недостаток этих двух методов? | |||||||||||||||||||||||||||
| Лист | |||||||||||||||||||||||||||
| Изм | Лист | № докум. | Подп. | Дата | |||||||||||||||||||||||
|
Лабораторная работа № 25 Определение хрома в растворе Цель: Ознакомиться с методом обратного титрования. Определить наличие ионов Cr3+ в растворе соли хрома. Посуда и реактивы: Мерная колба с раствором бихромата калия, бюретка, раствор соли Мора, 2н. серная кислота, раствор перманганата калия. Задание: Выполните опыты, оформите отчет.
|
|||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 106; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.227.228.95 (0.007 с.) |
|||||||||||||||||||||||||||