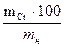Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Правила техники безопасности:. 1.Правила работы с реактивами.
1.Правила работы с реактивами. 2.Правила работы с химической посудой Методические указания к выполнению лабораторной работы: Уравнение реакции: K2Cr2O7 + 6FeSO4 + 7H2SO4 = Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7H2O 2KMnO4 + 10FeSO4 + 8H2SO4 =2MnSO4 + K2SO4 +5Fe2(SO4)3 +8H2O Ход работы:
1. Взвешиваем навеску бихромата калия и растворяем в мерной колбе. 2. Отбираем пипеткой исследуемый раствор бихромата калия из мерной контрольной колбы. 3. Подкисляем половинным объемом 2н. серной кислоты (1/2пипетки). Кислоту отмеряем мензуркой. 4. В ту же коническую колбу отмеряем из другой бюретки двойной объем соли Мора. 5. Избыток соли Мора титруем раствором перманганата калия до появления сероватой окраски. Оттитровываем параллельно пипетку соли Мора, подкисленной 2н. раствором серной кислоты. ПРИМЕЧАНИЕ: В том и другом случае титрование производим до 3-х сходящихся результатов. По среднему значению сходящихся результатов рассчитываем содержание хрома в растворе (в %). Результаты титрования записываем в таблицу:
| |||||||||||||||||||||||||||||||
|
| ||||||||||||||||||||||||||||||||
| Изм | Лист | № докум. | Подп. | Дата | ||||||||||||||||||||||||||||
| Разраб. | Лит. | Лист | Листов | |||||||||||||||||||||||||||||
| Пров. | ||||||||||||||||||||||||||||||||
|
| ||||||||||||||||||||||||||||||||
| Н. контр. | ||||||||||||||||||||||||||||||||
| Утв. | ||||||||||||||||||||||||||||||||
Таблица
Расчеты: 1. Навеску бихромата калия рассчитываем по формуле:
2. Определяем массу хрома в объеме мерной колбы: (Vм.к.)
где: V1 – объем перманганата калия, затраченного на титрование соли Мора без бихромата калия, мл V2 – объем перманганата калия, затраченного на титрование соли Мора с бихроматом калия, мл Vм.к. – вместимость мерной колбы, мл Vн – вместимость пипетки, мл
СОДЕРЖАНИЕ ХРОМА: Х% = mн – масса хрома в растворе, г Контрольные вопросы 1. Что называется окислителем? Его роль в химической реакции? 2. Что называется обратимым титрованием? 3. Расчеты при обратимом титровании. 4. Химическая реакция при данном титровании. 5. Ход работы по определению хрома данным методом. 6. Преимущества прямого метода титрования над обратным и наоборот.
7. Расчет массы хрома в растворе. 8. Определение процентного содержания. 9. Техника безопасности при выполнении данной работы. 10. Как меняется степень окисления восстановителя и окислителя в данной работе. | ||||||||||||||||||||||||||||||||
| Лист | ||||||||||||||||||||||||||||||||
| Изм | Лист | № докум. | Подп. | Дата | ||||||||||||||||||||||||||||
|
Лабораторная работа № 26 Определение нормальности раствора тиосульфата натрия по титрованному раствору перманганата калия Цель: Приобрести навыки работы с тиосульфатом натрия Посуда и реактивы: Промывалка, мерная посуда, бюретка, колбы, титрованный раствор KMnO4, раствор тиосульфата натрия, раствор йодида калия, 2н. серная кислота, крахмал. Задание: Выполните опыты, оформите отчет.
|
||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 123; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.222.80.122 (0.007 с.) |
||||||||||||||||||||||||||||||||