Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Определение кристаллизационной воды в кристаллогидратеСтр 1 из 25Следующая ⇒
Лабораторная работа №15 Определение кристаллизационной воды в кристаллогидрате Цель: Продолжить совершенствовать навыки взвешивания на техно-химических и аналитических весах. Определение массовой доли кристаллизационной воды в кристаллогидрате методом отгонки. Посуда и реактивы: Сушильный шкаф, бюкс, весы техно-химические, аналитические, разновес, эксикатор, соль кристалогидрата. Задание: Выполните опыты, оформите отчет Правила техники безопасности: 1.Правила работы с реактивами. 2.Правила работы с химической посудой. 3.Правила работы с нагревательными приборами.
Методические указания к выполнению лабораторной работы: Определение основано на разложении кристаллогидрата сульфата меди при нагревании при температуре 120-125 °С, с выделением воды: CuSO4 ×5H2O → CuSO4 + 5H2O По убыли массы пробы взятой для анализа определяют массовую долю кристаллизационной воды в образце. Ход работы Опыт 1. Взятие навески: а) Тщательно вымытый бюкс поставить сушить при 1200С в сушильный шкаф (крышку бюкса поставить на ребро). б) Через 40мин. Поместить бюкс в эксикатор. в) Когда бюкс остынет взвесить его на техно-химических, а затем на аналитических весах. Результат записать. г) Затем насыпать в бюкс, кристаллогидрат и произвести аналогично взвешивание бюкса с солью. Опыт 2. Высушивание: а) Бюкс вместе с крышкой (на ребро) поместить в сушильный шкаф. б) Высушивание производить при 2600С 1-1,5 часа. в) Высушенный бюкс с солью, высушить до «постоянного веса» и взвесить.
| ||||||||||||||||||||||||||||||
| Изм | Лист | № докум. | Подп. | Дата | |||||||||||||||||||||||||||
| Разраб. | Лит. | Лист | Листов | ||||||||||||||||||||||||||||
| Пров. | |||||||||||||||||||||||||||||||
| Н. контр. | |||||||||||||||||||||||||||||||
| Утв. | |||||||||||||||||||||||||||||||
Опыт 3. Вычисления: Вес бюкса с CuSO4 ×5H2O А= Вес бюкса А1= Навеска CuSO4×5H2O А2=А-А1
Вес бюкса с CuSO4 после первого высушивания А3= Вес бюкса с CuSO4 после первого высушивания А4= Вес бюкса с CuSO4 после третьего высушивания А5= Вес кристаллизационной воды в навеске: А6=А-А5
Опыт 4. Содержание воды % А6 г. воды содержится в А2 г. кристаллогидрата х г. воды содержится в 100 г. кристаллогидрата
ХГ =
Вычислить содержание воды в формуле: (теоретическое) в 243,5 г.CuSO4×5H2O содержится 90 г. H2O в 100 г. CuSO4×5H2O содержится х H2O
Х = Абсолютная ошибка:
Абс. = х% - 36,96
Относительная ошибка:
ОТН. = Контрольные вопросы 1. Суть гравиметрического метода анализа. 2. Как определяют содержание влаги в анализируемом образце? 3. Правило взвешивания на аналитических весах. 4. Ошибки в количественном анализе. 5. Техника безопасности при выполнении этой работы. | |||||||||||||||||||||||||||||||
| Лист | |||||||||||||||||||||||||||||||
| Изм | Лист | № докум. | Подп. | Дата | |||||||||||||||||||||||||||
|
Лабораторная работа №16 Лабораторная работа №17 Лабораторная работа №18 Лабораторная работа № 19 Лабораторная работа № 21 Лабораторная работа № 22 Лабораторная работа № 23 По оксалату аммония Цель: Углубить навыки титрования растворов окислительно-восстановительным методом. Стандартизировать раствор перманганата калия по оксалату аммонию. Посуда и реактивы: Бюретка, пипетка, колба коническая, титрованный раствор оксалата аммония, 2н. H2SO4, водяная баня. Задание: Выполните опыты, оформите отчет Расчет:
Контрольные вопросы 1. Почему этот метод титрования называется окислительно-восстановительным? 2. Какова роль величины электродного потенциала в определении направления химической реакции процесса? 3. Почему здесь не применяется индикатор? 4. Почему серную кислоту необходимо лить в воду? Для чего она применяется в этой реакции? Напишите уравнение реакции. 5. Ход работы по определению титра перманганата калия. 6. Как рассчитать нормальность и титр раствора, фактор пересчета. 7. Техника безопасности, соблюдаемая при работе. | |||||||||||||||||||||||||||||||
| Лист | |||||||||||||||||||||||||||||||
| Изм | Лист | № докум. | Подп. | Дата | |||||||||||||||||||||||||||
|
Лабораторная работа № 24 Уравнение реакции: 10(NH4)2Fe(SO4)2 + 2KMnO4 + 8H2SO4 = 5Fe2 (SO4)3 + 2MnSO4 + K2SO4 + 10(NH4)2 SO4 + 8H2O Соль Мора является двойной солью сульфатов железа (II) и аммония FeSO4 (NH4)2 SO4 ∙6H2 O. Так как сульфат аммония не участвует в реакции с перманганатом, то уравнение реакции взаимодействия можно написать только с FeSO4:
10 FeSO4 +2KMnO4 +8H2 SO4 =5Fe2 (SO4)3 +K2 SO4 +2MnSO4 +8H2 O
Ход работы:
1. Доливаем до метки контрольные раствор в мерной колбе, тщательно перемешиваем. 2. Заполняем бюретку титрованным раствором KMnO4. 3. Отбираем пипеткой из мерной колбы точный объем раствора в коническую колбу. 4. Добавляем в коническую колбу мензуркой столько же 2н. серной кислоты. 5. Производим титрование раствора титрованным раствором KMnO4 до устойчивой розовой окраски.
| |||||||||||||||||||||||||||||||
|
| |||||||||||||||||||||||||||||||
| Изм | Лист | № докум. | Подп. | Дата | |||||||||||||||||||||||||||
| Разраб. | Лит. | Лист | Листов | ||||||||||||||||||||||||||||
| Пров. | |||||||||||||||||||||||||||||||
|
| |||||||||||||||||||||||||||||||
| Н. контр. | |||||||||||||||||||||||||||||||
| Утв. | |||||||||||||||||||||||||||||||
Результаты титрования записываем в таблицу:
По среднему значению титра рассчитываем нормальность, массу соли Мора, процентное содержание железа:
ІІ. Определяем железа методом отдельных навесок. 1. Навеску рассчитываем на объем выбранной пипетки. 2. Взвешиваем три навески на аналитических весах (по разности) и количественно переносим в конические колбы, которые надписаны. 3. В каждую колбу добавляем 30-40мл 2н. серной кислоты и примерно 20мл воды. 4. Титруем титрованным раствором KMnO4 до появления розовой окраски. 5. Титрование начинаем с колбы, где меньше навеска. РАСЧЕТЫ: производим для каждой навески.
Масса железа в навеске составит:
Контрольные вопросы 1. Что называется восстановителем, какова его роль в химической реакции. 2. Что представляет собой соль Мора? Особенности двойных солей. 3. Что представляет собой кривая титрования соли Мора перманганатом калия? 4. Можно ли проводить работу в других средах? Почему выбрали кислоту? 5. Написать уравнение химической реакции. 6. Ход анализа соли Мора. 7. Расчет титра, массы, и процентного содержания этими методами. 8. Техника безопасности соблюдаемая при работе. 9. В чем преимущество и недостаток этих двух методов? | |||||||||||||||||||||||||||||||
| Лист | |||||||||||||||||||||||||||||||
| Изм | Лист | № докум. | Подп. | Дата | |||||||||||||||||||||||||||
|
Лабораторная работа № 25 Уравнение реакции: K2Cr2O7 + 6FeSO4 + 7H2SO4 = Cr2(SO4)3 + 3Fe2(SO4)3 + K2SO4 + 7H2O 2KMnO4 + 10FeSO4 + 8H2SO4 =2MnSO4 + K2SO4 +5Fe2(SO4)3 +8H2O Ход работы:
1. Взвешиваем навеску бихромата калия и растворяем в мерной колбе. 2. Отбираем пипеткой исследуемый раствор бихромата калия из мерной контрольной колбы. 3. Подкисляем половинным объемом 2н. серной кислоты (1/2пипетки). Кислоту отмеряем мензуркой. 4. В ту же коническую колбу отмеряем из другой бюретки двойной объем соли Мора. 5. Избыток соли Мора титруем раствором перманганата калия до появления сероватой окраски. Оттитровываем параллельно пипетку соли Мора, подкисленной 2н. раствором серной кислоты. ПРИМЕЧАНИЕ: В том и другом случае титрование производим до 3-х сходящихся результатов. По среднему значению сходящихся результатов рассчитываем содержание хрома в растворе (в %).
Результаты титрования записываем в таблицу:
| |||||||||||||||||||||||||||||||
|
| |||||||||||||||||||||||||||||||
| Изм | Лист | № докум. | Подп. | Дата | |||||||||||||||||||||||||||
| Разраб. | Лит. | Лист | Листов | ||||||||||||||||||||||||||||
| Пров. | |||||||||||||||||||||||||||||||
|
| |||||||||||||||||||||||||||||||
| Н. контр. | |||||||||||||||||||||||||||||||
| Утв. | |||||||||||||||||||||||||||||||
Таблица
Расчеты: 1. Навеску бихромата калия рассчитываем по формуле:
2. Определяем массу хрома в объеме мерной колбы: (Vм.к.)
где: V1 – объем перманганата калия, затраченного на титрование соли Мора без бихромата калия, мл V2 – объем перманганата калия, затраченного на титрование соли Мора с бихроматом калия, мл Vм.к. – вместимость мерной колбы, мл Vн – вместимость пипетки, мл
СОДЕРЖАНИЕ ХРОМА: Х% = mн – масса хрома в растворе, г Контрольные вопросы 1. Что называется окислителем? Его роль в химической реакции? 2. Что называется обратимым титрованием? 3. Расчеты при обратимом титровании. 4. Химическая реакция при данном титровании. 5. Ход работы по определению хрома данным методом. 6. Преимущества прямого метода титрования над обратным и наоборот. 7. Расчет массы хрома в растворе. 8. Определение процентного содержания. 9. Техника безопасности при выполнении данной работы. 10. Как меняется степень окисления восстановителя и окислителя в данной работе. | |||||||||||||||||||||||||||||||
| Лист | |||||||||||||||||||||||||||||||
| Изм | Лист | № докум. | Подп. | Дата | |||||||||||||||||||||||||||
|
Лабораторная работа № 26 Лабораторная работа № 27 Уравнение реакции: 2CuSO4 + 4KI = 2CuI + I2↓+ 2K2SO4 2Na2S2O3 + I2 = 2NaI + Na2S4O6 Ход работы: 1. Доводим полученный раствор в мерной колбе до метки. 2. Отбираем пипеткой точный объем исследуемого раствора в коническую колбу 3. Заполняем бюретку 0,1н. раствором тиосульфата натрия. 4. В коническую колбу добавляем 3-4мл. 2н. уксусной кислоты. 5. Производим титрование, после 5 минутного содержания конической колбы с содержимым в темном месте, накрыв колбу стеклом. 6. После окончания реакции содержимое в колбе оттитровываем раствором тиосульфата натрия.
| |||||||||||||||||||||||||||||||
|
| |||||||||||||||||||||||||||||||
| Изм | Лист | № докум. | Подп. | Дата | |||||||||||||||||||||||||||
| Разраб. | Лит. | Лист | Листов
| ||||||||||||||||||||||||||||
| Пров. | |||||||||||||||||||||||||||||||
|
| |||||||||||||||||||||||||||||||
| Н. контр. | |||||||||||||||||||||||||||||||
| Утв. | |||||||||||||||||||||||||||||||
7. Титрование производим до соломенной окраски раствора, не обращая внимание, на выпавший осадок. 8. После проявления соломенного окрашивания к раствору добавляем 1-2мл. раствора крахмала, раствор окрашивается в синий цвет. Титруем до бесцветной окраски.
Результаты титрования заносим в таблицу:
Рассчитываем нормальную концентрацию и массу меди в растворе.
Контрольные вопросы 1. Суть йодометрического метода. 2. Какое вещество является окислителем и восстановителем, в окислительно-восстановительном процессе. 3. Напишите уравнение реакции процесса. 4. Какой применяется индикатор, его особенности. 5. Какой переход окраски необходимо предусмотреть. 6. Расчетная формула нормальности и массы меди в растворе. 7. Ход данной работы. 8. Техника безопасности, предусматриваемая в работе. | |||||||||||||||||||||||||||||||
| Лист | |||||||||||||||||||||||||||||||
| Изм | Лист | № докум. | Подп. | Дата | |||||||||||||||||||||||||||
|
Лабораторная работа № 28 Лабораторная работа № 29 Лабораторная работа № 30 Лабораторная работа № 20 Уравнение реакции Са(НСО3)2+2НСl=СаСl2+2Н2О+2СО2 Мg(НСО3)2+2НСl=МgСl2+2Н2О+2СО2 Ход работы 1. Получить образцы воды для исследования. 2.Мерную колбу на 100мл два-три раза ополаскиваем исследуемой водой. 3.Наполняем ее до метки и количественно переносим в коническую колбу. 4. Прибавляем 1-2капли метил-оранжевого. 5.Титрование производим соляной кислотой до бледно-розового окрашивания. Рассчитываем жесткость воды. Результаты титрования записать в таблицу:
| |||||||||||||||||||||||||||||||
| Изм | Лист | № докум. | Подп. | Дата | |||||||||||||||||||||||||||
| Разраб. | Лит. | Лист | Листов | ||||||||||||||||||||||||||||
| Пров. | |||||||||||||||||||||||||||||||
| . | |||||||||||||||||||||||||||||||
| Н. контр. | |||||||||||||||||||||||||||||||
| Утв. | |||||||||||||||||||||||||||||||
Оформление результатов Рассчитать временную жесткость воды (Ж врем в мэкв/л) по формуле:
Сн (HCl) × V сред(HCl) Ж врем = --------------------------------- · 1000 V(H2O) Контрольные вопросы 1. В чем суть кислотно-основного метода титрования? 2.Что такое титрант? 3. Почему вода содержащая гидрокарбонаты кальция и магния имеет щелочную среду? 4. Какие виды жесткости вам известны? Какими ионами обусловлен тот или иной вид жесткости? 5.В каких единицах измеряется жесткость и как она рассчитывается? 6.На чем основано определение временной жесткости воды? 7. Какой закон применяется при обработке результатов кислотно-основного титрования.
8. Охрана труда при выполнении лабораторной работы.
| |||||||||||||||||||||||||||||||
| Лист | |||||||||||||||||||||||||||||||
| Изм | Лист | № докум. | Подп. | Дата | |||||||||||||||||||||||||||
|
| |||
| МИНИСТЕРСТВО ОБРАЗОВАНИЯ, НАУКИ И МОЛОДЕЖИ РЕСПУБЛИКИ КРЫМ | |||
| ГБОПУ РК «КЕРЧЕНСКИЙ ПОЛИТЕХНИЧЕСКИЙ КОЛЛЕДЖ» | |||
|
| |||
|
| |||
|
| |||
|
| |||
|
| |||
|
| |||
| Лаборатория | химического анализа | ||
|
| |||
|
| |||
|
ЖУРНАЛ | |||
|
| |||
| ЛАБОРАТОРНЫХ РАБОТ | |||
| (ОТЧЕТЫ) | |||
| по дисциплине ОП.03 Аналитическая химия | |||
|
| |||
|
| |||
| ЛР.____.18.02.01.___.___ | |||
|
| |||
|
| |||
|
| |||
|
| |||
|
| |||
|
| |||
|
| |||
|
| |||
|
| |||
| Группа | _______________ | ||
|
| |||
| Студент | ________________ | ||
|
| ________________ | ||
|
| |||
| Преподаватель | ________________ | ||
|
| ________________ | ||
|
| |||
|
| |||
|
| |||
|
| |||
| Керчь | |||
| 20__ г. | |||
|
| |||
|
Лабораторная работа № 1 Реакции на ионы Na +, K +, NH 4 + Цель: освоить технику лабораторного качественного анализа, освоить методику анализа катионов I аналитической группы и характерные реакции обнаружение ионов Na+, К+, NH4+. Посуда и реактивы: пробирки, микроскоп, сушильный шкаф,пробирка держатель, спиртовка, фильтровальная бумага, индикаторная бумага, стеклянные палочки, предметное стекло, синее (кобальтовое) стекло, тигель (фарфоровая чашка), пипетки, водяная баня, раствору солей натрия, калия, аммония, уранилацетат магния, гексагидроксиантимонат калия(V) – K[Sb(OH)6], кобальтинитрит натрия (гексанитрокобальтиат натрия) - Na3[Co(NO2)6], гидротартрат натрия – NaHC4H4O6,, Реактив Несслера -K2[HgJ4] – щелочной р-р комплексной соли ртути.
Задание: Выполнить задание, оформить отчет. Ход работы Согласно приведенной схемы анализа ионов Na +, K +, NH 4 + рассмотрите методы открытия катионов, рассмотрите основные признаки наличия реакции. Используя дополнительные методические указания заполните таблицу. 1. Открытие ионов аммония. Ионы аммония можно открыть дробно в присутствии других катионов I группы, используя щелочь (при нагревании) или реактив Несслера. Методики см. для лаб.раб.№1 Для последующего отделения ионов натрия и калия присутствие катионов аммония нежелательно, и в случае определения его удаляют. 2.Удаление ионов аммония. Для этого 5-20 капель исследуемого раствора помещают в фарфоровую чашку и выпаривают досуха, а затем прокаливают до прекращения выделения «белого дыма». NН4Сl→NН3↑+НСl
| ||||||||||||||||||||||||
| Изм | Лист | № докум. | Подп. | Дата | ||||||||||||||||||||
| Разраб. | Лит. | Лист | Листов | |||||||||||||||||||||
| Пров. | ||||||||||||||||||||||||
| . | ||||||||||||||||||||||||
| Н. контр. | ||||||||||||||||||||||||
| Утв. | ||||||||||||||||||||||||
Охлаждают содержимое чашки и растворяют его в 8-10 каплях дистиллированной воды, после чего проверяют на полноту осаждения катиона аммония реактивом Несслера. Затем приступают к обнаружению катионов калия и натрия с помощью соответствующих качественных реакций. 3. Открытие ионов калия и натрия. После полного удаления ионов аммония растворы необходимо нейтрализовать уксусной кислотой (рН=7 проверить по индикатору) и частными реакциями открывать в первой пробирке ионы калия, во второй – ионы натрия (смотрите схему и частные методики). Если ионы аммония в задаче отсутствуют, то п. 2 выполнять не надо, а нужно дробно открывать частными реакциями ионы натрия и калия прямо из задачи. 4. Сделайте заключение о присутствии катионов 1 группы, предварительно оформив результаты работы в таблицу.
Таблица Частные реакции ионов
Контрольне вопросы 1. Чем отличается 1 аналитическая группа катионов от других аналитических групп кислотно-основной классификации? 2. В какой среде проводят реакции обнаружения катионов 1 группы? Ответ обосновать. 3. Можно ли обнаружить катионы калия и натрия в присутствии катионов аммония? Ответ мотивируйте. 4. Какая из реакций обнаружения катиона аммония является специфической? 5. Как можно удалить ионы аммония, лития из задачи? Зачем это необходимо делать? 6. Как проверить полноту удаления ионов аммония, лития? 7. Почему при обнаружении ионов аммония щелочами необходимо нагревание и применение влажной индикаторной бумаги? 8. Составьте схему анализа смеси Na+, NH4+. 9. Составьте схему анализа смеси K+, Li+. 10. Составьте схему анализа смеси K+, NH4+, Li+. 11. Можно ли использовать сухой метод для открытия катионов 1 группы? Каких? Как это сделать?
| ||||||||||||||||||||||||
|
Лист | ||||||||||||||||||||||||
| Изм | Лист | № докум. | Подп. | Дата | ||||||||||||||||||||
| ||||||||||||||||||||||||
|
Лист | ||||||||||||||||||||||||
| Изм | Лист | № докум. | Подп. | Дата | ||||||||||||||||||||
|
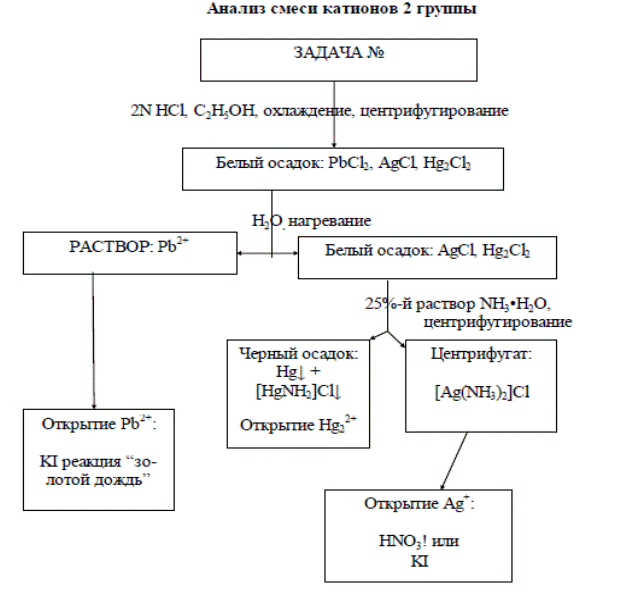
Лабораторная работа № 2 Реакции на ионы Ag + Pb 2+, Hg 2+ Цель: освоить технику лабораторного качественного анализа, освоить методику анализа катионов II аналитической группы и характерные реакции обнаружение ионов Ag+ Pb2+,Hg2+ Посуда и реактивы: пробирка, центрифуга, стеклянные палочки, спиртовка, медная пластинка, растворы солей содержащие серебро, свинец и ртуть, соляная кислота-HCl, этанол-C2H5OH, раствор аммиака-NH3•H2O, азотная кислота-HNO3, иодид калия- КI, гидроксиды калия и натрияКОН, NaOH,хромат калия – K2CrO4,серная кислота – H2SO4, уксусная кислота-CH3COOH,дитизон (дифенилтиокарбазон) – (C6H5)2N4H2CS
Задание: Выполнить задание, оформить отчет. Ход работы 1. Осаждение катионов 2 группы. В пробирку поместите 20-30 капель исследуемого раствора и помешивая добавить 2н раствор HCl, если осадок не образуется, значит в растворе нет катионов II группы, в противном случае через 1-2 мин. Осадок отцентрифугируйте и промойте холодной водой, содержащей несколько капель 2н раствора соляной кислоты. В дальнейшем центрифугат не используется. Осадок обработайте 2-3 раза горячей водой и центирифугируйте. При этом хлорид свинца переходит в раствор, а хлориды серебра и ртути остаются в осадке 2. Отделение и открытие ионов свинца. В центрифугате проверяют наличие ионов свинца действием иодида калия, реакция “золотой дождь” (методику выполнения лаб.раб №2).
| ||||||||||||||||||||||||
| Изм | Лист | № докум. | Подп. | Дата | ||||||||||||||||||||
| Разраб. | Лит. | Лист | Листов | |||||||||||||||||||||
| Пров. | ||||||||||||||||||||||||
| . | ||||||||||||||||||||||||
| Н. контр. | ||||||||||||||||||||||||
| Утв. | ||||||||||||||||||||||||
3. Открытие ионов ртути (I). К осадку (после обработки его горячей водой) добавьте 6N или 25%-й раствор NH3•H2O и хорошо перемешайте. При этом хлорид серебра должен раствориться и перейти в раствор в виде комплексного соединения [Аg(NH3)2]Cl. Быстрое почернение осадка при обработке его раствором аммиака указывает на присутствие в задаче ионов ртути (I). Осадок отделите от раствора центрифугированием. 4. Открытие ионов серебра. Несколько капель центрифугата, полученного в п. 3, поместите в чистую пробирку или на предметное стекло и прибавьте несколько капель концентрированной HNO3. Выпадение белого осадка АgCl или помутнение указывают на присутствие в задаче ионов серебра, вместо HNO3! можно использовать KI. 5. Результаты работы оформите в таблицу, напишите уравнения необходимых реакций, сделайте вывод о наличии катионов II группы. Схема 1
| ||||||||||||||||||||||||
|
Лист | ||||||||||||||||||||||||
| Изм | Лист | № докум. | Подп. | Дата | ||||||||||||||||||||
|
Таблица Частные реакции ионов
Контрольные вопросы 1. Какой реагент является групповым на II группу катионов? 2. Методика выполнения реакции «золотой дождь». 3. На чем основано удаление хлорида свинца из осадка хлоридов катионов II группы? 4. Если при обработке горячей водой осадок хлоридов катионов II группы растворился полностью, что это значит? 5. На чем основано растворение осадка хлорида серебра в растворе аммиака? 6. Что произойдет при действии раствора аммиака на осадок хлорида ртути (II)? 7. Какой вывод вы сделаете, если осадок хлоридов катионов II группы, отмытый от хлорида свинца, полностью растворится в растворе аммиака? 8. Чем можно разрушить аммиачный комплекс серебра? Что при этом наблюдается?
| ||||||||||||||||||||||||
|
Лист | ||||||||||||||||||||||||
| Изм | Лист | № докум. | Подп. | Дата | ||||||||||||||||||||
|
Лабораторная работа №3 Реакции на ионы Ba 2+, Sr 2+, Ca 2+ Цель: освоить технику лабораторного качественного анализа, освоить методику анализа катионов III аналитической группы и характерные реакции обнаружение ионов Ba2+, Sr2+, Ca2+ Посуда и реактивы: пипетки, пробирки, спиртовка, водяная баня, микроскоп, центрифуга, медная пластинка, соли бария, стронция, кальция, бихромат калия - K2CrO4, ацетат натрия, платиновая петля, оксалат аммония-(NH4)2C2O4, серная кислота – H2SO4,сульфат аммония- (NH4)2SO4, этанол-C2H5OH, соляная кислота-HCl, раствор аммиака-NH3•H2O, азотная кислота-HNO3,, карбонат натрия (калия) – Na2CO3 (K2CO3), гипсовая вода – насыщенный водный раствор CaSO4•2H2O, медная пластинка
Задание: Выполнить задание, оформить отчет. Ход работы 1. Дробное открытие ионов бария. Для этого к 3 каплям анализируемого раствора в отдельной пробирке прибавьте 4 капли уксусной кислоты и 5 капель хромата калия. Вместо уксусной кислоты и хромата калия можно использовать ацетат натрия и дихромат калия. Если ионы бария присутствуют,их необходимо удалить и только после этого открывать ионы стронция и кальция, т.к. ионы бария будут мешать их открытию. 2. Удаление ионов бария. Образовавшийся осадок хромата бария из 1п. отделите от раствора центрифугированием. Центрифугат проверьте на полноту осаждения ионов бария действием хромата калия. Если желтый осадок не появился, ионы бария полностью удалены, в противном случае удаление повторите. Осадок хромата бария отбрасывается, а в центрифугате после соответствующей обработки открываются ионы стронция и кальция. Copyright ОАО «ЦКБ «БИБКОМ» & ООО «Aгентство Kнига-Cервис» | ||||||||||||||||||||||||
| Изм | Лист | № докум. | Подп. | Дата | ||||||||||||||||||||
| Разраб. | Лит. | Лист | Листов | |||||||||||||||||||||
| Пров. | ||||||||||||||||||||||||
| . | ||||||||||||||||||||||||
| Н. контр. | ||||||||||||||||||||||||
| Утв. | ||||||||||||||||||||||||
3. Осаждение ионов стронция и кальция. Ионы стронция и кальция осадите из раствора, прибавляя 6N раствор поташа или соды до рН=10. Образовавшийся осадок карбонатов кальция и стронция отделите от раствора центрифугированием и промойте несколько раз дистиллированной водой (промывные воды отбросьте). Белый осадок карбонатов обработайте 2N СН3СООН до полного его растворения. Если в задаче нет ионов бария, то п. 2-3 проводить не надо, а сразу после п. 1 выполняйте п. 4.
|
||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 513; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.14.70.203 (0.288 с.) |
||||||||||||||||||||||||
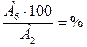

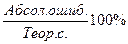
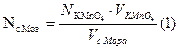

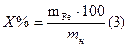


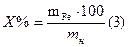


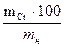
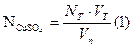
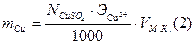
 Схема 1
Схема 1