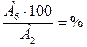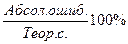Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Правила техники безопасности:. 1.Правила работы с реактивами.
1.Правила работы с реактивами. 2.Правила работы с химической посудой. 3.Правила работы с нагревательными приборами.
Методические указания к выполнению лабораторной работы: Определение основано на разложении кристаллогидрата сульфата меди при нагревании при температуре 120-125 °С, с выделением воды: CuSO4 ×5H2O → CuSO4 + 5H2O По убыли массы пробы взятой для анализа определяют массовую долю кристаллизационной воды в образце. Ход работы Опыт 1. Взятие навески: а) Тщательно вымытый бюкс поставить сушить при 1200С в сушильный шкаф (крышку бюкса поставить на ребро). б) Через 40мин. Поместить бюкс в эксикатор. в) Когда бюкс остынет взвесить его на техно-химических, а затем на аналитических весах. Результат записать. г) Затем насыпать в бюкс, кристаллогидрат и произвести аналогично взвешивание бюкса с солью. Опыт 2. Высушивание: а) Бюкс вместе с крышкой (на ребро) поместить в сушильный шкаф. б) Высушивание производить при 2600С 1-1,5 часа. в) Высушенный бюкс с солью, высушить до «постоянного веса» и взвесить.
| ||||||||||||
| Изм | Лист | № докум. | Подп. | Дата | |||||||||
| Разраб. | Лит. | Лист | Листов | ||||||||||
| Пров. | |||||||||||||
| Н. контр. | |||||||||||||
| Утв. | |||||||||||||
Опыт 3. Вычисления: Вес бюкса с CuSO4 ×5H2O А= Вес бюкса А1= Навеска CuSO4×5H2O А2=А-А1
Вес бюкса с CuSO4 после первого высушивания А3= Вес бюкса с CuSO4 после первого высушивания А4= Вес бюкса с CuSO4 после третьего высушивания А5= Вес кристаллизационной воды в навеске: А6=А-А5
Опыт 4. Содержание воды % А6 г. воды содержится в А2 г. кристаллогидрата х г. воды содержится в 100 г. кристаллогидрата
ХГ =
Вычислить содержание воды в формуле: (теоретическое) в 243,5 г.CuSO4×5H2O содержится 90 г. H2O в 100 г. CuSO4×5H2O содержится х H2O
Х = Абсолютная ошибка:
Абс. = х% - 36,96
Относительная ошибка:
ОТН. = Контрольные вопросы 1. Суть гравиметрического метода анализа. 2. Как определяют содержание влаги в анализируемом образце?
3. Правило взвешивания на аналитических весах. 4. Ошибки в количественном анализе. 5. Техника безопасности при выполнении этой работы. | |||||||||||||
| Лист | |||||||||||||
| Изм | Лист | № докум. | Подп. | Дата | |||||||||
|
Лабораторная работа №16 Определение железа в солях железа или бария в соли бария. Цель: Продолжить формировать навыки операций весового метода. Определить содержания вещества входящего в состав исследуемой соли. Посуда и реактивы: соль железа или соль бария, чистый стакан емкостью 200мл., тигель, дистиллированная вода, весы аналитические, 2н. HNO3, NH4NO3, часовое стекло, стеклянная палочка, 10%-ный аммиак, фильтр (красная лента), воронка, разновес. Задание: Выполните опыты, оформите отчет
|
|||||||||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 82; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.221.165.246 (0.008 с.) |
|||||||||||||