
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Общие сведения о коррозии металловСтр 1 из 11Следующая ⇒
А. В. Гунцов ХИМИЧЕСКОЕ СОПРОТИВЛЕНИЕ МАТЕРИАЛОВ И ЗАЩИТА ОТ КОРРОЗИИ Учебное пособие ЧАСТЬ 1 Тюмень ТюмГНГУ
УДК 620.197 ББК 34.437 Г 94
Рецензенты: доктор химических наук, профессор О. В. Андреев доктор химических наук, профессор К. С. Чемезова
УДК 620.197 ББК 34.437
ОГЛАВЛЕНИЕ
ВВЕДЕНИЕ
Латинское слово «corrodere» от которого произошло слово «коррозия» означает «разъедать, изгладывать». Коррозией металлов называют самопроизвольное разрушение металлов и сплавов при их взаимодействии с окружающей средой. Процессы коррозии происходят и с неметаллическими материалами - пластмассами, бетоном и другими неметаллическими материалами. Металл, подвергающийся коррозии, называют корродирующим металлом, а среда, в которой протекает коррозионный процесс - коррозионной средой. Способность металлов сопротивляться воздействию среды называется коррозионной стойкостью или химическим сопротивлением материала. Химические соединения, образующиеся в результате взаимодействия металла и коррозионной среды, называют продуктами коррозии. Понятия, термины и определения по коррозии даны в ГОСТ 5272-68. Борьба с коррозией имеет различные социальные, экологические и экономические аспекты. Только в США ежегодные потери от коррозии составляют 300 миллиардов долларов. В большинстве развитых стран потери от коррозии составляют 4-6 % национального дохода. Наибольшие потери от коррозии происходят в топливно-энергетическом комплексе, сельском хозяйстве и нефтехимии. Большое число аварий нефтегазовых сооружений связано с коррозией. В нефтедобывающей промышленности и транспорте нефти до 70 % аварий происходит по причине коррозионных повреждений. Различают прямые и косвенные потери от коррозии. Прямые потери определяются стоимостью ремонта оборудования и коммуникаций вышедших из строя вследствие коррозии. Косвенные потери это экономические затраты связанные с: 1) простоем вышедшего из строя по причине коррозии оборудования, 2) потерями материальных продуктов от коррозии металлических ёмкостей, 3) авариями и даже катастрофами (например, взрыв проржавевшего трубопровода) и т.п. Металлы, находящиеся в свободном состоянии неустойчивы и при взаимодействии с окружающей средой переходят в более устойчивое окисленное состояние. Большинство металлов в земной коре находится в окисленном состоянии – в виде оксидов, сульфидов и некоторых других соединений. Это является следствием физико-химических условий на поверхности земли.
Показатели коррозии
Скорость коррозии определяется по величине изменения какого-либо показателя коррозии от времени. В настоящее время используют большое число показателей коррозии. Рассмотрим наиболее часто применяемые на практике показатели коррозии. 1) Массовый показатель - изменение массы образца металла в результате коррозии, отнесенное к единице поверхности металла и к единице времени. При коррозии металла продукты коррозии могут растворяться в коррозионной среде и этот показатель может быть отрицательным: Km= Δm / Sτ, (1.5) где Δm - убыль массы металла за время испытания τ. 2) Глубинный показатель коррозии KП – глубина коррозионного разрушения металла П в единицу времени τ: KП = П / τ. (1.6) 3) Объемный показатель коррозии KV – объем поглощенного или выделившегося в процессе коррозии металла газа (например, кислорода или водорода, соответственно) ΔV, приведенный к нормальным условиям (т.е. t = 0° С, Р = 1 атм.) и отнесенный к единице поверхности металла и к единице времени:
KV = ΔV / Sτ. (1.7) 5) Механический показатель коррозии Kмех – изменение какого-либо показателя за определенное время коррозионного процесса, выраженное в процентах (например, изменение предела прочности металла): 6) Показатель изменения электрического сопротивления KR, применяемый при исследовании тонкого листового материала или проволоки – изменение электрического сопротивления ΔR образца металла за определенное время коррозионного процесса τ, выраженное в процентах: KR = (ΔR/R0τ)·100%, (1.8) где R0 – электрическое сопротивление до процесса коррозии. 7) Доля поверхности, занятая продуктами коррозии. 8) Количество коррозионных язв или точек на единице поверхности. 9) Время до появления первого очага коррозии.
ХИМИЧЕСКАЯ КОРРОЗИЯ
Химическая коррозия характерна для сред, не проводящих электрический ток. Наиболее часто химический механизм реализуется в процессах газовой коррозии и в жидкой среде неэлектролитов. Химическая коррозия металлов — это самопроизвольный окислительно-восстановительный процесс, подчиняющийся законам гетерогенных химических реакций, которые осуществляются одновременно в одном акте в точке взаимодействия металла с компонентом агрессивной среды. В процессе химической коррозии происходит прямое гетерогенное взаимодействие металлов с окислителем окружающей среды, в результате которого между ними совершается обмен электронами, т.е. протекает обычная окислительно-восстановительная реакция. Наиболее распространенным видом химической коррозии металлов является газовая коррозия – коррозия металлов в газах при высоких температурах. Газовая коррозия металлов имеет место при работе многих металлических деталей и аппаратов (металлической арматуры нагревательных печей, двигателей внутреннего сгорания, газовых турбин, аппаратов синтеза аммиака и др.) и при нагревании в случае многочисленных процессов обработки металлов при высоких температурах. Чаще всего она встречается при эксплуатации различных топочных устройств паровых котлов, когда при сгорании топлива в воздухе или кислороде образуется газовая смесь, содержащая кислород. Поведение металлов при высоких температурах имеет большое практическое значение и описывается двумя характеристиками – жаростойкостью и жаропрочностью.
Жаростойкостью называется способность металла сопротивляться коррозионному воздействию газов при высоких температурах. Жаропрочностью называется способность металла сохранять при высоких температурах достаточно высокие механические свойства длительную прочность и сопротивление ползучести.
Пленки на металлах
Большинство твердых металлов при взаимодействии с кислородом воздуха или другими окислителями покрывается тонкой пленкой соединения металла с окислителем. Процесс окисления твёрдого металла складывается из нескольких последовательных стадий, включающих адсорбционные и диффузионные явления, а также химическое взаимодействие.
Образование пленки продуктов коррозии
Дальнейший рост окисной пленки идет за счет образования зародышей. Дислокации, поверхностные дефекты, примеси служат местами образования зародышей, где двухмерная структура адсорбированного кислорода переходит в объёмную, трехмерную плёнку с правильным чередованием атомов металла и кислорода. После образования хаотично размещающихся зародышей окисла, окисление идет путем роста отдельных кристаллитов до тех пор, пока поверхность полностью не покроется окислом. При наличии химического сродства между металлом и окислителем хемосорбированная пленка быстро переходит в состояние оксидной пленки в результате протекания химической реакции
и перестройки атомов металла и кислорода, соответствующей их пространственному распределению в оксиде. Получающийся оксид образует на поверхности корродирующего металла пленку. Толщина пленок продуктов коррозии на металлах изменяется в широком интервале. Пленки по толщине подразделяют на три группы: 1) тонкие (невидимые), толщина которых от нескольких ангстрем до 400 ангстрем; 2) средние (дают различные цвета), толщина которых от 400 до 5000 ангстрем; 3) толстые (видимые), толщина которых свыше 5000 ангстрем и достигает во многих случаях значительной величины (например, окалина на стали). При изучении газовой коррозии необходимо определять характер изменения толщины пленки во времени, а также изменение структуры образующейся пленки. Для определения толщины, структуры и свойств оксидных пленок используют различные современные методы: интерференционные, электронографию, рентгенографию и др. Некоторые примеры условий образования различных по толщине пленок указаны в табл. 2.1. Таблица 2.1 Условия образования пленок на железе и алюминии
Таблица 2.2 Толщина и цвет окисных пленок на железе и меди
Оксидные пленки могут быть сплошными или несплошными. Пиллинг и Бедвортс сформулировали условие, при котором образуются сплошные пленки, способные препятствовать дальнейшему окислению металла: молекулярный объем соединения, возникшего из металла и окислителя, Vок должен быть больше объема металла VMе, израсходованного на образование молекулы соединения. В противном случае образующегося соединения не хватает, чтобы покрыть сплошным слоем весь металл, в результате чего пленка продукта коррозии металла получается пористой и рыхлой. Таким образом, если Vок/VMе < 1, то пленка не может быть сплошной, если Vок/VMе > 1, то пленка может быть сплошной. Отношение объемов соединений металла с окислителем и металла можно рассчитать по формуле
где Mок – молекулярная масса продукта коррозии (окисла); АМе – атомная масса металла; ρок – плотность продукта коррозии (окисла); ρМе – плотность металла, m – число атомов металла в продукте коррозии. Отношения Vок/VMе для некоторых металлов приводятся в табл. 2.3.
Таблица 2.3 Значения объемов оксидов и металлов
Защитные свойства пленки определяются рядом факторов, из которых сплошность является необходимым, но недостаточным условием. В реальных условиях роста пленки в ней могут возникнуть такие внутренние напряжения, которые начнут разрушать ее, частично или полностью нарушая ее сплошность, и тем самым значительно уменьшают или полностью устраняют ее защитные свойства. Это наблюдается при Vок/VMе > 2.5. Достаточно хорошими защитными свойствами могут обладать лишь пленки на металлах, удовлетворяющие условию 2,5 > Vок/VMе > 1. (2.6) При окислении легких металлов объем оксидного слоя меньше объема израсходованного на его образование металла. Оксидное покрытие обычно пористое и не обладает защитными свойствами. При коррозии тяжелых металлов объем образующегося соединения (оксида) больше объема израсходованного металла. И хотя при этом наблюдается тенденция к образованию тонкого покрытия, при слишком большом различии в объемах (>2,5) в системе возникают сжимающие напряжения, приводящие к расслаиванию или другим механическим повреждениям защитного слоя.
Кинетика газовой коррозии
Термодинамические расчеты не позволяют оценить скорость коррозии металла. Рассмотрением этого вопроса, а также различных факторов, влияющих на скорость коррозии и характер коррозионного разрушения металлов, занимается кинетика коррозионных процессов. Скорость газовой коррозии vгаз, обычно принято выражать через скорость роста толщины оксидной пленки:
где h – толщина пленки; t – время коррозии.
Скорость коррозии в этом случае будет в соответствии с уравнением определяться уравнением:
где kp – константа скорости реакции; СМе – равна 1; СО – концентрация кислорода у поверхности металла. Так как СМе =1 уравнение (2.8) имеет вид:
Далее разделяем переменные и интегрируем:
Величины k р и СО – постоянные, и их выносят за знак интеграла. После интегрирования получаем:
Произведение k р СО обозначим через k 1. Тогда из (2.11) следует:
Из уравнения (2.12) следует, что толщина тонкой рыхлой пленки с течением временем увеличивается линейно. Если пленка сплошная (рисунок 2.1 б), то она оказывает торможение проникновению кислорода к металлу и скорость коррозии описывается уравнением:
Принимая площадь сечения, через которое идет диффузия, равным единице и выражая градиент концентрации через (С0 – С0)/x, где C0 – концентрация кислорода в объеме, С0 – концентрация кислорода у поверхности металла, получаем:
Если диффузия является лимитирующим фактором, то весь кислород, достигший поверхности металла, успевает вступить в реакцию, и тогда С0 → 0. В этом случае имеют место предельные условия диффузии:
Для вычисления толщины пленки x это уравнение нужно проинтегрировать. Разделяя переменные, получим:
После интегрирования получаем:
Обозначив 2· K д ·СО через k 2, записываем уравнение (2.17) в виде h 2 = k 2 · t. (2.18) Из уравнения (2.18) видно, что рост сплошной оксидной пленки происходит по параболическому закону. Если же скорость коррозии лимитируется и кинетикой, и диффузией (СО ≠ 0), что часто наблюдается в начальный период коррозии, то для стационарной скорости газовой коррозии можно получить уравнение:
Уравнение (2.19) учитывает влияние на скорость окисления металла химической реакции и диффузии. Если пленка очень тонкая (h → 0), то первый член уравнения (2.19) значительно меньше второго. Пренебрегая первым членом, получим:
т.е. получается линейный закон роста пленки. Если толщина пленки велика, то можно пренебречь вторым членом по сравнению с первым, в этом случае получаем:
т.е. получается параболический закон роста пленки. Часто рост пленки протекает медленнее, чем это следует из параболического закона. Затухание процесса коррозии в таких случаях объясняется либо уплотнением пленок, либо появлением различных дефектов или расслоений, что тормозит диффузию. В этих случаях рост пленки протекает в соответствии с логарифмическим законом h = ln (k 3 · t), (2.22) где k 3 некоторая константа. Для тонких пленок при низких температурах применяется логарифмическая или обратно-логарифмическая зависимости: h = k4 lg(at+b) ; 1/h = k5 – k6 lgt (2.23)
hn = k 7 t, n >2, (2.24) где k 4 k 5 k 6 k 7 некоторые константы независящие от времени.
Различные металлы в различных температурных интервалах окисляются по-разному. Линейный закон окисления характерен для натрия, кальция, магния, вольфрам; параболический – для меди, железа, никеля; логарифмический – для алюминия и цинка в интервале 25-225ºC, никеля до 650 ºC, железа до 375 ºC, меди до 100 ºC и т.д.
Влияние деформации
По мере роста окисел испытывает деформационные усилия со стороны металлической поверхности, на которой он формируется. Это обусловлено тем, что объем окисла не всегда равен объему металла, из которого он образуется. В защитных пленках могут возникать следующие напряжения: · внутреннее сжимающее напряжение, т.к. при росте защитной пленки происходит рост ее объема · внутреннее напряжение сжатия на неровной поверхности, вызывающее отрывающее усилие. Напряжение на неровной поверхности больше чем на плоской. По этой же причине в процессе окислении различные трещины появляются сначала на краях образцов. Знак и величина напряжений зависят от механизма окисления и от кривизны образца. · внутренние напряжения внутри защитной пленки появляются из-за различия линейного и объемного коэффициента теплового расширения металла и материала пленки Эти напряжения уменьшают сохранность защитных пленок на металле и вызывают их механическое разрушение. Причины разрушения оксидных пленок в процессе их роста: · при недостаточной прочности пленок появляются пузырьки, что делает пленку газопроницаемой, а под пузырем образуется новая оксидная пленка; · возникновение газонепроницаемых микропузырей, которые препятствуют диффузии ионов металла и тормозят процесс окисления, контролируемый этой диффузией, что может привести от параболического закона роста пленки к степенному или логарифмическому; · отслаивание пленки на поверхности металла; · растрескивание при сдвиге (характерно для пленок, обладающих большой адгезией к металлам и малой прочностью); · растрескивание на узлах и крутых изгибах поверхности приводит к интенсивному окислению острых выступов и служит началом разрушения оксидных пленок отслаиванием. При окислении металла переменной валентности (Fe, Co) в условиях, допускающих образование нескольких различных окислов, пленки могут иметь многослойную структуру. Деформация металлов и сплавов в процессе нагрева может нарушать сплошность пленок. А это приводит к увеличению скорости окисления. Предварительная деформация оказывает сравнительно небольшое влияние на скорость окисления только при температуре ниже температуры рекристаллизации.
Влияние температуры
Температура существенно влияет на скорость процессов химической коррозии металлов. С повышением температуры процессы окисления металлов протекают значительно быстрее, несмотря на уменьшение термодинамической возможности.
Температура оказывает влияние на константу скорости химической реакции и на коэффициент диффузии (для процесса диффузии). Для обоих случаев имеет место экспоненциальная зависимость:
k = A exp(-E/RT), (2.24) где к — константа скорости химической реакции или коэффициент диффузии; А — постоянная независящая от температуры; Е — энергия активации химической реакции или процесса диффузии; R — газовая постоянная; Т — абсолютная температура. Если прологарифмировать уравнение (2.24), то получим
ln k = ln A – E/RT. (2.25)
Температурная зависимость в координатах ln k — 1/T выражается прямой линией, для которой (-E/R) равно тангенсу угла наклона. При повышении температуры коэффициент скорости химической реакции растёт быстрее, чем коэффициент диффузии. Это приводит к тому, что при определенной температуре скорость химической реакции уравнивается со скоростью диффузии, а потом превышает ее. Процесс начинает контролироваться стадией диффузии. На зависимости lnk — 1/Т этот эффект будет связан с изменением наклона прямой линии. Температура может оказывать влияние также на состав образующихся пленок и закон их роста (табл. 2.7). При окислении меди при температурах ниже 1025 °С образуются Сu2О, и СuО, а при температурах выше 1025 °C – только Сu2О. Закон роста пленок на меди при изменении температуры также изменяется. Таблица 2.7 Составы и законы роста оксидных пленок железа при различных температурах
Большое влияние на скорость окисления металлов оказывает режим нагрева. Колебания температуры при нагреве и особенно попеременный нагрев и охлаждение вызывают разрушение пленок вследствие возникновения больших внутренних напряжений, в результате чего скорость окисления металла увеличивается. Влияние давления
На скорость окисления металлов оказывает влияние парциальное давление кислорода. Если окисление металла лимитируется химической реакцией, то скорость коррозии увеличивается пропорционально корню квадратному от величины давления кислорода (рис. 2.8).
Явление уменьшения скорости газовой коррозии при повышении парциального давления кислорода называется высокотемпературной пассивацией. Пассивное состояние металла объясняется образованием на его поверхности совершенной пленки. При значительном увеличении парциального давления кислорода выше критического у некоторых нержавеющих сталей происходит нарушение пассивного состояния, что приводит к увеличению скорости окисления стали. Повышение скорости движения газовой среды при высоких температурах, как и повышение давления, может вызвать увеличение скорости окисления металла или сплава.
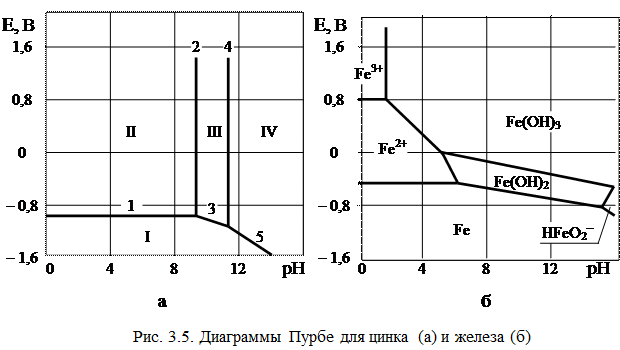
Диаграммы Пурбе
Бельгийский ученый Пурбе по термодинамическим данным построил диаграммы состояния металл-вода. Эти диаграммы позволяют оценить возможность протекания процесса коррозии для всех технически важных металлов. Диаграммы учитывают три возможных типа равновесия в системе металл-вода. 1) Равновесия, связанные с обменом электрическими зарядами:
2) Равновесия, не связанные с обменом электрическими зарядами:
Эти равновесия определяются только величиной pH и не зависят от потенциала. Линии, характеризующие эти равновесия, параллельны оси потенциалов (рис. 3.3). 3) Равновесия, зависящие как от потенциала, так и от pH, например, на металл-оксидных электродах:
Потенциал такого электрода определяется уравнением: E OH - /Me = E0 OH - /Me - - 0,059pH т.е. линия равновесия имеет наклон (рис. 3.4). На рис. 3.5, а приведена одна из наиболее простых диаграмм Пурбе – диаграмма для цинка. Она имеет четыре области: I – область термодинамической устойчивости; II, IV – области коррозии; III – область пассивности. Линии диаграммы отвечают следующим равновесиям: 1 – 2 – 3 – 4 – 5 –
Таким образом, в области II устойчив ион цинка, а в области IV – ион цинката. Пассивность цинка в области III обусловлена образованием пленки малорастворимого гидроксида цинка Zn(OH)2. На рис. 3.5, б представлена диаграмма для железа. Она имеет две области коррозии: в первой из них стабильны ионы двух- и трехвалентного железа, а во второй – феррат-ион. Положения областей термодинамической стабильности, коррозии и пассивности существенно зависят от присутствия в растворе различных анионов, например, хлорид, сульфат- и т.п. анионов. Классические диаграммы Пурбе не дают данных о возможности протекания коррозии в присутствии «посторонних» ионов.
Пассивность металлов Общие положения
Явление пассивации было открыто более 150 лет назад английским физиком М. Фарадеем, хотя первое описание этого явления встречается в трудах М.В. Ломоносова (1738 г). Пассивность металла – это состояние относительно высокой коррозионной стойкости, вызванное торможением анодной реакции ионизации металла в определенной области потенциалов.
С точки зрения термодинамики смещение потенциала электрода в положительную сторону должно приводить к увеличению вероятности протекания электрохимической реакции растворения металла, но на практике этого не происходит. При пассивации металла наблюдается существенное отклонение зависимости скорости анодного процесса от сдвига потенциала в электроположительную область: вместо увеличения происходит уменьшение скорости анодного процесса.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 122; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.21.158.148 (0.16 с.) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
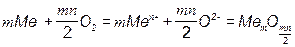
 (2.5)
(2.5)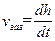 , (2.7)
, (2.7)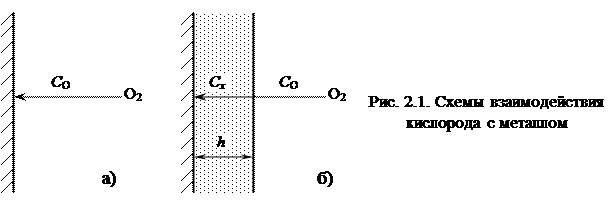 Возможны два случая окисления металла. Если на поверхности металла отсутствует оксидная пленка или она очень тонкая или пористая (несплошная Vок/Vмет < 1), то процесс коррозии контролируется реакцией взаимодействия металла с кислородом и рост пленки протекает при кинетическом контроле (рисунок 2.1 a).
Возможны два случая окисления металла. Если на поверхности металла отсутствует оксидная пленка или она очень тонкая или пористая (несплошная Vок/Vмет < 1), то процесс коррозии контролируется реакцией взаимодействия металла с кислородом и рост пленки протекает при кинетическом контроле (рисунок 2.1 a). , (2.8)
, (2.8) . (2.9)
. (2.9)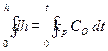 . (2.10)
. (2.10)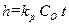 . (2.11)
. (2.11)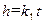 . (2.12)
. (2.12)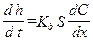 . (2.13)
. (2.13)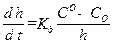 . (2.14)
. (2.14) . (2.15)
. (2.15)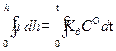 . (2.16)
. (2.16)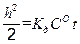 или
или 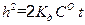 (2.17)
(2.17) . (2.19)
. (2.19) , (2.20)
, (2.20) , (2.21)
, (2.21) На рис. 2.2. представлены зависимости для линейного, параболического и логарифмического законов окисления.
На рис. 2.2. представлены зависимости для линейного, параболического и логарифмического законов окисления.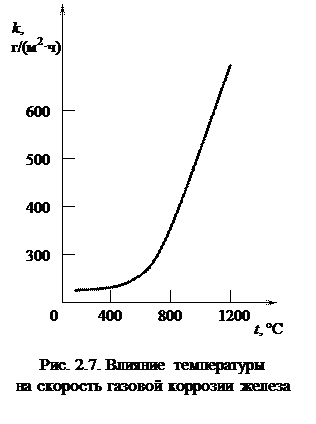 Характер влияния температуры на скорость коррозии металлов определяется двумя конкурирующими факторами: как было показано выше, термодинамическая возможность протекания процессов окисления металла с повышением температуры уменьшается, в то же время повышение температуры вызывает увеличение константы скорости реакции окисления металла, как это следует из уравнения Аррениуса, а также рост скорости диффузии реагентов в пленке продуктов коррозии. В целом с повышением температуры увеличивается скорость химической коррозии металлов и сплавов. Зависимость скорости коррозии металлов от температуры близка к экспоненциальной (рис. 2.7).
Характер влияния температуры на скорость коррозии металлов определяется двумя конкурирующими факторами: как было показано выше, термодинамическая возможность протекания процессов окисления металла с повышением температуры уменьшается, в то же время повышение температуры вызывает увеличение константы скорости реакции окисления металла, как это следует из уравнения Аррениуса, а также рост скорости диффузии реагентов в пленке продуктов коррозии. В целом с повышением температуры увеличивается скорость химической коррозии металлов и сплавов. Зависимость скорости коррозии металлов от температуры близка к экспоненциальной (рис. 2.7). При окислении металлов, склонных к пассивации, при постоянной и достаточно высокой температуре с повышением парциального давления кислорода скорость окисления увеличивается, а затем при достижении некоторого критического давления резко уменьшается и в широком диапазоне давлений остается постоянной и достаточно низкой.
При окислении металлов, склонных к пассивации, при постоянной и достаточно высокой температуре с повышением парциального давления кислорода скорость окисления увеличивается, а затем при достижении некоторого критического давления резко уменьшается и в широком диапазоне давлений остается постоянной и достаточно низкой.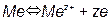 .
.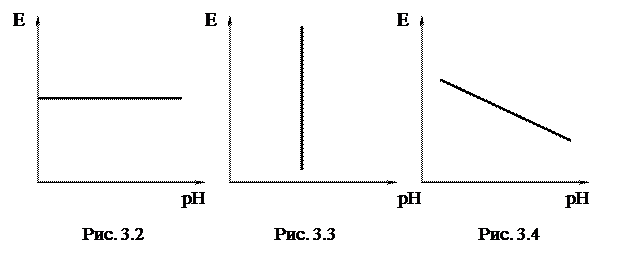 Эти равновесия определяются только величиной потенциала и не зависят от pH. Линии, характеризующие эти равновесия, параллельны оси pH (рис. 3.2).
Эти равновесия определяются только величиной потенциала и не зависят от pH. Линии, характеризующие эти равновесия, параллельны оси pH (рис. 3.2).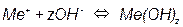 .
.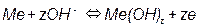 .
.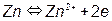 ;
;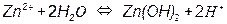 ;
;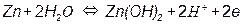 ;
;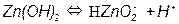 ;
;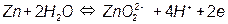 .
.
 Металл, находящийся в пассивном состоянии, практически не корродирует, несмотря на то, что его потенциал значительно (на сотни мВ) смещен в область электроположительных потенциалов от стационарного значения. Металл или сплав считается пассивным, если он стоек к коррозии в среде, в которой должно произойти достаточно большое понижение свободной энергии при переходе его из металлического состояния в соответствующие продукты коррозии.
Металл, находящийся в пассивном состоянии, практически не корродирует, несмотря на то, что его потенциал значительно (на сотни мВ) смещен в область электроположительных потенциалов от стационарного значения. Металл или сплав считается пассивным, если он стоек к коррозии в среде, в которой должно произойти достаточно большое понижение свободной энергии при переходе его из металлического состояния в соответствующие продукты коррозии.


