
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Стационарный потенциал металла
Уравнение Нернста (3.3) позволяет вычислить величину потенциала металла, погруженного в раствор собственных ионов. В этом случае проходит обмен ионами между металлом и раствором (Me – ze I а = I к = I 0. (3.6) Если металл погружен в раствор собственных ионов, устанавливается обратимое (равновесное) значение потенциала, которое можно вычислить по уравнению Нернста. Такие условия характеризуются уравнением (3.6), когда прямой и обратный процессы обеспечиваются перемещением через границу металл-раствор только одного сорта ионов – ионов металла. В этом случае не наблюдается потерь металла (Δm = 0). В реальных условиях, когда металл корродирует, процесс обмена ионами не осуществляется только одним сортом ионов. При этом анодный процесс обеспечивается в основном ионами металла, а катодный – ионами водорода (если катодный процесс – водородная деполяризация). Установившийся при этом не изменяющийся во времени потенциал называется необратимым или стационарным. При таком значении потенциала сохраняется равенство суммарного анодного и катодного токов:
Но в этом случае IMe а > IMe к, и, следовательно, происходит убыль металла (Δm > 0). Стационарные электродные потенциалы нельзя вычислить с помощью уравнения Нернста, их можно определить только опытным путем. На их величину влияют различные факторы: химическая природа металлов (≤ 4 В), состояние поверхности металла (десятые доли вольта), адсорбция атомов и молекул (сотые и десятые доли вольта), механические напряжения (сотые доли вольта), химическая природа и концентрация раствора (до вольта), изменение температуры (сотые вольта на 10 °С). В табл. 3.2 приведены значения электродных потенциалов некоторых металлов, полученных в 3 %-ом растворе NaCl. Таблица 3.2 Значения стационарных потенциалов
Таким образом, реальный коррозионный процесс характеризуется величиной стационарного значения электродного потенциала, при котором одновременно протекают анодная и катодная реакции.
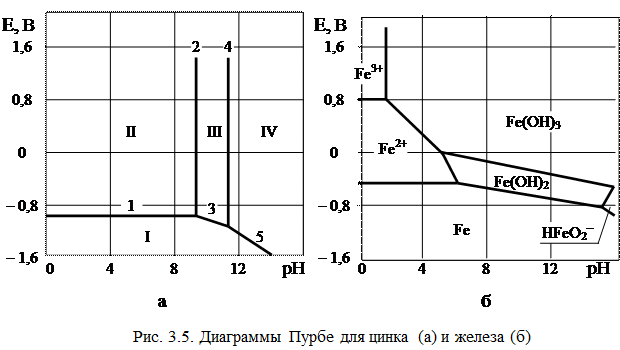
Диаграммы Пурбе
Бельгийский ученый Пурбе по термодинамическим данным построил диаграммы состояния металл-вода. Эти диаграммы позволяют оценить возможность протекания процесса коррозии для всех технически важных металлов. Диаграммы учитывают три возможных типа равновесия в системе металл-вода. 1) Равновесия, связанные с обменом электрическими зарядами:
2) Равновесия, не связанные с обменом электрическими зарядами:
Эти равновесия определяются только величиной pH и не зависят от потенциала. Линии, характеризующие эти равновесия, параллельны оси потенциалов (рис. 3.3). 3) Равновесия, зависящие как от потенциала, так и от pH, например, на металл-оксидных электродах:
Потенциал такого электрода определяется уравнением: E OH - /Me = E0 OH - /Me - - 0,059pH т.е. линия равновесия имеет наклон (рис. 3.4). На рис. 3.5, а приведена одна из наиболее простых диаграмм Пурбе – диаграмма для цинка. Она имеет четыре области: I – область термодинамической устойчивости; II, IV – области коррозии; III – область пассивности. Линии диаграммы отвечают следующим равновесиям: 1 – 2 – 3 – 4 – 5 –
Таким образом, в области II устойчив ион цинка, а в области IV – ион цинката. Пассивность цинка в области III обусловлена образованием пленки малорастворимого гидроксида цинка Zn(OH)2. На рис. 3.5, б представлена диаграмма для железа. Она имеет две области коррозии: в первой из них стабильны ионы двух- и трехвалентного железа, а во второй – феррат-ион. Положения областей термодинамической стабильности, коррозии и пассивности существенно зависят от присутствия в растворе различных анионов, например, хлорид, сульфат- и т.п. анионов. Классические диаграммы Пурбе не дают данных о возможности протекания коррозии в присутствии «посторонних» ионов.
Пассивность металлов Общие положения
Явление пассивации было открыто более 150 лет назад английским физиком М. Фарадеем, хотя первое описание этого явления встречается в трудах М.В. Ломоносова (1738 г).
Пассивность металла – это состояние относительно высокой коррозионной стойкости, вызванное торможением анодной реакции ионизации металла в определенной области потенциалов.
С точки зрения термодинамики смещение потенциала электрода в положительную сторону должно приводить к увеличению вероятности протекания электрохимической реакции растворения металла, но на практике этого не происходит. При пассивации металла наблюдается существенное отклонение зависимости скорости анодного процесса от сдвига потенциала в электроположительную область: вместо увеличения происходит уменьшение скорости анодного процесса. Пассивное состояние, как правило, наступает при контакте металлов с сильными окислителями, такими, как O2, H2O2, хромат-ионы (CrO42–), бихромат-ионы (Cr2O72–), перманганат-ионы (MnO42–) и др. Уменьшение скорости коррозии обуславливается образованием на поверхности металла его гидроксида. Многие металлы в той или иной степени в зависимости от условий склонны пассивироваться, но наибольшей склонностью к пассивации обладают Fe, Cr, Ni, Ti, Al. Это их качество обусловлено тем, что образующиеся при их пассивации гидроксиды имеют малую растворимость в коррозионной среде. Явление пассивности имеет большое практическое значение, т.к. позволяет существенно снизить коррозионные потери металлов. Основным методом исследования пассивности является метод съемки потенциостатических анодных поляризационных кривых: потенциал анода – плотность тока (либо логарифм плотности тока). Схема типичной анодной потенциостатической поляризационной кривой приведена на рис. 3.6. На этой кривой имеются четыре характерных участка. 1 – область активного состояния металла, когда он ведет себя как растворимый анод, в этой области металл при потенциале, более положительном, чем стационарный Eст, переходит в ионное состояние, например, железо переходит в ионы железа: Fe – 2e = Fe2+. 2 – область формирования пассивного состояния, которое наступает после достижения потенциала пассивации Eп. и тока пассивации iп.. В этой области скорость растворения металла (анодной реакции) снижается при сдвиге потенциала в область более электроположительных потенциалов. Это явление вызвано образованием на поверхности металла различных пленок оксидов или гидроксидов металла согласно уравнениям реакций: Me + zH2O – 2ze → MeOz + 2zH+; Me + zOН– – ze → Me(OH)z. 3 – область пассивности, наступающая при достижении потенциала полной пассивации Eп.п.. Область пассивности характерна тем, что в ее пределах скорость растворения металла остается постоянной и соответствует величине плотности тока полной пассивации iп.п.. Металл в пассивном состоянии не является абсолютно инертным. Величина тока полной пассивации, хотя и может быть ничтожно малой, но никогда не достигает нулевого значения. При смещении потенциала, находящегося в пассивном состоянии, в область потенциалов, отрицательнее Eп.п., происходит увеличение тока коррозии. При этом протекают процессы:
MeOz + 2ze + 2zH+ → Me + zH2O; Me(OH)z + ze → Me + zOН–. Если в коррозионной среде присутствуют ионы-активаторы, например, Cl–, то наступает преждевременное нарушение пассивного состояния металла: Me + zCl– → MeClz + ze. Этот процесс протекает при потенциале пробоя Eпр., при этом происходит как бы прорыв пассивной пленки в наиболее слабых ее местах. Обычно это происходит в растворах ионов: Cl –, Br –, I –, CN – , SO4– . Область протекания процесса характеризуется кривой ПР и здесь протекает точечная коррозия металла. Потенциал Eпр. еще называют потенциалом питтингообразования. 4 – область перепассивации, которая начинается по достижении потенциала перепассивации Eпер.. В этой области с увеличением положительного значения потенциала ток растворения металла растет. В отличие от области активного растворения (участок 1) металл, находящийся в пассивном состоянии, растворяется с образованием ионов высшей степени окисления. Так, железо в активной области переходит в раствор в виде Fe2+, а в области перепассивации – в виде Fe3+: Fe – 3e → Fe3+. Если для металла не характерно явление перепассивации, то смещение потенциала в электроположительную область может вызвать или выделение кислорода (разложение воды): 2H2O → 4H+ + O2 + 4e, или протекание процесса анодирования – образования толстого слоя оксила, – например, при анодной обработке алюминиевых сплавов. Первый из этих процессов начинается при достижении потенциала начала выделения кислорода EО2, второй – потенциала анодирования Eан. Для практических целей необходимо: - чтобы область потенциалов, в которой металл находится в пассивном состоянии, была как можно шире, т.е. чтобы Eп.п. был как можно более электроотрицателен, а Eпер. – как можно более электроположителен; - iп. и iп.п. должны быть минимальными. Указанные области при изменении состава раствора, состава сплава и температуры могут частично исчезать. Например, при снижении рН и увеличении концентрации хлора пассивная область сокращается; увеличение температуры расширяет участок аномального растворения; уменьшение содержания хрома в легированной стали снижает активное растворение, сокращает пассивную область. Переход металла в пассивное состояние и не зависят от природы окислителя, действующего на металл, а зависит лишь от величины потенциала.
Пассиваторы и депассиваторы
Вещества или процессы, вызывающие в определенных условиях наступление пассивного состояния металлов, называются пассиваторами. Пассиваторами являются некоторые вещества окислители и процесс анодной поляризации. Вещества-окислители (например, HNO3, NaNO3, NaNO2, Na2NO4, K2CrO4, O2) имеют большое сродство к металлу и высокую энергию образования новых веществ (хемосорбция). Кислород при хемосорбции пассивирует поверхность, в то время как ионы хлора из-за очень низких энергий образования образуют хлориды металла, вытесняя адсорбированные на поверхности металла атомы пассиватора, способствуя растворению пассивирующих пленок и переходу ионов металла в раствор. К пассиваторам относится также процесс анодной поляризации (т.е. окисление соприкасающейся с раствором электролита поверхности металла электрическим током) от внешнего источника постоянного электрического тока или при работе металла в качестве анода в паре с другим металлом, являющимся катодом. Пассивное состояние металла может сохраняться и после изменения внешних пассивных условий. Железный образец запассивированный в HNO3 (конц.) длительное время сохраняет пассивность в сухом воздухе. При изменении внешних условий пассивный металл может перейти в активное состояние. Этот процесс называется активацией, или депассивацией. Вещества или процессы, нарушающие пассивное состояние металлов или затрудняющих наступление их пассивности, называются активаторами, или депассиваторами. Активаторами являются: 1) вещества-восстановители (например, H2, Na2SO3, Na2S2O3 и др.); 2) процесс катодной поляризации (т.е. восстановление соприкасающейся с раствором электролита поверхности металла электрическим током) от внешнего источника постоянного тока или при работе пассивного металла в качестве катода в паре с другим металлом, являющимся анодом; 3)некоторые ионы (например, H+, галлоидные ионы Cl–,F–,Br–, а также SO42– и др.), которые поэтому называют активными ионами; 4) повышение температуры; 5)механическое нарушение пассивной поверхности металла, например, царапание, если запассивированный металл не находится в пассивирующей среде. На поверхности металла возникают при этом гальванические пары: царапина (анод) и неповрежденная пассивная поверхность (катод). В результате катодный восстановительный процесс на пассивных участках металла оказывает активирующее действие и металл разрушается.
Теории пассивности металлов
Существуют две основные теоретические концепции, объясняющие пассивность металла - пленочная и адсорбционная. Согласно пленочной теории пассивность наступает в результате образования на поверхности металла фазовой пленки толщиной в единицы и десятки нанометров. Эта пленка может представлять собой слой оксида или гидроксида металла и может быть гидратирована в различной степени. Пленочная теория, основанная на том, что кислород химически связан с поверхностью металла, не может объяснить все известные факты в области пассивности. Во многих случаях фазовой пленки на поверхности металла не обнаруживается, тем не менее, металл находится в пассивном состоянии.
Согласно адсорбционной теории пассивация металла наступает в результате адсорбции кислорода на поверхности металла. Причем пассивность может наступать даже тогда, когда по расчетам количество адсорбированного кислорода таково, что поверхность металла не может быть полностью покрыта слоем кислорода толщиной в одну молекулу. Часто бывает достаточно, чтобы весьма малая доля поверхности (около 1 %) была закрыта адсорбированными молекулами кислорода. Этот факт объясняется тем, что на поверхности металла имеется небольшое число активных мест, и адсорбция именно на этих местах резко снижает скорость растворения металла. Адсорбированные молекулы кислорода закрывают активные места на металле и тем самым блокируют процесс ионизации металла в этих наиболее активных местах. Считают, что молекулы кислорода, вызывающие пассивацию металла, образуются из молекул воды или ионов гидроксила, адсорбированных на поверхности металла, по уравнениям: 2H2Oадс – 4e → O2 + 4H+; 2OH–адс – 4e → O2 + 2H+. Изучение явления пассивности привело к важным практическим следствиям. 1) Установлена возможность анодной защиты металлов, склонных к пассивации, т.е. внешней анодной поляризацией можно затормозить процесс ионизации металла. Здесь нужно остерегаться «перезащиты» – возможности сдвига потенциала положительнее Eпер., при котором начинается процесс перепассивации. 2) Показана возможность применения окислителей для защиты металлов от коррозии. Например, насыщение коррозионной среды кислородом, являющимся катодным деполяризатором в нейтральных и щелочных средах и ускоряющим процесс на катодных участках металла, способно затормозить процесс коррозии, так как при этом наступает пассивация металла. 3) Найден метод катодного легирования металлов. Он заключается в том, что в металл, склонный к пассивации, добавляют малые количества легирующих металлов, имеющих значительно более электроположительный потенциал, чем защищаемый металл. Легирующим катодным элементом чаще всего бывает медь. На катодном включении катодные реакции протекают с низким перенапряжением и, тем самым, они обеспечивают в условиях низкой катодной поляризации протекание через коррозионную систему значительного коррозионного тока. Это приводит к сдвигу потенциала защищаемого металла (анод) в область пассивности и металл, таким образом, как бы автоматически поддерживается в пассивном состоянии. Любое случайное нарушение этого состояния вновь приводит в действие коррозионную систему «защищаемый металл (анод) – добавка (катод)», в результате чего снова происходит сдвиг потенциала металла в пассивную область.
|
|||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 329; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.145.151.141 (0.038 с.) |
 Mez+). Скорости перехода ионов в прямом I а и обратном I к направлениях равны между собой и равны току обмена I0:
Mez+). Скорости перехода ионов в прямом I а и обратном I к направлениях равны между собой и равны току обмена I0: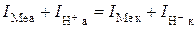 (3.7)
(3.7)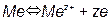 .
.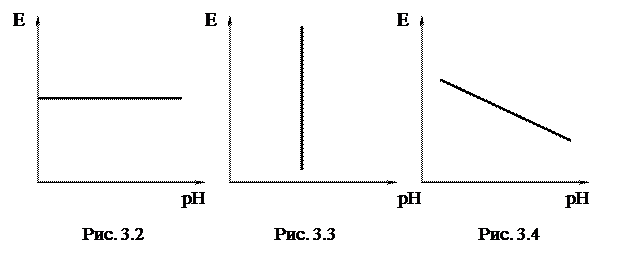 Эти равновесия определяются только величиной потенциала и не зависят от pH. Линии, характеризующие эти равновесия, параллельны оси pH (рис. 3.2).
Эти равновесия определяются только величиной потенциала и не зависят от pH. Линии, характеризующие эти равновесия, параллельны оси pH (рис. 3.2).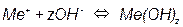 .
.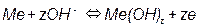 .
.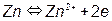 ;
;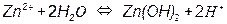 ;
;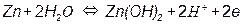 ;
;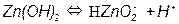 ;
;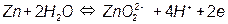 .
.
 Металл, находящийся в пассивном состоянии, практически не корродирует, несмотря на то, что его потенциал значительно (на сотни мВ) смещен в область электроположительных потенциалов от стационарного значения. Металл или сплав считается пассивным, если он стоек к коррозии в среде, в которой должно произойти достаточно большое понижение свободной энергии при переходе его из металлического состояния в соответствующие продукты коррозии.
Металл, находящийся в пассивном состоянии, практически не корродирует, несмотря на то, что его потенциал значительно (на сотни мВ) смещен в область электроположительных потенциалов от стационарного значения. Металл или сплав считается пассивным, если он стоек к коррозии в среде, в которой должно произойти достаточно большое понижение свободной энергии при переходе его из металлического состояния в соответствующие продукты коррозии.


