
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Влияние состава газовой среды
На скорость газовой коррозии металлов и сплавов в газовой среде влияют такие внешние факторы как состав и давление газовой среды, ее скорость движения, температура, режим нагрева. Металлы при высоких температурах взаимодействуют с кислородом, парами воды, оксидом углерода (IV), оксидом серы (IV) по схеме: 2Ме + О2 = 2МеО; Me + СО2 = МеО + СО; Ме + Н2O = МeО + Н2; 3Me + SO2 = 2MeO + MeS. Константа скорости этих химических реакций и защитные свойства образующихся пленок различны. Это и определяет различные скорости окисления металлов. При температуре 900 °С скорость окисления железа, кобальта и никеля возрастает в ряду: Н2О → СО2 → О2 → SO2. Медь же практически не корродирует в атмосфере оксида серы (IV). Вольфрам при температуре 900 °С наибольшую скорость газовой коррозии проявляет в атмосфере кислорода – в атмосфере оксида углерода (IV). В парах воды, в атмосфере СО2, О2, и SО2 скорость газовой коррозии металлов увеличивается в ряду Сr → Ni → Со → Fe. На скорость газовой коррозии металлов в воздухе большое влияние оказывают примеси. Относительные скорости газовой коррозии стали с 0,17 % углерода при 900 °C в воздухе, содержащем различные примеси, приведены в табл. 2.6. Таблица 2.6 Относительные скорости газовой коррозии стали с 0,17% углерода в воздухе, содержащем различные примеси
Из табл. 2.6. следует, что загрязнение воздуха оксидом углерода (IV), оксидом серы (IV), парами воды вызывает повышение скорости газовой коррозии малоуглеродистой стали. Это обусловлено увеличением количества несовершенств в пленке. При нагревании в атмосфере, содержащей О2, СО2, Н2O, помимо окисления может происходить также обезуглероживание: Fe3C + 1/2O2 = 3Fe + CO; Fe3C + CO2 = 3Fe + 2CO: Fe3C + H2O (пар) = 3Fe + CO + H2. Окисление углерода происходит на поверхности стали: из прилегающего слоя он диффундирует на поверхность стали и окисляется. Обезуглероживание может происходить также при нагревании в атмосфере, содержащей Н2, который диффундирует в сталь и реагирует с углеродом: Fe3C + 2H2 = 3Fe + CH4. Процесс проникновения водорода в сталь называется наводораживанием. Наводораживание происходит только при наличии на поверхности металла адсорбированных атомов водорода. При повышенных температурах в атмосфере молекулярного водорода устанавливается равновесие с образованием на поверхности стали адсорбированного атомарного водорода, который затем проникает вглубь стали. При комнатной температуре молекулы водорода не диссоциируют, поэтому при этой температуре наводораживания стали не происходит.
С повышением парциального давления молекулярного водорода увеличивается концентрация адсорбированного водорода, в результате чего увеличивается наводораживание стали, причем
где СН – концентрация атомов водорода в стали;
k – коэффициент пропорциональности. Наводораживание стали при повышенных температурах может происходить при выплавке, сварке, термодинамической обработке и в отсутствии водорода (в присутствии паров воды): Fe + H2O (пар) = 3FeO + H2; H2 → H2 адс → 2H – наводораживание. Наводораживание металлов резко уменьшает пластичность и прочность металлов и сплавов. В процессе горения топлива возможно образование оксида ванадия. Зола с V2O5 попадает на поверхность стальных деталей и способствует повышению скорости окисления стали. Это явление получило название ванадиевой коррозии. Причина ванадиевой коррозии заключается в легкоплавкости V2O5 и способности растворять железо и оксидные пленки на железе с образованием соединений ванадия: Fe2O3 + V2O5 = 2FeVO4 4Fe + 3V2O5 = 2Fe2O3 + 3V2O3 Образующиеся V2O3 и FeVO4 принимают участие в последующих реакциях: V2O3 + О2 = V2O5 6FeVO4 + 4Fe = 5Fe2O3 + 3V2O3 Аналогичным образом оксид пятивалентного ванадия V2O5 реагирует с оксидами никеля и хрома. При этом защитная пленка разрушается, в ней образуются поры, и скорость коррозии металла увеличивается.
Влияние температуры
Температура существенно влияет на скорость процессов химической коррозии металлов. С повышением температуры процессы окисления металлов протекают значительно быстрее, несмотря на уменьшение термодинамической возможности.
Температура оказывает влияние на константу скорости химической реакции и на коэффициент диффузии (для процесса диффузии). Для обоих случаев имеет место экспоненциальная зависимость:
k = A exp(-E/RT), (2.24) где к — константа скорости химической реакции или коэффициент диффузии; А — постоянная независящая от температуры; Е — энергия активации химической реакции или процесса диффузии; R — газовая постоянная; Т — абсолютная температура. Если прологарифмировать уравнение (2.24), то получим
ln k = ln A – E/RT. (2.25)
Температурная зависимость в координатах ln k — 1/T выражается прямой линией, для которой (-E/R) равно тангенсу угла наклона. При повышении температуры коэффициент скорости химической реакции растёт быстрее, чем коэффициент диффузии. Это приводит к тому, что при определенной температуре скорость химической реакции уравнивается со скоростью диффузии, а потом превышает ее. Процесс начинает контролироваться стадией диффузии. На зависимости lnk — 1/Т этот эффект будет связан с изменением наклона прямой линии. Температура может оказывать влияние также на состав образующихся пленок и закон их роста (табл. 2.7). При окислении меди при температурах ниже 1025 °С образуются Сu2О, и СuО, а при температурах выше 1025 °C – только Сu2О. Закон роста пленок на меди при изменении температуры также изменяется. Таблица 2.7 Составы и законы роста оксидных пленок железа при различных температурах
Большое влияние на скорость окисления металлов оказывает режим нагрева. Колебания температуры при нагреве и особенно попеременный нагрев и охлаждение вызывают разрушение пленок вследствие возникновения больших внутренних напряжений, в результате чего скорость окисления металла увеличивается. Влияние давления
На скорость окисления металлов оказывает влияние парциальное давление кислорода. Если окисление металла лимитируется химической реакцией, то скорость коррозии увеличивается пропорционально корню квадратному от величины давления кислорода (рис. 2.8).
Явление уменьшения скорости газовой коррозии при повышении парциального давления кислорода называется высокотемпературной пассивацией. Пассивное состояние металла объясняется образованием на его поверхности совершенной пленки. При значительном увеличении парциального давления кислорода выше критического у некоторых нержавеющих сталей происходит нарушение пассивного состояния, что приводит к увеличению скорости окисления стали. Повышение скорости движения газовой среды при высоких температурах, как и повышение давления, может вызвать увеличение скорости окисления металла или сплава.
|
|||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-05-12; просмотров: 223; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.137.243 (0.01 с.) |
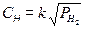 , (2.23)
, (2.23)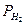 – парциальное давление молекулярного водорода;
– парциальное давление молекулярного водорода; Характер влияния температуры на скорость коррозии металлов определяется двумя конкурирующими факторами: как было показано выше, термодинамическая возможность протекания процессов окисления металла с повышением температуры уменьшается, в то же время повышение температуры вызывает увеличение константы скорости реакции окисления металла, как это следует из уравнения Аррениуса, а также рост скорости диффузии реагентов в пленке продуктов коррозии. В целом с повышением температуры увеличивается скорость химической коррозии металлов и сплавов. Зависимость скорости коррозии металлов от температуры близка к экспоненциальной (рис. 2.7).
Характер влияния температуры на скорость коррозии металлов определяется двумя конкурирующими факторами: как было показано выше, термодинамическая возможность протекания процессов окисления металла с повышением температуры уменьшается, в то же время повышение температуры вызывает увеличение константы скорости реакции окисления металла, как это следует из уравнения Аррениуса, а также рост скорости диффузии реагентов в пленке продуктов коррозии. В целом с повышением температуры увеличивается скорость химической коррозии металлов и сплавов. Зависимость скорости коррозии металлов от температуры близка к экспоненциальной (рис. 2.7). При окислении металлов, склонных к пассивации, при постоянной и достаточно высокой температуре с повышением парциального давления кислорода скорость окисления увеличивается, а затем при достижении некоторого критического давления резко уменьшается и в широком диапазоне давлений остается постоянной и достаточно низкой.
При окислении металлов, склонных к пассивации, при постоянной и достаточно высокой температуре с повышением парциального давления кислорода скорость окисления увеличивается, а затем при достижении некоторого критического давления резко уменьшается и в широком диапазоне давлений остается постоянной и достаточно низкой.


