Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Классификация и клиническая картинаСтр 1 из 13Следующая ⇒
Гемангиома младенческая
МКБ 10: D18.0
Возрастная группа: дети
Год утверждения:2020
Профессиональные ассоциации: Российская ассоциация детских хирургов II. Оглавление Ключевые слова Список сокращений Термины и определения Краткая информация Диагностика Лечение Реабилитация Профилактика Дополнительная информация, влияющая на течение и исход заболевания Критерии оценки качества медицинской помощи Список литературы Приложение А1. Состав рабочей группы Приложение А2. Методология разработки клинических рекомендаций Приложение Б. Алгоритмы ведения пациента Приложение В. Информация для пациентов Приложение Г. Шкалы оценки
Ключевые слова Младенческая гемангиома Инфантильная гемангиома Сосудистые аномалии III. Список сокращений АФП — α-фетопротеин КГЭ — капошиформная гемангиоэндотелиома КТ — компьютерная томография МГ — младенческая гемангиома МРТ — магниторезонансная томография УЗИ — ультразвуковое исследование ЦДК — цветное дуплексное картирование ЭхоКГ — эхокардиография IV. Термины и определения Новые и узконаправленные профессиональные термины в настоящих клинических рекомендациях не используются V. Краткая информация Определение Младенческие гемангиомы (МГ) это доброкачественная сосудистая опухоль, которая развивается из эндотелиальной ткани, отличительными особенностями которой являются, появление у младенцев первых месяцев жизни и способность к инволюции в течении последующих лет. Продолжительность и скорость роста варьирует; у некоторых детей гемангиомы практически не растут, тогда как у других они растут быстро и непредсказуемо. 12% МГ являются опасными для пациента и требуют лечения [1]. Этиология и патогенез Патогенез младенческой гемангиомы остается не до конца изученным. В настоящее время существуют три основные гипотезы, которые, однако, не исключают друг друга: (1) теория тканевой гипоксии, (2) теория эмболизации эндотелиальных клеток плаценты и (3) теория повышенной ангиогенной и васкулогенной активности. Гипоксия тканей, по-видимому, является наиболее мощным индуктором ангиогенеза (и васкулогенеза). Была обнаружена связь между гипоксией плода и МГ [2]. Кроме того, связь между низкой массой тела при рождении и МГ и связь между ретинопатией недоношенных и МГ указывает на гипоксию [3].
Теория плацентарной эмболии привлекательна тем, что объясняет запрограммированный жизненный цикл МГ. МГ может представлять собой доброкачественные метастазы плаценты или других клеток, которые пролиферируют в областях с низким парциальным давлением кислорода, таких как «концевые артерии или сосудистые тупики», возникающие в областях слияния лицевых отростков [4]. GLUT-1 сильно экспрессируется как в МГ так и в плаценте. Кроме того, МГ, как и плацента экспрессируют другие молекулярные маркеры, такие как мерозин, ламинин, антиген Lewis Y, FcγRII, IDO и IGF-2. Таким образом плаценту можно считать источником МГ [5]. Васкулогенез и ангиогенез. (Васкулогенез - это процесс формирования сосудов из мезенхимальных клеток de novo, в то время как ангиогенез – это процесс формирования новых сосудов на осонве уже существующих, где основную роль играют миграция и пролиферация эндотелиоцитов). Мезенхимные клетки, выделенные из пролиферирующих МГ способны дифференцироваться в эндотелиальные клетки, перициты (периваскулярные клетки) и адипоциты [6]. При имплантации мышам стволовых клеток из МГ образовывались GLUT-1-положительные сосуды. Это доказывает, что васкулогенез является важным механизмом в развитии МГ [7]. Эндотелий капилляров, полученный из образцов гемангиомы, формирует капиллярные трубки в культуре ткани - «ангиогенез in vitro» [8]
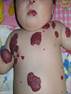
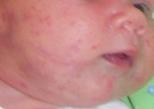
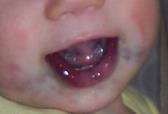
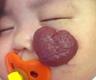
Эпидемиология Младенческие гемангиомы поражают около 4% всех детей и до 30% недоношенных. Девочки болеют младенческими гемангиомами в 3 раза чаще мальчиков. Наиболее частой локализацией МГ являются кожные покровы, гораздо реже поражаются печень и другие внутренние органы. Кодирование по МКБ-10 Гемангиома любой локализации (D18.0) Виды младенческих гемангиом По распространенности различают единичные, множественные и сегментарные (занимающие одну или несколько анатомических областей) МГ (рис. 1).
Рис. 1. Множественные МГ кожных покровов. Двухсторонняя сегментарная МГ лица.
По отношению к кожным покровам можно выделить следующие формы МГ: поверхностные, глубокие и комбинированные МГ (рис. 2).
Рис. 2. Различные формы МГ: а – поверхностная, б – глубокая, в – комбинированная.
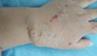
Редкой формой МГ кожных покровов являются ретикулярные МГ (рис. 3). Поверхностные, в виде ретикулярно-макулярных элементов, могут ошибочно приниматься за сосудистую мальформацию. Характеризуются медленным ростом. Могут быть сегментарными. Чаще других сочетаются с трофическими язвами, различными пороками развития, в том числе пороками магистральных сосудов. [10]
Рис. 3. Ретикулярная МГ предплечья.
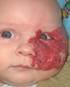
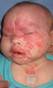
МГ внутренних органов встречаются гораздо реже МГ кожных покровов, при этом часто сочетаются в множественными МГ кожных покровов. Наиболее часто, из висцеральный МГ, встречаются гемангиомы печени, гораздо реже – селезенки. Редко встречаются МГ кишечника, брыжейки, средостения но возможна любая локализация. PHACES-синдром Обширные МГ области лица могут сочетаться с неврологическими, офтальмологическими, сердечнососудистыми или другими аномалиями. Название синдрома представляет собой первые буквы основных патологических стояний, характерных для него (табл. 1). Табл. 1. Расшифровка аббревиатуры PHACES.
Для диагностики PHACES-синдрома, были разработаны следующие критерии: наличие по крайней мере сегментарной МГ лица (рис. 12) или крупная (> 5 см) МГ кожи головы в сочетании с одним или несколькими пороками развития, характерными для этого синдрома.
Рис. 12. Условное деление лица на сегменты, предложенное A. N. Haggstrom, по принципу типичной локализации МГ, сочетающейся с пороками развития. (1 - лобновисочный сегмент, 2 – верхнечелюстной сегмент, 3 – нижнечелюстной сегмент, 4 – лобноносовой сегмент) [14].
Рис. 13. PHACES-синдром. Обширная МГ лица, занимающей несколько сегментов в сочетании с расщелиной грудины.
Рис. 14. PHACES-синдром. Обширной МГ лица, занимающей несколько сегментов в сочетании с гипоплазией левого полушария мозжечка и коарктацией аорты. Внешний вид. МРТ головного мозга. 3D реконструкция КТ-ангиографии. На рис. 13 и 14 – примеры пациентов с PHACES-синдром. Пациенты с сегментарными МГ лица требуют срочного лечения, т.к. уже имеются или возможны грубые косметические и функциональные дефекты, ведь речь идет об обширном поражении лица. С другой стороны требуется дообследование, для исключения сочетанных пороков развития, в частности стенотических поражений сонных артерий и пороков сердца. Наличие таких поражений переводит больных в группу риска при терапии β-адреноблокаторами. В подобных случаях необходимо начинать терапию исходя из предположения, что имеются сочетанные пороки развития. Одновременно с этим следует проводить комплексное обследование, направленное на выявление или исключение этих пороков (более подробно см. Особенности терапии у больных с сегментарными МГ лица). Большие сегментарные МГ верхней половины тела (не лица) также могут быть связаны с аномалиями PHACES; феномен «PHACES без лица»[15].
LUMBAR-синдром Аналогично с PHACES-синдромом описано сочетание МГ каудального отдела с соответствующей группой пороков развития (Табл. 2) Табл. 2. Расшифровка аббревиатуры LUMBAR.
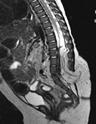
Пациенты с обширными МГ, расположенными в области поясницы, ягодиц, промежности или нижней конечности, и занимающими целые анатомические области, должны дообследоваться для исключения сочетанной патологии (рис. 15).
Рис. 15. LUMBAR-синдром. Обширная ретикулярная МГ поясницы, ягодицы и нижней конечности, занимающая несколько анатомических областей в сочетании с гипотрофией нижней конечности, трофической язвой ягодицы, пороком развития почек, незаращением душек позвонков и менингомеилоцеле. а – Внешний вид. б – КТ поясничного отдела позвоночника. в – МРТ поясничнокрестцового отдела позвоночника.
Гемангиомы печени Печень – наиболее частая локализация висцеральных гемангиом. Встречается два вида гемангиом печени: младенческие и врожденные, они идентичны аналогичным видам гемангиом кожных покровов. Каждая из них имеет свой специфический цикл развития и свой подход к лечению. Основным достоверным отличительным признаком врожденной гемангиомы печени от младенческой является иммуногистохимическая реакция на GLUT1. Однако обычно для постановки диагноза биопсия не требуется. Дело в том, что врожденные гемангиомы печени встречаются в виде единичного узла, тогда как МГ печени встречаются исключительно в вида множественных очагов. Поэтому на сегодняшний день классификация гемангиом печени основана на количестве опухолевых узлов в печени. Различают монофокальные, мультифокальные и диффузные гемангиомы печени.[16] Монофокальные (единичные) гемангиомы печени (т.е. располагающиеся единичным узлом) гистологически относятся к врожденным гемангиомам (не является МГ), хотя могут сочетаться с одной или несколькими МГ кожных покровов. Будучи врожденными гемангиомами, они растет внутриутробно, достигая своего максимального размера к рождению ребенка. Возможна их пренатальнаяя диагностика. Основной вид диагностики – УЗИ, но часто требуется дополнительное проведение МРТ или КТ для уточнения характера опухолевого процесса. Анализ крови на АФП помогает исключить злокачественные новообразования.
Перинатальные внутриопухолевые кровотечения являются обычным явлением и объясняются перераспределением печеночного кровотока. У новорожденного могут сразу же после рождения развиться значительная анемия, тромбоцитопения и легкая гипофибриногенемия [17]. Это состояние не следует путать с с-мом Казабаха-Мерритта, который также может появляться у детей первых недель или месяцев жизни. С-м Казабаха-Мерритта представляет собой специфическое осложнение капошиформной гемангиоэндотелиомы, которое не встречается в паренхиме печени. После рождения монофокальные гемангиомы печени в подавляющем большинстве случаев не растут и регрессируют самостоятельно. Контроль за динамикой регресса опухоли проводится с помощью УЗИ. Интервал между наблюдениями должен начинаться с 2-х недель, увеличиваясь на две недели всякий раз, когда динамика по УЗИ отсутствует или размеры опухоли уменьшаются [17]. В противном случае, надо расширять диагностические мероприятия вплоть до биопсии образования. До настоящего времени не известна эффективная медикаментозная терапия при монофакальных гемангиомах печени. Обычно бывает достаточно динамического наблюдения, в противном случае проводится эндоваскуклярная окклюзия или удаление опухоли. Мультифокальные (множественные) гемангиомы печени морфологически относится к типичным МГ. Как правило сочетаются с множественными (>5) МГ кожных покровов. Имеет ту же стадийность течения что и МГ кожных покровов. Для диагностики обычно бывает достаточно УЗИ, в сложных случаях проводится МРТ или КТ. Анализ крови на АФП исследуется, также как и при монофокальеных гемангиомах печени. Не следует забывать, что у новорожденных его нормальные значения намного выше, чем у взрослых, поэтому важен не единичный анализ, а снижение уровня АФП в динамике. Мониторинг при мультифокальных гемангиомах аналогичен таковому при монофокальных. Начальный интервал между контрольными УЗИ – 2 недели. Увеличение интервала на две недели при стабильной УЗ картине. Рекомендуется продолжать мониторинг до завершения инволюции гемангиом. При обширном поражении необходимо исследование крови на ТТГ для исключения вторичного гипотириоза. Медикаментозная терапия показана при обширном поражении и при признаках роста. При прогрессировании патологического процесса мультифокальные гемангиомы печени могут приобретать свойства диффузной гемангиомы. Диффузная гемангиома печени отличаются от мультифокальной гемангиомы степенью поражения паренхимы печени. При диффузной гемангиоме печени гемангиом так много, что они практически полностью замещают паренхиму печени. Является крайне тяжелым видом МГ. Первое, что должно насторожить врача у пациента с несколькими МГ кожных покровов, это увеличение объема живота за счет выраженной гепатомегалии (рис. 16), что является срочным показанием для УЗИ брюшной полости.
Рис. 16. Множественные МГ кожных покровов в сочетании с диффузной гемангиому печени. а - Внешний вид ребенка. Видимое увеличение объема живота. б – УЗИ печени. В паренхиме печени определяются множественные гипоэхогенные округлые образования с четкими контурами.
Проявлением диффузной гемангиомы печени является гепатомегалия, абдоменальный компартмент с-м (рис. 17) (повышение внутрибрюшного давления, приводящее к сдавлению органов как брюшной, так и грудной полости), тяжелый гипотиреоз и сердечная недостаточность в следствие объемной перегрузки.
Рис. 17. Диффузная гемангиома печени (тот-же ребенок). Резкое увеличение печени за счет множественных гемангиом, увеличение брюшной полости, уменьшение объема грудной полости с выраженным уменьшением дыхательного объема легких, гипертрофия правых отделов сердца.
Без адекватного лечения в этой группе пациентов наблюдается высокая летальность. Основными направлениями лечения у этих пациентов является системная терапия МГ (см. ниже), заместительная терапия гормонами щитовидной железы (по назначению эндокринолога), симптоматическая терапия при сердечной и легочной недостаточности.
VI. Диагностика Жалобы и анамнеза
При сборе анамнеза большую роль играет время появления сосудистого образования и скорость его роста (рис графика). Часто решающее значение могут иметь первые фотографии ребенка, сделанные родителями. Многие сосудистые мальформации, могут увеличиваться в размере, имитируя опухолевый рост. Это связано не с увеличением патологической клеточной массы, а с постепенной эктазией порочных сосудов. Сосудистые мальформации если увеличиваются со временем, то делают это гораздо медленней, чем МГ. (рис. 18).
Рис. 18. Венозная мальформация. Внешний вид ребенка. а – 10 дней; б – 5 мес; в – 1 год. Видно увеличение объема поражения с ростом ребенка, которое можно ошибочно принять за рост МГ.
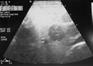
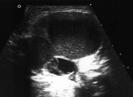
УЗИ При неясном клиническом диагнозе в качестве первичного метода визуализации следует использовать ультразвуковое исследование (УДД-3, УУР-C).[19, 20] При глубокой форме МГ (без поражения кожи) УЗИ позволит провести дифференциальную диагностику с лимфатической или венозной мальформацией. Типичными признаками МГ является гипоэхогенное объемное образование с четкими контурами и активным кровотоком смешанного характера по всей толще при ЦДК (рис. 19).
Рис. 19. а - Внешний вид ребенка с МГ в стадии медленного роста. б – В-режим УЗИ: гипоэхогеное, относительно однородное образование с четкими контурами. в – ЦДК: активная васкуляризация по всей толще образования.
В стадии инволюции опухолевая ткань становится гиперэхогенной. Повышенная васкуляризация сохраняется длительно и снижается медленно, ее отсутствие говорит о глубокой инволюции МГ (рис. 20).
Рис. 20. а - МГ кисти в стадии инволюции. б - УЗИ в В-режиме: гиперэхогенное образование. в – ЦДК: активная васкуляризация сохраняется.
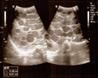
При пяти и более МГ кожных покровов необходимо проведение УЗИ органов брюшной полоти для исключения поражения печени или других внутренних органов (УДД-2, УУР-A) [20, 21]. Классические проявления гемангиом печени – это одиночный или множественные гипоэхогенные образования с четкими контурами (рис. 21). Мелкие гемангиомы выглядят более однородными, а крупные могут в центральной части содержать кальцинаты, кистозные включения и участки фиброза, что придает им гетерогенный характер. Допплерографически определяется активный кровоток смешанного характера по всей толще образования. Может встречаться значимая гипертрофия питающих сосудов и признаки артериовенозного или артериопортального шунтирования. В таких случаях необходимо проведение ЭхоКГ для исключения объемной перегрузки сердца.
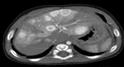
Рис. 21. а,б - Ребенок с множественными (>5) МГ кожных покровов. в – УЗИ печени: множественные гемангиомы печени. При неоднозначной УЗ картина показано выполнение МРТ или КТ. КТ При КТ необходимо выполнение как нативного, так и контрастусиленных исследования с получением артериальной, паренхиматозной, венозной и отсроченной фаз. КТ должна использоваться как можно реже в связи с высокой лучевой нагрузкой на пациента. Тем не менее КТ диагностика доступна и широко распространена, поэтому именно она, чаще МРТ. Показанием для КТ чаще всего являются объемные образования печени, а также для уточнения характера поражения при МГ сложной локализации.
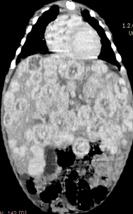
Типичной картиной гемангиомы печени является гиподенсивное объемное образование (одно или несколько) в нативную фазу, активно накапливающее рентгеноконтрастный препарат от периферии к центру при постконтрастных исследованиях и вымывание его при отсроченном исследовании (рис. 22). Гемангиома больших размеров может иметь в центральной части некотрастируемую область с оссификатами, как результат кровоизлияния, некроза или фиброза (рис. 23).
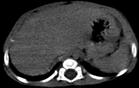
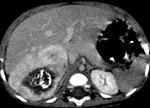
Рис. 22. КТ пациента с мультифакальной гемангиомой печени. а – нативное исследование: видны гиподенсивные округлые образования в паренхиме печени. б – артериальная фаза: умеренно расширенные печеночные артерии, контрастирование гемангиом от периферии к центру. в – венозная фаза: гемангиомы хорошо контрастируются. г – отсроченная фаза: контрастный препарат в гемангиомах не задерживается.
Рис. 23. Монофакальная гемангиома печени. КТ с к/у, венозная фаза. Центральный участок аваскулярный, вследствие кровоизлияния в опухоль с кальцинатами.
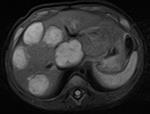
МРТ На сегодняшний день во многих странах МРТ является основным методом диагностики висцеральных гемангиом [18, 22]. Пока нельзя признать МРТ общедоступным методом диагностики. Тем не менее, МРТ будет более предпочтительным методом диагностики мягкотканых образований. Показанием к МРТ является подозрение на наличие ассоциированной структурной патологии (например синдромов PHACE или LUMBAR). (УДД-2, УУР-B) [20, 22]. При МРТ гемангиомы обычно гиперинтенсивны в стандартных T2-взвешенных последовательностях и гипоинтенсивны по сравнению с нормальной паренхимой печени на T1-взвешенных изображениях (рис. 24). Яркий сигнал на T1 в гемангиоме обычно представляет кровь, а центральная область слабого сигнала на T1- и T2-взвешенных последовательностях соответствует фиброзному рубцу. Динамические постконтрастные изображения показывают типичное периферическое распределение контрастного усиления на ранних фазах с последующим постепенным центростремительным заполнением. Если имеется центральный фиброз, гемангиомы могут не однородно заполняться контрастным веществом. При МРТ с Примовистом на отсроченной фазе, гемангиомы имеют тенденцию становиться гипоинтенсивными по сравнению с усилением сигнала от паренхимы печени.
Т1 Т2 T2 STIR Рис. 24. МРТ картина мультифокальной гемангиомы печени.
Тириотропный гормон (ТТГ).
Все инфантильные гемангиомы экспрессируют йодтиронин-дейодиназу 3-го типа, которая превращает гормон щитовидной железы в неактивную форму, что приводит к приобретенному (вторичному) гипотиреозу [23]. Все пациенты с диффузной гемангиомой печени страдают гипотиреозом в тяжелой формой. Гипотиреоз также возможен при мультифокальной форме гемангиомы печени, а также при гигантских МГ кожных покровов. При диффузной гемангиоме печени обязательно проведение анализа крови на тириотропный гормон (ТТГ) (УДД-4, УУР-А) [23]. Скрининг новорожденных на гипотиреоз не поможет в случае с МГ, т.к. опухоль приобретает большие размеры и, следовательно, активно инактивирует тириоидные гормоны через несколько недель или месяцев после рождения. При выявлении гипотиреоза необходима консультация эндокринолога и назначение заместительной терапии. Гипотиреоз уменьшается и пропадает при инволюции опухоли.
Биопсия. Проведение биопсии для подтверждения диагноза МГ – не целесообразно. В крайне редких случаях, когда подозревается патологический процесс, требующий специфического лечения (например злокачественные опухоли), проводится биопсия образования. Признаком МГ, отличающим их как от врожденных гемангиом, так и от других сосудистых аномалий, является положительная иммуногистохимическая реакция на GLUT1.
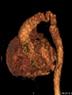
Врожденная гемангиома Как следует из названия, период роста врожденной гемангиомы происходит внутриутробно. Она достигает своего максимального размера к рождению ребенка. После этого регрессирует. По скорости регрессии их различают: RICH (Rapidly Involuting Congenital Hemangioma) – быстро инволютирующая врожденная гемангиома, PICH (partially involuting congenital hemangioma) – частично инволютирующая врожденная гемангиома, NICH (Non-Involuting Congenital Hemangioma) – не инволютирующая врожденная гемангиома (рис. 11). Главное их отличие от МГ в том, что ребенок рождается уже с крупной опухолью, которая после рождения не растет (рис. 25). Врожденная гемангиома не чувствительна к медикаментозной терапии. При необходимости биопсии следует учитывать, что гистологическая картина врожденных гемангиом аналогична таковой у МГ, за исключением иммуногистохимической реакции на GLUT1. При врожденной гемангиома она – отрицательная.
Рис. 25. Врожденная гемангиома бедра (RICH). а – сразу после рождения. б – через 3 месяца.
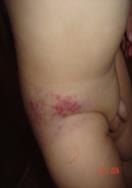
Тафт-ангиома Тафт-ангиома представляют собой доброкачественные сосудистые опухоли, которые встречаются у младенцев, детей или молодых. Ее клинические проявления неодинаковы и включают в себя эритематозные пятна, бляшки и узелки (рис. 27). Подобно КГЭ имеет предрасположенность к сочетанию с с-м Казабаха-Мерритта. Обе опухоли ведут себя непредсказуемо и могут медленно расти в течение месяцев или лет, быстро расти, спонтанно регрессировать или оставаться латентными в течение многих лет.
Рис. 27. Тафт-ангиома поясничной области.
Пиогенная гранулема Пиогенная гранулема - это реактивное пролиферирующее сосудистое образование. Пиогенные гранулемы чаще всего локализуются на голове и шее, быстро увеличиваются до среднего размера 5-6 мм, часто имеют узкое основание-ножку, осложняются эрозией, склонны к кровотечениям, которые трудно остановить (рис. 28).
Рис. 28. Пиогенная гранулема.
Лимфатическая мальформация. Различают микро- и макрокистозные лимфатические мальформации. Они различаются размера патологических лимфатических полостей. При подкожной локализации по внешнему виду и пальпаторно может не отличаться от МГ. В диагностике поможет УЗИ: определяются единичные или множественные гипоэхогенные (жидкостные) образования без кровотока (рис. 29).
Рис. 29. Макрокистозная многокамерная лимфатическая мальформация правого надплечья. а – внешний вид ребенка, б – УЗИ.
Рис. 30. Поверхностная микрокистозная лимфатическая мальформация нижней конечности. Лимфатическая мальформация кожи.
Венозная мальформация Как следует из названия являются результатом порока развития вен. С возрастом увеличиваются в размере за счет увеличения эктазии пораженных сосудов. При УЗИ определяются анэхогенные полости со слабым спонтанным кровотоком или с кровотоком при компрессии (рис. 32).
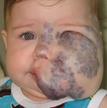
Рис. 32. Венозная дисплазия левой половины лица. Внешний вид ребенка.
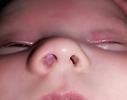
Капиллярная мальформация Капиллярная мальформация может менять интенсивность окраски в первые месяцы жизни, но не имеет тенденции к пролиферативному росту и изъязвлениям (рис. 33).
Рис. 33. Капиллярная мальформация лица. Внешний вид ребенка.
Нарушение важных функций Нарушение дыхания. МГ может располагаться со стороны слизистой носовой полости и облитерировать ее (рис. 34).
Рис. 34. МГ правой носового хода и его облитерация.
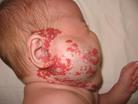
МГ передней поверхности шеи, подбородка, двухсторонние МГ подчелюстной локализации, могут приводить к сдавлению верхних дыхательных путей, стридору и дыхательной недостаточности (рис. 35).
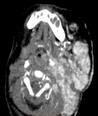
Рис. 35. а - Ребенок с обширной МГ околоушной и подчелюстной области с клиникой дыхательной недостаточности. б – КТ с к/у: обширная МГ сдавливает трахею. в – Тот-же пациент с трахеостомой, МГ в стадии остаточных явлений.
Возможно изолированное поражение МГ верхних дыхательных путей (рис. 36). В клинической картине, в таких случаях, доминирует нарастающее стридерозное дыхание.
Рис. 36. МГ подскладочного пространства.
Гипоксия является провоцирующим фактором для роста МГ и ее резистентности к медикаментозной терапии. При снижении сотурации показана кислородотерапия, а в тяжелых случаях - трахеостомия. Нарушение зрения. Параорбитально расположенная гемангиома может угрожать зрению и быть причиной амблиопии, астигматизма или косоглазия (рис. 37).
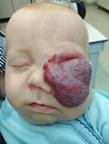
Рис. 37. МГ лица с полным перекрытием глазной щели слева. Пациент угрожаем по атрофии сетчатки и зрительного нерва слева.
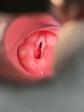
Нарушение слуха. Обтурация слухового прохода МГ приводит к рецидивирующим инфекциям и нарушению слуха (рис. 38).
Рис. 38. МГ лица с деформацией ушной раковины и обтурацией наружного слухового прохода.
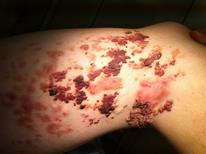
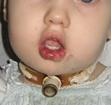
Изъязвления Изъязвление является наиболее распространенным осложнением и наблюдается примерно у 10% всех пациентов с МГ. Наиболее склонны к изъязвлению МГ области губ, шеи и промежности (рис. 39). Язвы могут вызывать обильные кровотечения и болевой с-м.
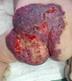
Рис. 39. МГ ягодичной области с обширным изъязвлением.
Кровотечения. Кровотечение возникает как осложнение язвы или в результате травмы. Сильное, опасные для жизни кровотечения встречаются крайне редко. Их причиной обычно является изъязвление крупного кровеносного сосуда. В таких случаях может понадобиться экстренное хирургическое лечение.
Косметические дефекты Деформации, вызванные МГ больших размеров, имеет особое значение при локализации на лице, в области носа, губ, лба, щек и ушей. МГ носа и губ регрессируют медленней и часто не полностью. МГ околоушной области часто большие и имеют тенденцию регрессировать медленнее, чем другие МГ. Грубые рубцовые изменения возникают после гемангиом, протекающих с изъязвлениями. (рис. 40).
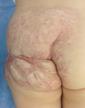
Рис. 40. Рубцовые деформации области ягодицы после перенесенной МГ с изъязвлением (тот-же ребенок, что и на рис)
VII. Лечение Показанием для лечения являются МГ высокого риска, т.е. МГ, которые могут быть связаны с: 1) жизнеугрожающими осложнениями например нарушение проходимости дыхательных путей, а также диффузную гемангиому печени связанную с сердечной недостаточностью и тяжелым гипотиреозом 2) функциональными нарушениями или изъязвлением, например нарушение зрения (потеря зрения, астигматизм, косоглазие), нарушение питания из-за поражения (изъязвления) губ или рта, боль и кровотечение в результате изъязвления МГ 3) структурными аномалиями, такими как синдромы PHACE или LUMBAR 4) необратимым косметическим дефектом, «обезображивание» возникают вследствие локализации МГ в критических областях: веко, кончик носа, ушная раковина, губа, грудь, промежность и т.д.). Любые изъязвления в конечном итоге оставят выраженные рубцовые измерения (УДД-5, УУР-A) [20, 24, 25, 26, 27, 28].
Большинство МГ не несут высоких рисков и не требуют лечения. Тем не менее, клиническая картина МГ может измениться в течение нескольких дней. Чтоб не упустить время и назначить лечение вовремя необходимо применять тактику «активного наблюдения». Ее принцип – повторные осмотры пациента проводить через столько недель, сколько пациенту месяцев. Например, если пациенту с МГ 1 месяц, следующий осмотр должен быть произведен через 1 неделю, если – 2 месяца, то – через 2 недели и так далее.
Интервал наблюдения в неделях = возраст в месяцах [ 29, 30 ]
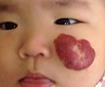
Повторимся: Надо быль крайне внимательным, если у пациента первых месяцев жизни есть маленькое образование красного цвета. Это может быть МГ, которая может вырасти до больших размеров за считанные недели (рис. 41).
Рис. 41. Быстрый рост МГ лица. а – 2 дня; б – 3 нед; в – 6 нед.
Только вовремя начатое лечение может предотвратить катастрофу!
Лучшее время для назначения терапии – начало стадии быстрого роста МГ! В клинических рекомендациях США 2019 года используется термин «окно возможностей» - период времени, в течение которого можно добиться оптимальных результатов в лечении МГ [20] Системная терапия Показания к медикаментозной терапии: · МГ вызывает или может вызвать нарушение важных функций (дыхание, зрение,…) · Изъязвленная МГ, или имеющая высокий риск изъязвления (например МГ губ и промежности) · МГ, способные вызвать стойкий или проходящие уродства (в первую очередь, имеются в виду МГ области лица, особенно области носа, губ, ушной раковины, область молочной железы у девочек) · Диффузная и множественные гемангиомы печени
B-адреноблокаторы В качестве первой линии системной терапии МГ рекомендуется пероральные b-адреноблокаторы (УДД-1, УУР-A).[20, 31, 32, 33, 34, 35] На сегодняшний день в России для лечения МГ используются неселективный b-адреноблокатор пропранолол и селективный b1-адреноблокатор атенолол. Пропранолол исторически начал использоваться для лечения МГ раньше атенолола и получил большее распространение. Однако, селективный b-адреноблокатор атенолол теоретически является более безопасным препаратом, т.к. в меньшей степени, чем пропранолол вызывает бронхоспазм, гипогликемию и нарушение сна. В самом крупном, на сегодняшний день, исследовании по сравнению эффективности и безопасности атенолола и пропранолола участвовало 80 пациентов. Авторы этого исследования утверждают, что атенолол по меньшей мере так же эффективен, как и пропранолол при лечении МГ. Меньший процент пациентов в группе атенолола испытывал побочные эффекты, чем в группе пропранолола, но это различие не было статистически значимым [36]. Создана, прошла длительный период апробации и зарегистрирована (в том числе и в России) лекарственная форма пропранолола специально созданная для лечения МГ: «Hemangiol». Во многих странах разработаны и приняты согласительные документы по лечению МГ пропранололом. Аналогичных документов по использованию атенолола пока не существует. Таким образом: 1. Пропранолол более распространен для лечения МГ. 2. Показания к назначению пропранолола и атенолола аналогичны. 3. Побочные эффекты также схожи, но бронхообструкция при приеме атенолола встречается несколько реже. 4. Среди пациентов из групп риска по гипогликемии и бронхоспазму целесообразней использовать селективный b1-адреноблокатор атенолол.
Мониторинг Пиковое действие перорального пропранолола на ЧСС и АД составляет от 1 до 3 часов после приема. Пациентам необходимо измерение ЧСС до и через 1 и 2 часа после приема первой дозы препарата и после увеличения дозы на 1 мг/кг/сут. Дозовый ответ обычно наиболее выражен после первой дозы; следовательно, нет необходимости повторять измерения несколько раз для одной и той же дозы.[34]
|
|||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-04-13; просмотров: 100; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.221.154.151 (0.165 с.) |