Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Система врожденной резистентности
К факторам врожденного иммунитета, или резистентности, относятся механические, физико-химические и биологические барьеры. Механические барьеры создаются кожей и слизистыми оболочками. Они механически защищают организм от проникновения в него бактерий, вирусов, макромолекул. Эту же роль выполняют слизь и реснитчатый эпителий верхних дыхательных путей, освобождающие слизистые оболочки от попавших на них инородных частичек. Целостные покровы здоровой кожи и слизистых оболочек непроницаемы для микроорганизмов и макромолекул. Однако при малозаметных микроповреждениях, воспалительных изменениях, укусах насекомых, ожогах и травмах микроорганизмы могут преодолевать этот барьер. Кроме того, некоторые микроорганизмы могут проникать в макроорганизм межклеточно и с помощью фагоцитов, переносящих их после поглощения через эпителий слизистых оболочек. Физико-химическим барьером, повреждающим попадающие в организм чужеродные агенты, являются ферменты, хлористоводородная (соляная) кислота желудочного сока, альдегиды и жирные кислоты потовых и сальных желез кожи. На чистой и неповрежденной коже обычно содержится мало микроорганизмов, так как потовые и сальные железы постоянно выделяют на поверхности кожи вещества, обладающие бактерицидным действием (уксусную, муравьиную, молочную кислоты). Желудок также является барьером для проникающих через полость рта бактерий, вирусов и других чужеродных агентов, так как они инактивируются и разрушаются под влиянием кислого желудочного содержимого (рН = 1,5-2,5) и ферментов. В кишечнике инактивирующими факторами являются ферменты пищеварительной системы (трипсин, панкреатин, липаза, амилаза и др.) и желчь, а также ферменты и бактриоцины, образуемые нормальной микрофлорой кишечника. Функцию биологического барьера осуществляют две группы факторов - гуморальной (растворимые) и клеточной природы (табл. 8.1). Таблица 8.1. Факторы биологического барьера
8.2.1. КЛЕТОЧНЫЕ ФАКТОРЫ БИОЛОГИЧЕСКОГО БАРЬЕРА
К группе клеточных факторов относят фагоциты (фагоцитоз), тромбоциты и нормальную микрофлору. Фагоциты и осуществляемый ими феномен фагоцитоза открыл и описал И. И. Мечников, который подразделил все фагоцитирующие клетки на макро- и микрофаги. В настоящее время все фагоциты объединены в единую мононуклеарную фагоцитирующую систему. К группе макрофагов относят тканевые макрофаги (альвеолярные, перитонеальные и др.), клетки Лангерганса (белые отростчатые эпидермоциты) и Гренштайна (эпидермоциты кожи), клетки Купфера (звездчатые ретикулоэндотелиоциты), к микрофагам - нейтрофилы и эозинофилы в крови и др. Фагоциты препятствуют адгезии чужеродных агентов на слизистой оболочке, удаляют и разрушают их путем фагоцитоза. Фагоцитоз (от греч. phagos - «пожираю» и cytos - «клетка») является одним из древнейших и основных факторов, обеспечивающих резистентность макроорганизма, защиту от чужеродных и инородных веществ, в том числе микроорганизмов. Процесс фагоцитоза имеет несколько стадий: — приближение фагоцита к объекту (хемотаксис); — адгезию объекта на поверхности фагоцита; — поглощение объекта; — переваривание объекта. Поглощение фагоцитируемого объекта (микроорганизма, АГ, макромолекул) осуществляется путем инвагинации клеточной мембраны с образованием в цитоплазме фагосомы, содержащей объект. Затем происходит слияние фагосомы с лизосомой клетки с образованием фаголизосомы, в которой объект переваривается с помощью ферментов. В том случае, если проходят все стадии и процесс заканчивается перевариванием объекта, фагоцитоз называется завершенным. В противном случае наблюдается незавершенный фагоцитоз. При этом поглощенные микроорганизмы не погибают, а иногда даже размножаются в фагоцитах. Активность фагоцитов характеризуется фагоцитарным показателем и опсонофагоцитарным индексом. Фагоцитарные показатели оцениваются по количеству бактерий, поглощенных или переваренных одним фагоцитом в единицу времени. Опсонофагоцитарный индекс представляет собой отношение фагоцитарных показателей, полученных с сывороткой, содержащей опсонины, к сыворотке без них. Эти показатели используют в клинической практике для определения иммунного статуса организма человека.
Тромбоциты играют важную роль в иммунитете, выделяя биологически активные вещества (гистамин, лизоцим, лизины, лейкины, простагландины и др.), которые участвуют в процессах разрушения чужеродных агентов и воспаления. Гранулема, т.е. клеточный вал вокруг чужеродного агента, также является древним механизмом торможения его воздействия и функционирования путем экранирования от окружающих тканей. Гранулема возникает при невозможности устранения из организма чужеродного агента и запуска иммунного ответа. Пример - водонерастворимый объект, возбудитель туберкулеза. Нормальная микрофлора - естественные обитатели биотопов тела макроорганизма, которые путем синтеза бактериоцинов осуществляют колонизационную резистентность: предотвращают заселение и сдерживают размножение гнилостной и гноеродной микрофлоры. 8.2.2. ГУМОРАЛЬНЫЕ ФАКТОРЫ БИОЛОГИЧЕСКОГО БАРЬЕРА Группа гуморальных факторов представлена опсонинами, ингибиторами ферментных систем и литическими факторами. Опсонины - белки в плазме крови, способные неспецифически сорбироваться на чужеродных агентах, экранировать их адгезины, рецепторы и препятствовать их адгезии и инвазии в макроорганизме. К опсонинам относят фибронектин, пропердин, маннозосвязывающий белок, белки острой фазы и др. Фибронектин - универсальный белок в плазме крови и тканевых жидкостях, синтезируется макрофагами и обеспечивает опсонизацию АГ и связывание клеток с чужеродными веществами.
Пропердин - γ-глобулин в нормальной сыворотке крови, способствующий активации комплемента и, таким образом, участвующий во многих иммунологических реакциях. Маннозосвязывающий белок (МСБ) - нормальный протеин в плазме крови, способный прочно связываться с остатками маннозы на поверхности клеточной стенки некоторых бактерий и активировать комплемент по лектиновому пути. К белкам острой фазы относятся С-реактивный белок (СРБ), противовоспалительные и другие белки, которые вырабатываются в печени в ответ на повреждение тканей и клеток. СРБ способствует опсонизации бактерий и является индикатором воспаления. Ингибиторы ферментных систем способны блокировать биосинтетические процессы в клеточных системах и останавливать их рост и размножение. К данным факторам относят трансферрин, лактоферрин, интерфероны. Трансферрин - белок в плазме крови, синтезируемый в печени, имеет высокое сродство к ионам железа. Трансферрин присутствует в слизистых оболочках, где связывает эти ионы, конкурируя с бактериями, и тем самым снижает эффективность их метаболизма и возможность размножения. Лактоферрин обнаруживают в молоке, сходен по биологической активности с трансферрином. Интерферон - белок, синтезируемый клетками иммунной системы и соединительной ткани. В зависимости от того, какими клетками синтезируется интерферон, различают три его вида: α-интерферон - вырабатывается лейкоцитами, β-интерферон - клетками соединительной ткани, фибробластами, γ-интерферон (иммунный) - Т-лимфоцитами. Интерфероны синтезируются клетками постоянно. Их продукция резко возрастает при инфицировании организма вирусами, а также при воздействии индукторов интерферона (интерфероногенов). Интерфероны-α и и -β участвуют в противовирусной защите - блокируют белковый синтез в зараженных вирусом клетках, γ-интерферон является регулятором активности клеток иммунной системы.
Интерферон, полученный генно-инженерным способом, называется рекомбинантным. Его широко применяют как профилактическое и лечебное средство при вирусных инфекциях, новообразованиях и иммунодефицитах. Литические факторы, обеспечивающие разрушение чужеродных агентов, включают лизоцим, комплемент, β-лизины и др. Лизоцим - гидролитический фермент, синтезируемый фагоцитирующими клетками. Он постоянно содержится практически во всех жидкостях и тканях организма: в крови, лимфе, слезах, молоке, сперме, на слизистых оболочках урогенитальной системы, дыхательных путей и ЖКТ, но отсутствует в спинномозговой жидкости и передней камере глаза. Лизоцим разрушает клеточную стенку грамположительных бактерий, что приводит к их осмотическому лизису и способствует фагоцитозу. Система комплемента - сложный комплекс белков в сыворотке крови, активация которого способна вызвать разрушение целой клетки. В состав комплемента входят 20 взаимодействующих между собой белков, 9 из которых являются основными компонентами, их обозначают С1, С2, С3... С9. Функции комплемента многообразны, он является составной частью многих иммунологических реакций, направленных на освобождение организма от микроорганизмов и других чужеродных клеток и АГ. Механизм активации комплемента очень сложен и представляет собой каскад ферментативных протеолитических реакций. В результате образуется активный цитотоксический комплекс, нарушающий целостность ЦПМ эукариотической клетки или клеточной стенки бактерий и вызывающий их осмотический лизис. Существуют три пути активации комплемента: классический, альтернативный и лектиновый. По классическому пути комплемент активируется комплексом «антиген-антитело», а по альтернативному и лектиновому - без участия АТ, агрегатами с некоторыми белками в сыворотке крови. Активация комплемента осуществляется в присутствии Са 2+ и Mg 2+. β-Лизины - белки в сыворотке крови, которые синтезируются тромбоцитами и повреждают ЦПМ бактерий. Факторы врожденной резистентности участвуют в защите организма от любых АГ независимо от их природы и характера. Они не имеют специфической направленности действия применительно к конкретному АГ, поэтому их называют факторами неспецифической резистентности.
Между факторами врожденного и приобретенного иммунитета существуют тесная связь и взаимодействие. Так, чужеродные агенты, прежде чем проникнуть в организм, должны преодолеть механические и физико-химические барьеры. Если эти барьеры преодолены, на пути АГ возникает третий мощный барьер в виде клеточной реакции и многочисленных гуморальных факторов. В случае неспособности факторов врожденного иммунитета устранить из организма чужеродный агент в течение 4 ч подключается система приобретенного иммунитета. Однако врожденный иммунитет будет продолжать действовать не только до полного устранения угрозы (нейтрализации и обезвреживания) со стороны интервента, но и до восстановления структурной и функциональной целостности организма (репарации дефектов). 8.3. ИММУННАЯ СИСТЕМА ЧЕЛОВЕКА Реализацию приобретенного иммунитета осуществляет иммунная система. Принцип ее действия основан на распознавании «свой-чужой». Иммунная система включает специализированную, анатомически обособленную лимфоидную ткань, разбросанную по всему организму в виде различных лимфоидных образований и отдельных клеток. Суммарная масса этой ткани составляет 1-2% массы тела. Анатомически иммунная система подразделена на центральные и периферические органы. К центральным органам относятся костный мозг и тимус (вилочковая железа), а к периферическим - лимфатические узлы, скопления лимфоидной ткани (пейеровы бляшки, аппендикс, миндалины), а также селезенка, кровь и лимфа. Схематическое строение иммунной системы изображено на рис. 8.1. Основные функциональные клетки лимфоидной системы - лимфоциты, кроме них - мононуклеарные и гранулярные лейкоциты, а также тучные клетки. Часть клеток сосредоточена в отдельных органах иммунной системы, другие клетки свободно перемещаются с током крови и лимфы по всему организму. Функциональное деление иммунной системы подразумевает выделение зон контроля входных ворот чужеродных агентов (кожи, слизистых оболочек), контроля внутренней среды организма и генеративной зоны. Центральные органы иммунной системы - костный мозг и вилочковая железа, или тимус. Это органы воспроизведения клеток иммунной системы - рождения, размножения, дифференцировки и «обучения» клеток иммунной системы. У птиц к центральным органам иммунной системы относят сумку Фабрициуса (bursa Fabricii), локализованную в области клоаки. Костный мозг содержит полипотентные стволовые клетки, являющиеся родоначальницами всех форменных элементов крови и, соответственно, клеток иммунной системы. В костном мозге происходят дифференцировка и размножение популяции В-лимфоцитов (от англ. bone morrow - «костный мозг»), которые затем разносятся по всему организму кровотоком. Здесь же образуются предшественники лимфоцитов, мигрирующих впоследствии в тимус и образующих популяцию Т-лимфоцитов (от англ. thymus - «тимус»). Фагоциты и их предшественники также образуются в костном мозге.
Вилочковая железа (тимус, или зобная железа) расположена в верхней части загрудинного пространства. В тимусе находится большое количество эпителиальных клеток - тимоцитов («клеток-нянек»), участвующих в «обучении» Т-лимфоцитов. Предшественники Т-лимфоцитов, образовавшиеся в костном мозге, поступают в тимус, проходят «обучение», активно размножаются и превращаются в зрелые Т-лимфоциты, способные распознавать чужеродные агенты. Зрелые формы Т-лимфоцитов мигрируют с кровотоком из тимуса в другие органы и ткани, заполняя присущие им зоны. Процесс обучения складывается из селекции клеток, способных к размножению и не способных распознавать «свое как чужое». Клетки, не прошедшие профессиональный отбор, подлежат уничтожению.
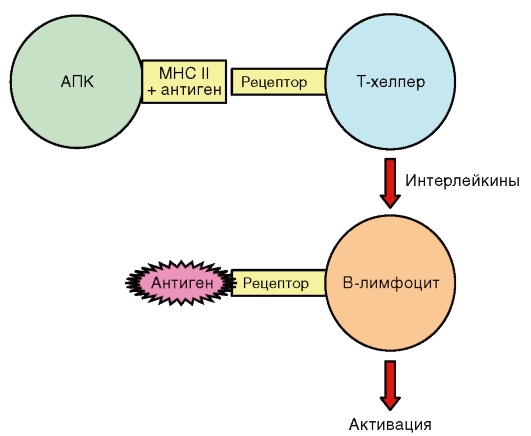
Рис. 8.1. Иммунная система человека Периферические органы иммунной системы - селезенка, аппендикс, миндалины глоточного кольца, групповые лимфатические фолликулы (пейеровы бляшки), лимфатические узлы, кровь, лимфа. В этих органах локализуются клетки иммунной системы, которые непосредственно осуществляют иммунный надзор. Они обеспечивают местный иммунитет слизистой оболочки кишки и ее просвета, носоглотки, ротовой полости, верхних дыхательных путей и мочеполовой системы. Здесь происходят стимуляция клеток иммунной системы, развитие специфической иммунной реакции и обезвреживание чужеродного агента. Лимфатические узлы выполняют функцию биологического сита: через них фильтруется лимфа, задерживаются и концентрируются чужеродные агенты. Селезенка - орган, через который фильтруется кровь. В селезенке задерживаются «состарившиеся» эритроциты («кладбище эритроцитов»). 8.3.1. ИММУНОКОМПЕТЕНТНЫЕ КЛЕТКИ Основные клетки иммунной системы - лимфоциты, макрофаги и дендритные клетки. По функциональной активности иммунокомпетентные клетки подразделяют на регуляторные и эффекторные. Регуляторные клетки управляют функцией иммунной системы путем выработки медиаторов - иммуноцитокинов. Эффекторные клетки являются исполнителями иммунного реагирования и действуют на объект непосредственно либо путем биосинтеза биологически активных веществ (АТ). Лимфоциты - подвижные мононуклеарные клетки, которые в зависимости от места созревания в организме подразделяются на Т- и В-лимфоциты. Лимфоциты непосредственно распознают генетически чужеродные молекулы и участвуют в регуляции иммунного ответа, формировании гуморального и клеточного иммунитета, иммунологической толерантности и памяти, а также в реакциях гиперчувствительности. Лимфоциты постоянно рециркулируют между различными органами и тканями. В-лимфоциты - эффекторные иммунокомпетентные клетки, ответственные за синтез Ig, участвующие в формировании гуморального иммунитета, иммунологической памяти, гиперчувствительности немедленного типа (ГНТ). Активностью В-лимфоцитов управляют молекулярные АГ и клетки-регуляторы: Т-хелперы и фагоциты. Популяция Т-лимфоцитов включает субпопуляции клеток-регуляторов (Т-хелперы) и клеток-эффекторов (Т-киллеры), различающихся по рецепторному аппарату и специфическим продуктам биосинтеза. Т-лимфоциты обеспечивают клеточные формы иммунного ответа (гиперчувствительность замедленного типа - ГЗТ, трансплантационный, противовирусный, противоопухолевый иммунитет), определяют силу и продолжительность иммунной реакции. Т-хелперы (помощники) - субпопуляция Т-лимфоцитов-регуляторов, выполняющих регуляторную функцию. Основным продуктом биосинтеза Т-хелперов являются иммуноцитокины (интерлейкин, γ-интерферон и др.), с помощью которых они воздействуют на клоны Т- и В-лимфоцитов, включая созревание, пролиферацию и дифференцировку эффекторных клеток. Т-киллеры - субпопуляция Т-лимфоцитов-эффекторов, на долю которых приходится примерно 25% всей популяции Т-лимфоцитов. Т-киллер распознает клетки с измененной структурой, поэтому его мишенью являются мутировавшие, а также пораженные вирусом клетки или трансплантаты. Т-киллеры синтезируют ферменты-токсины - перфорин, гранзимы и гранулизин, разрушающие генетически чужеродные клетки. Макрофаги - самая многочисленная фракция иммунокомпетентных клеток, гетерогенная по морфологическим свойствам. Они обладают регуляторной и эффекторной активностью, вырабатывают иммуноцитокины, ферменты и другие биологически активные вещества и обеспечивают вне- и внутриклеточное разрушение (киллинг) чужеродного агента, фагоцитоз, переработку и представление его фрагментов Т-хелперам. Имеются также NK-клетки (естественные киллеры), в определенной мере обеспечивающие противоопухолевый иммунитет, защиту от внутриклеточных паразитов, а также предохраняющие от атаки иммунными факторами отдельные ткани организма, включая эмбрион. Антигенпрезентирующие клетки (АПК) захватывают, перерабатывают (переваривают) и представляют фрагменты чужеродного агента Т-хелперам для распознавания «свой-чужой». Основными АПК являются дендритные клетки, В-лимфоциты и макрофаги. Дендритные клетки - клетки костномозгового происхождения, выполняющие функцию АПК. 8.3.2. МЕЖКЛЕТОЧНАЯ КООПЕРАЦИЯ В иммунной защите организма участвуют три вида клеток: макрофаги, Т- и В-лимфоциты. Деятельность этих клеток направлена на распознавание и уничтожение генетически чужеродных веществ и объектов, регуляцию функционирования компонентов иммунной системы и поддержание гомеостаза. Такая работа осуществляется в постоянном взаимодействии всех типов иммунокомпетентных клеток, т.е. в условиях межклеточной кооперации. Связующим звеном между клетками иммунной сиистемы служат рецепторы, иммуноцитокины и другие медиаторы. Схему межклеточной кооперации можно упрощенно проиллюстрировать на примере активации В-лимфоцитов (рис. 8.2).
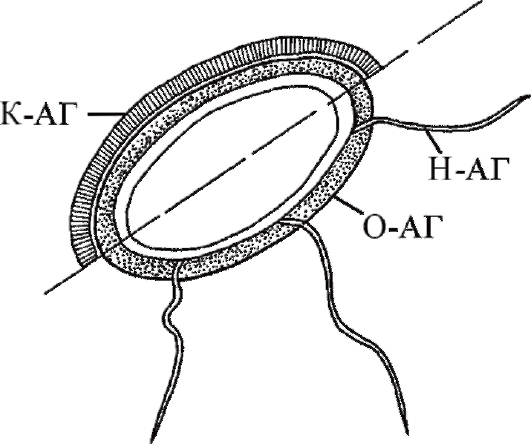
Рис. 8.2. Схема межклеточной кооперации «MHC II-антиген главного комплекса гистосовместимости II класса» (пояснения см. в тексте) При появлении в организме чужеродного агента он захватывается АПК и переваривается, его фрагмент предоставляется Т-хелперу для определения «свой-чужой». В случае распознавания чужеродности АПК и Т-хелпер начинают вырабатывать иммуноцитокины, запускающие в В-лимфоцитах пролиферативные и дифференцировочные процессы, в результате чего формируется клон В-лимфоцитов, синтезирующих АТ, высокоспецифичные к данному агенту. 8.3.3. АНТИГЕНЫ Точкой приложения иммунной системы являются чужеродные агенты, или антигены, - полимеры биоорганической природы, генетически чужеродные для макроорганизма, вызывающие в нем иммунные реакции, направленные на их устранение. АГ имеют самое разнообразное происхождение. Ими являются бактерии, грибы, простейшие, вирусы, клетки животных и растений, продукты их жизнедеятельности. Они могут образовываться в процессе природного биологического синтеза, а также появляться в собственном организме при структурных изменениях уже синтезированных нормальных молекул или при генетической мутации. АГ могут быть получены искусственно направленным химическим синтезом. Однако в любом случае молекула АГ будет отличаться генетической чужеродностью по отношению к макроорганизму, в котором она находится. АГ попадают в макроорганизм различными путями: через кожные покровы или слизистые оболочки, непосредственно во внутреннюю среду, минуя покровы, или образовываться внутри организма. АГ распознаются иммунокомпетентными клетками и вызывают разнообразные иммунологические реакции, направленные на их инактивацию, разрушение и удаление. Свойства антигенов Характерными свойствами АГ являются антигенность, специфичность и иммуногенность. Антигенность - потенциальная способность молекулы АГ взаимодействовать с факторами иммунитета (АТ, эффекторными лимфоцитами). Специфичность - способность АГ избирательно реагировать со строго определенными АТ или клонами лимфоцитов. При этом взаимодействие происходит не со всей молекулой АГ, а только с ее небольшим участком, который получил название «антигенная детерминанта», или «эпитоп». Иммуногенность - способность АГ вызывать иммунную защиту макроорганизма. Степень иммуногенности зависит от самого АГ (чужеродности, природы, химического состава, молекулярной массы, структуры, растворимости), реактивности макроорганизма и условий среды обитания. Чужеродность - обязательное условие реализации иммуногенных свойств. Чем дальше в филогенетическом развитии организмы отстоят друг от друга, тем большей иммуногенностью обладают их АГ по отношению друг к другу. Иммуногенность в значительной степени зависит от природы АГ. Известно, что наиболее выраженными иммуногенными свойствами обладают белки. Чистые полисахариды, нуклеиновые кислоты и липиды, напротив, менее иммуногенны. В то же время ЛПС, гликопротеины, липопротеины способны в достаточной мере активировать иммунную систему. Большое значение имеет относительная молекулярная масса АГ. Так, небольшие полипептидные молекулы с массой менее 5000 D (дальтон), как правило, не иммуногенны. В то же время полисахарид с молекулярной массой 600000 D достаточно хорошо индуцирует в организме человека иммунную реакцию. На иммуногенность также влияет структура АГ. При равной молекулярной массе (около 70000 D) альбумин является более сильным антигеном, чем гемоглобин. Белок коллаген (молекулярная масса - 330000 D) обладает значительно меньшей иммуногенностью по сравнению с альбумином, масса которого почти в 5 раз меньше. Важным условием иммуногенности является растворимость АГ. Например, такие высокомолекулярные белки, как кератин и меланин, не могут быть получены в виде коллоидного раствора и не являются АГ. На иммунный ответ влияют динамика поступления АГ в организм, способ его введения и количество. Иммуногенность зависит также от состояния макроорганизма. Хорошо известно, что результат иммунизации в определенной мере связан с генотипом особи и его функциональным состоянием. Различают полноценные и неполноценные АГ. Полноценные АГ обладают выраженной антигенностью и иммуногенностью. Такие вещества имеют достаточно большую молекулярную массу (более 10000 D) и большой размер молекулы (частицы) в виде глобулы. Неполноценные АГ (гаптены), напротив, не способны при введении в организм индуцировать иммунный ответ, так как обладают крайне низкой иммуногенностью. Однако свойство антигенности они не утратили, что позволяет им специфически взаимодействовать с АТ и лимфоцитами. Чаще всего гаптенами являются низкомолекулярные соединения (с молекулярной массой ниже 1000 D). При укрупнении гаптена - соединении его прочной связью с какой-либо белковой молекулой - он приобретает свойство полноценного АГ. Иммуногенностью можно управлять, воздействуя на перечисленные факторы. Существует группа веществ, называемых адъювантами (см. раздел 8.8), которые способны усиливать это свойство АГ. Антигены организма человека Изучение антигенных свойств тканей человека было начато после открытия К. Ландштейнером в 1901 г.групповых антигенов эритроцитов (системы АВ0). На сегодняшний день их известно более 250. Наиболее важное клиническое значение имеют АГ системы АВ0 и Rh (резус-фактора) при переливаниях крови (гемотрансфузии), пересадке органов и тканей, для предупреждения и лечения осложнений беременности. АГ системы АВ0 определяют наличие в человеческой популяции четырех групп крови: 0 (I), A (II), B (III) и AB (IV). Переливание пациенту крови, несовместимой по группе, как правило, приводит к острому состоянию - гемолитическому шоку. По резус-фактору в популяции людей различают две группы: резус-положительные и резус-отрицательные. Совпадение по резусфактору важно не только при переливании крови, но также для течения и исхода беременности. У резус-отрицательной матери на резусположительный плод вырабатываются антирезусные АТ, которые могут привести к прерыванию беременности или к развитию желтухи новорожденного (внутрисосудистому иммунному лизису эритроцитов), особенно при повторной беременности. Помимо указанных АГ, на цитоплазматических мембранах клеток организма находятся антигены гистосовместимости - HLA (Human Leukocyte Antigene - антигены лейкоцитов человека). Они играют важную роль в развитии иммунного ответа, отторжении трансплантатов и других реакциях. HLA обнаруживают на ЦПМ практически всех клеток макроорганизма. Из них наиболее изучены HLA I и II класса. HLA имеют сложную, строго индивидуальную структуру. Каждый человек строго уникален по набору HLA, исключение составляют только однояйцевые близнецы. — Антигены гистосовместимости I класса обнаруживают на поверхности практически всех клеток, кроме эритроцитов и клеток ворсинчатого трофобласта (профилактика отторжения плода). В настоящее время у человека различают более 200 их различных типов, образующих бесконечное множество вариантов. HLA являются маркерами «своего» для иммунокомпетентных клеток, т.е. «биологическим паспортом» макроорганизма. Зараженные вирусом или мутировавшие клетки изменяют структуру HLA I класса. Т-киллер распознает отклонение от нормы и уничтожает такую клетку. — Антигены гистосовместимости II класса участвуют в индукции приобретенного иммунного ответа. Они присутствуют на ЦПМ АПК и предоставляют Т-хелперам фрагмент АГ для распознавания чужеродности. На ЦПМ иммунокомпетентных клеток обнаруживают CD-антигены (Cell Differentiation antigens) - антигены клеточной дифференцировки, которые используются для распознавания клеточных популяций. Например, CD3 экспрессируется в популяции Т-лимфоцитов, CD4 - в популяции Т-хелперов, CD8 - в популяции цитотоксических Т-лимфоцитов (Т-киллеров), CD11a - в популяции моно- и гранулоцитов, CD11b - в популяции естественных киллеров, CD19-22 - в популяции В-лимфоцитов. CD-антигены имеют значение в диагностике иммунодефицитных состояний. Определение CD-маркеров осуществляется в серологических реакциях с использованием моноклональных АТ. Аутогенные антигены (аутоантигены) - АГ собственного организма. В нормальных условиях они не вызывают реакции иммунной системы вследствие либо иммунологической толерантности (невосприимчивости), либо недоступности для контакта с факторами иммунитета - это так называемые забарьерные АГ. При срыве толерантности или нарушении целостности биологических барьеров (наиболее частая причина - травма) компоненты иммунной системы начинают специфически реагировать на аутоантигены выработкой специфических факторов иммунитета (аутоантител, клонов аутореактивных лимфоцитов). Антигены микроорганизмов В структуре бактериальной клетки определяются несколько типов АГ, которые специфичны для семейств, родов и видов. Внутри видов могут быть выделены серогруппы и серологические варианты (серовары). В структуре бактериальной клетки различают жгутиковые (Н), соматические (О), капсульные (К) и некоторые другие АГ (рис. 8.3). — Жгутиковый (Н) АГ локализован в локомоторном аппарате бактерий - жгутиках. Он состоит из белка флагеллина, который термолабилен (при нагревании быстро разрушается и теряет свою специфичность). — Соматический (О) АГ связан с клеточной стенкой бактерий. Его основу составляют ЛПС, что придает ему термостабильность, и он не разрушается при кипячении. — Капсульные (К) АГ расположены на поверхности клеточной стенки, встречаются у бактерий, образующих капсулу. Некоторые из них термостабильны, другие термолабильны. Вариантом капсульного АГ является Vi-антиген. Его можно обнаружить на поверхностях возбудителя брюшного тифа и некоторых других энтеробактерий, которые обладают высокой вирулентностью, в результате чего он получил название антигена вирулентности. Антигенными свойствами обладают также бактериальные белковые токсины, ферменты и некоторые другие белки, секретирующиеся бактериями в окружающую среду. В антигенном составе некоторых бактерий выделяется группа АГ с сильно выраженной иммуногенностью, названных протективными. В структуре вирусной частицы различают несколько групп АГ: ядерные (коровые) (от англ. core - «ядро, стержень»), капсидные (оболочечные) и суперкапсидные. На поверхности некоторых вирусных частиц встречаются особые V-антигены - гемагглютинин и NA. Антигенный состав вириона зависит от его строения. Антигенная специфичность простоорганизованных вирусов связана с нуклеопротеидами. Эти вещества хорошо растворяются в воде и поэтому обозначаются как S-антигены (от лат. solutio - «раствор»). У сложноорганизованных вирусов часть АГ связана с нуклеокапсидом, а другая локализуется во внешней оболочке - суперкапсиде.
Рис. 8.3. Антигены бактерий (пояснения см. в тексте) АГ многих вирусов отличаются высокой степенью изменчивости, что связано с мутациями, часто происходящими в их генетическом аппарате. Примерами могут служить вирус гриппа, ВИЧ и др. 8.4. ОСНОВНЫЕ ФОРМЫ ИММУННОГО РЕАГИРОВАНИЯ Основными формами иммунного реагирования являются антителообразование, иммунный фагоцитоз, опосредованный клетками киллинг (уничтожение), реакции гиперчувствительности, иммунологическая память и иммунологическая толерантность. Все элементы иммунной системы имеют единый принцип активации и практически одновременно реагируют на изменение гомеостаза. Однако в зависимости от характера антигенного воздействия наблюдается неравномерное стимулирование: одна или несколько форм становятся ведущими, в то время как другие могут практически не проявляться. Например, при токсинемической инфекции преимущественно активируется продукция АТ, так как организму необходимы иммуноглобулины-антитоксины, которые способны нейтрализовать токсины. При туберкулезной инфекции, наоборот, основную функциональную нагрузку несут факторы клеточного иммунитета (макрофаги, Т-лимфоциты). Антитела, их природа и функция Одной из основных форм иммунного ответа на внедрение в организм антигена является синтез АТ. Антитела - это белки γ-глобулиновой фракции в плазме крови, способные специфически связываться с АГ. Исходя из своей структуры, АТ получили название «иммуноглобулины», их обозначают символом Ig. Они синтезируются В-лимфоцитами и их потомками - плазматическими клетками. Молекулярное строение антител Молекулы Ig различных классов, несмотря на их видимое разнообразие, имеют универсальное строение и состоят из двух пар полипептидных цепей: двух тяжелых (Н) и двух легких (L). Тяжелые и легкие цепи соединены между собой попарно дисульфидными (-S-S-) связями (рис. 8.4).
Рис. 8.4. Схема строения молекулы иммуноглобулина класса G: V - вариабельный домен; С - константный домен; S - дисульфидная связь шарнирного участка Вторичная структура полипептидных цепей молекул Ig имеет доменное строение: ее отдельные участки цепи свернуты в глобулы (домены). Таких доменов в составе тяжелой цепи бывает четырепять, а в легкой - два. Каждый домен состоит примерно из 110 аминокислотных остатков. Домены различаются по постоянству аминокислотного состава. Выделяют С-домены (от англ. mutant -«постоянный») с относительно постоянной структурой полипептидной цепи и V-домены (от англ. vаriablе -«изменчивый») - с переменной структурой. В составе легкой цепи есть по одному V- и С-домену, а в тяжелой - один V-домен и три-четыре С-домена. Вариабельные домены легкой и тяжелой цепей совместно образуют участок, который специфически связывается с АГ, - антигенсвязывающий центр (Fab-фрагмент). В каждой молекуле АТ также имеется Fc-фрагмент, ответственный за взаимодействие с комплементом и его активацию, за связывание с рецепторами на мембране клеток макроорганизма и некоторых микроорганизмов. Механизм взаимодействия антитела с антигеном Взаимодействие молекулы Ig с АГ происходит за счет ограниченного участка - антигенсвязывающего центра, взаимодействующего не со всей молекулой АГ, а лишь с ее антигенной детерминантой. Эффективность взаимодействия АТ с АГ зависит от условий, в которых происходит реакция: рН, осмотической плотности, солевого состава и температуры среды. Структурно-функциональные особенности иммуноглобулинов различных классов В зависимости от строения тяжелой цепи различают пять классов, или изотипов Ig: G, М, А, Е, D (рис. 8.5).
Рис. 8.5. Схема строения иммуноглобулинов различных классов (пояснения см. в тексте) Иммуноглобулины класса G (IgG) составляют основную массу Ig в сыворотке крови - на их долю приходится 70-80% всех сывороточных Ig. IgG - мономер, имеет два антигенсвязывающих центра (может связать две молекулы АГ), активирует комплемент, легко проходит через плацентарный барьер и обеспечивает гуморальный иммунитет новорожденного в первые 3-4 мес после рождения. Иммуноглобулины класса М (IgМ) - наиболее крупные молекулы из всех Ig, пентамер имеет 10 антигенсвязывающих центров и дополнительную J-цепь, соединяющую субъединицы. На их долю приходится около 5-10% всех сывороточных Ig. является филогенетически наиболее древним, синтезируется предшественниками и зрелыми В-лимфоцитами, образуется в начале первичного иммунного ответа, являясь показателем острой инфекции первым начинает синтезироваться в организме новорожденного (определяется уже на 20-й неделе внутриутробного развития), не проходит через плаценту, активирует комплемент. Обнаружение специфических АТ изотипа М в сыворотке крови новорожденного указывает на бывшую внутриутробную инфекцию или дефект плаценты. Иммуноглобулины класса А (IgА) существуют в сывороточной и секреторной формах. На долю сывороточного IgА приходится около 10-15% всех сывороточных Ig. Около 60% всех IgА содержится в секретах слизистых оболочек, они активируют комплемент. Секреторный IgА - основной фактор местного иммунитета слизистых оболочек ЖКТ, мочеполовой системы и дыхательных путей. Обладает дополнительным секреторным пептидом (S-цепь). Переносится в просвет органа эпителиальными клетками. Препятствует адгезии микроорганизмов на эпителиальных клетках слизистых оболочек.
|
|||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-04-05; просмотров: 191; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.19.29.89 (0.065 с.) |