
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кислородные соединения хлора ⇐ ПредыдущаяСтр 8 из 8
Хлор образует четыре кислородсодержащие кислоты: хлорноватистую, хлористую, хлорноватую и хлорную. Хлорноватистая кислота HClO образуется при взаимодействии хлора с водой, а также ее солей с сильными минеральными кислотами. Она относится к слабым кислотам, очень неустойчива. Состав продуктов, реакции ее разложения зависит от условий. При сильном освещении хлорноватистой кислоты, наличии в растворе восстановителя, а также длительном стоянии она разлагается с выделением атомарного кислорода: HClO = HCl + О. В присутствии водоотнимающих веществ образуется оксид хлора(I): 2 HClO = Н2О + Сl2O. Cl2O можно считать ангидридом хлорноватистой кислоты. При нагревании хлорноватистая кислота разлагается с образованием двух кислот — соляной и хлорноватой: 3 HClO = 2 HCl + HClO3. Поэтому при взаимодействии хлора с горячим раствором щелочи образуются соли не соляной и хлорноватистой, а соляной и хлорноватой 6 NaOH + 3 Сl2 = 5 NaCl + NaClO3 + 3 H2O. Соли хлорноватистой кислоты — гипохлориты — очень сильные окислители. Они образуются при взаимодействии хлора со щелочами на холоду. Одновременно образуются соли соляной кислоты. Из таких смесей наибольшее распространение получили хлорная известь и жавелевая вода. Хлорная, или белильная, известь CaOCl2 или CaCl(ClO), образуется при взаимодействии хлора с порошкообразным гидроксидом кальция — пушенной: Ca(ОН)2 + Cl2 = СаСlOCl + H2O или 2 Ca(ОН)2 + 2 Cl2 = CaCl2 + Ca(OCl)2 + 2 Н2О. Качество хлорной извести определяется содержанием в ней гипохлорита. Она обладает очень сильными окислительными свойствами и может окислять даже соли марганца до перманганата: 5 СаОСl2 + 2 Mn(NО3)2 + 3 Ca(ОН)2 = Ca(МnO4)2 + 5 CaCl2 + 2 Ca(NО3)2 + 3 Н2О. Под действием углекислого газа, содержащегося в воздухе, она разлагается с выделением гемиоксида хлора: 2 СаОСl2 + СО2 = СаСО3 + Cl2O + CaCl2 или Ca(OCl)2 + CO2 = СаСО3¯ + Cl2O. Хлорная известь применяется как отбеливающее и дезинфицирующее вещество. Хлористая кислота НСlO2 образуется при действии концентрированной серной кислоты на хлориты щелочных металлов, которые получаются как промежуточные продукты при электролизе растворов хлорид в щелочных металлов в отсутствие диафрагмы между катодным и анодным пространствами. Это слабая, неустойчивая кислота, очень сильный окислитель в кислой среде. При взаимодействии ее с соляной кислотой выделяется хлор:
НСlO2 + 3 HCl = 2 Cl2 + 2 H2O. Хлориты натрия используются для получения диоксида хлора, при обеззараживании воды, а также как отбеливающий агент. Хлорноватая кислота HСlO3 образуется при действии на ее соли — хлораты — серной кислоты. Это очень неустойчивая кислота, очень сильный окислитель может существовать только в разбавленных растворах. При упаривании раствора НСlO3 при низкой температуре в вакууме можно получить вязкий раствор, содержащий около 40% хлорной кислоты. При более высоком содержании кислоты раствор разлагается со взрывом. Разложение со взрывом происходит и при меньшей концентрации в присутствии восстановителей. В разбавленных растворах хлорноватая кислота проявляет окислительные свойства, причем реакции протекают вполне спокойно: HClO3 + 5 HBr = HCl + 3 Br2 + 3 Н2О. Соли хлорноватой кислоты — хлораты — образуются при электролизе растворов хлоридов в отсутствие диафрагмы между катодным и анодным пространствами, а также при растворении хлора в горячем растворе щелочей, как показано выше. Образующийся при электролизе хлорат калия (бертолетова соль) слабо растворяется в воде и в виде белого осадка легко отделяется от других солей. Как и кислота, хлораты — довольно сильные окислители КСlO3 + 6 HCl = KCl + 3 Сl2 + 3 Н2О. Хлораты применяются для производства взрывчатых веществ, а также получения кислорода в лабораторных условиям и солей хлорной кислоты и перхлоратов. При нагревании бертолетовой соли в присутствии диоксида марганца MnO2 играющего роль катализатора, выделяется кислород. Если же нагревать хлорат калия без катализатора, то он разлагается с образованием калиевых солей хлороводородной и хлорной кислот: 2 КСlO3 = 2 KCl + 3 О2, 4 КClO3 = KCl + 3 КСlO4. При обработке перхлоратов концентрированной серной кислотой можно получить хлорную кислоту. КСlO4 + H2SO4 = KHSO4 + HClO4. Это самая сильная кислота. Она наиболее устойчива из всех кислородсодержащих кислот хлора, но безводная кислота при нагревании, встряхивании или контакте с восстановителями может разлагаться со взрывом. Разбавленные растворы хлорной кислоты вполне устойчивы и безопасны в работе. Хлораты калия, рубидия, цезия, аммония и большинства органических оснований плохо растворяются в воде.
В промышленности перхлорат калия получают электролитическим окислением бертолетовой соли: KClO3 + H2O 2 Н+ + 2е- = H2 (на катоде), СlO3- - 2е- + Н2О = СlO4- + 2 Н+ (на аноде). § 7.13.5. Бром Бром был открыт в 1826 г. французским химиком А. Ж. Баларом. Нахождение в природе. В свободном состоянии бром в природе не встречается. Он не образует также самостоятельных минералов, а его соединения (в большинстве случаев со щелочными металлами) являются примесями хлорсодержащих минералов, таких, как каменная соль, сильвинит и карналлит. Соединения брома встречаются также в водах некоторых озер и буровых скважин. Физические свойства. Бром — легколетучая красно-бурая жидкость с неприятным, удушливым запахом. Кипит при 58,8 °С и затвердевает при -7,3 °С. В 1 л воды при 20 °С растворяется 35 г брома. В органических растворителях бром растворяется значительно лучше. Химические свойства. По химическим свойствам бром напоминает хлор. На внешнем электронном уровне его атома находится 7 электродов (s2р5), он легко присоединяет электрон, образуя ион Br-. Благодаря наличию незаполненного d-уровня бром может иметь 1, 3, 5 и 7 неспаренных электронов и в кислородсодержащих соединениях проявляет степень окисления +1, +3, +5 и +7. Подобно хлору бром взаимодействует с металлами и неметаллами: 2 Al + 3 Вr2 = 2 AlВr3 (бромид алюминия), Н2 + Br2 = 2 HBr (бромоводород). 2 Р + 3 Вr2 = 2 РВr3 (бромид фосфора(III)). Все реакции брома протекают менее энергично, чем хлора. Менее энергично реагирует бром и с водой. При растворении в воде реагирует только часть брома, образуя бромоводородную и бромноватистую кислоты Вr2 + Н2О При растворении брома в растворе щелочи на холоду образуются соли этих кислот: Br2 + 2 NaOH = NaBr + NaBrO + Н2О. С предельными и непредельными углеводородами бром также реагирует менее энергично, чем хлор: С6Н6 + Вr2 СН2=СН2 + Br2 Бром, как и хлор, является окислителем Так, он легко окисляет сернистую кислоту до серной: H2 SO3 + Вr2 + Н2О = H2SO4 + 2 HBr. Если к раствору сероводорода прибавить бромную воду, то красно-бурая окраска исчезает и раствор мутнеет вследствие выделения серы: H2S + Вr2 = 2 HBr + S. Получение. В лабораторных условиях бром получают действием на различные окислители бромоводородной кислоты или ее солей в сернокислотной среде: 2 КМnО4 + 16 HBr = 2 KBr + 2 МnВr2 + 6 Br2 + 8 Н2O, КСlO3 + 6 HBr = KCl + 3 Вr2 + 3 Н2О, 2 КМnО4 + 10 KBr + 8 H2SO4 = 6 К2SO4 + 2 MnSO4 + 5 Br2 + 8 Н2О. В промышленности бром получают действием хлора на различные бромиды: 2 KBr + Cl2 = 2 KCl + Вr2. Применение. Бром применяют для получения различных броморганических соединений, используемых в лакокрасочной и фармацевтической промышленности. Значительные количества брома расходуются для получения бромида серебра, используемого в качестве светочувствительного вещества при изготовлении кинофотоматериалов. Бромоводород и бромоводородная кислота. Бромоводород — это бесцветный газ с резким запахом, переходящий при -66,8 °С в жидкость, затвердевающую при -87 °С. В 1 л воды при 0 °С растворяется около 500 л бромоводорода. Химические свойства бромоводорода и его водного раствора — бромоводородной кислоты — аналогичны свойствам хлороводорода и соляной кислоты с той лишь разницей, что бромоводородная кислота является более сильной кислотой, а бромоводород — более сильным восстановителем.
Бромоводород легко присоединяется по месту двойной или тройной связи непредельных углеводородов, образуя бромпроизводные соответствующих органических соединений: CH3-СН=CH3 + HBr = СН3-CHBr-CH3 Пропилен Изопропилбромид Из-за легкой окисляемости бромоводорода его нельзя получить действием концентрированной серной кислоты на бромиды щелочных металлов при нагревании, так как серная кислота окисляет бромиды до свободного брома: 2 KBr + 2 Н2SO4 = К2SО4 + SO2 + Br2 + 2 Н2O. Свободный от брома бромоводород получают взаимодействием трибромида фосфора с водой: РВr3 + 3 Н2O = Н3РО3 + 3 HBr. Бромоводородная кислота используется для получения бромидов различных металлов, особенно бромида серебра, который используется в производстве светочувствительных кинофотоматериалов. Большинство солей бромоводородной кислоты (бромидов) хорошо растворимо в воде. Нерастворимыми солями являются бромид серебра AgBr, бромид ртути (I) Hg2Br2, бромид меди (I) CuBr и бромид свинца РbВr2. Кислородные соединения брома аналогичны кислородным соединениям хлора, но кислоты являются более слабыми электролитами в более слабыми, окислителями. Кроме бромата калия KBiO3, который применяется в аналитической химии и лабораторной практике, они практического значения не имеют. § 7.13.6. Иод Иод был открыт французским химиком-селитроваром Б. Куртуа в 1811 г. Нахождение в природе. Соединения иода самостоятельных залежей не образуют, а встречаются в виде примесей к минералам хлора. Соли иода содержатся в водах буровых скважин. Заметные количества иода входят в состав некоторых морских водорослей, иода которых может быть использована как сырье для получения этого элемента. Физические свойства. Иод — твердое темно-серое кристаллическое вещество со слабым металлическим блеском. При медленном нагревании он легко возгоняется, образуя фиолетовые пары. При быстром нагревании иод при 114 °С плавится, а при 183 °С кипит. Он хорошо растворим в органических растворителях и водном растворе KI. В присутствии KI растворимость его в воде очень незначительна (при 20 °С в 1 л воды растворяется 290 мг иода). Химические свойства. По химическим свойствам иод похож на хлор и бром, однако менее активен. С водородом он реагирует только при нагревании, причем реакция протекает не до конца:
I2 + Н2 При нагревании иод взаимодействует в фосфором: 2 Р + 3 I2 = 2 РI3 (иодид фосфора(III)). В присутствии воды, играющей роль катализатора, иод интенсивно, почти со взрывом, реагирует о алюминием: 2 Al + 3 I2 = 2 АlI3 (иодид алюминия). С водой иод почти не реагирует, а со щелочью реагирует аналогично хлору и брому: I2 + 2 КОН = KI + КIO + Н2O, 3 I2 + 6 КОН = 5 КI + KIO3 + 3 Н2О. Иод обладает окислительными свойствами, которые проявляет в присутствии сильных восстановителей. Он легко взаимодействует е сернистой кислотой и сероводородом: H2SO3 + I2 + Н2О = H2SO4 + 2 HI, H2S + I2 = 2 HI + S. При взаимодействии иода с тиосульфатом образуется не сульфат, как в случае с хлором или бромом, а тетратионат: I2 + 2 Na2S2O3 = 2 NaI + Nа2S4О6. Эта реакция используется в аналитической химии. Метод анализа, основанный на ее применении, называется иодометрическим. Окончание реакции определяют но появлению или исчезновению синей окраски, которая обусловлена взаимодействием иода с крахмалом. Получение. В лаборатории иод можно получить аналогично получению хлора или брома действием иодоводородной кислоты на различные окислители (КМnО4, МnО2, КСlO3, КВrО3 и даже FeCl3 и CuSO4): 2 KMnO4 + 16 HI = 2 KI + 2 МnI2 + I2 + 8 Н2О, КВrО3 + 6 HI = KBr + 3 I2 + 3 Н2О, 2 FеСl3 + 2 HI = 2 FeCl2 + I2 + 2 HCl, 2 CuSO4 + 4 HI = 2 CuI + 2 H2SO4 + I2. В промышленности иод получают действием хлора на иодиды: 2 KI + Cl2 = 2 KCl + I2. Применение. Иод применяют в лабораторной практике и медицине. Он входит в состав многих фармацевтических препаратов, в качестве 5%-ного водно-спиртового раствора используется для обработки ран. Недостаток иода в организме приводит к серьезным заболеваниям (зоб). Иодоводород и иодоводородная кислота. Иодоводород — это бесцветный, с резким запахом газ, который при -35,4 °С превращается в жидкость, а при -50,8 °С затвердевает. В 1 л воды растворяется около 500 л иодоводорода, образуя иодоводородную кислоту. Среди бескислородных кислот это наиболее сильная кислота. Она значительно сильнее соляной и даже бромоводородной кислот. Иодоводородная кислота — очень сильный восстановитель, поэтому окисляется даже кислородом воздуха, вследствие чего раствор ее окрашивается в бурый цвет: 4 HI + О2 = 2 Н2О + I2. На свету окисление проходит более энергично, чем в темноте, поэтому растворы иодоводородной кислоты хранят в темной стеклянной посуде. Большинство солей иодоводородной кислоты — иодидов — хорошо растворимо в воде. Нерастворимыми солями иодоводородной кислоты являются иодид серебра AgI, иодид ртути (I) Hg2I2, иодид меди (I) CuI и иодид свинца РbI2. Иодоводород получают действием воды на фосфортрииодид: РI3 + 3 Н2O = Н3РО3 + 3 HI. Получить иодоводород действием серной кислоты на иодиды щелочных металлов невозможно, так как почти весь иодид окисляется концентрированной серной кислотой до свободного иода 2 KI + 2 Н2SО4 = К2 SO4 + SO2 + I2 + 2 Н2О, 8 KI + 4 H2SO4 = 3 К2SO4 + K2S + 4 I2 + 4 H2O. Иодоводородная, кислота применяется только в лабораторной практике. Кислородные соединения иода аналогичны кислородным соединениям брома. Слабые кислоты НIO, HIO3 и HIO4 являются также слабыми окислителями. Они находят применение только в лабораторной практике.
§ 7.13.7. Марганец Марганец впервые получили К. В. Шееле и Ю. Ган в 1774 г. Нахождение в природе. По распространению в природе марганец занимает место после железа. Содержание его в земной коре составляет 0,1%. Основным минералом, в виде которого марганец встречается в рудах, является пиролюзит МnО2. Кроме пиролюзитовых марганцевых руд встречаются марганцевые руды, содержащие браунит Мn2О3, манганит MnO(ОН), гаусманит Mn3O4 и марганцевый шпат MnCO3. Кроме того, марганец в виде оксидов содержится почти во всех железных рудах. Физические свойства. Марганец — серебристо-белый металл, плотность его 7,2 г/см3. Он твердый и хрупкий, при 1260 °С плавится, а при 2120 °С закипает. На воздухе металл покрывается пестрыми пятнами оксидной пленки, которая предохраняет его от дальнейшего окисления. С железом марганец образует сплавы с любым соотношением компонентов (ферромарганец). Химические свойства. Марганец образует различные соединения, в которых проявляет степень окисления +2, +3, +4, +6, и +7. Соединения марганца с другими степенями окисления малохарактерны и встречаются очень редко. При взаимодействии металлического марганца в различными неметаллами образуются соединения марганца(II): Mn + Сl2 = MnCl2 (хлорид марганца(II)), Mn + S = MnS (сульфид марганца(II)), 3 Mn + 2 Р = Мn2P3 (фосфид марганца(II)), 3 Mn + N2 = Mn3N2 (нитрид марганца(II)), 2 Mn + Si = Mn2Si (силидид марганца(II)). Марганец легко растворяется в кислотах-неокислителях с выделением водорода: Mn + 2 HCl = МnСl2 + Н2, Mn + H2SO4(разб.) = MnSO4 + Н2. Он растворяется также в воде в присутствии соединений, дающих при гидролизе кислую реакцию: Mn + 2 H2O + 2 NH4Cl = MnCl2 + 2 NH4OH + H2. Растворение марганца в кислотах-окислителях сопровождается выделением продуктов восстановления этих кислот: Mn + 2 H2SO4(конц.) = MnSO4 + SO2 + 2 H2О, Mn + 4 HNO3(конц.) = Mn(NO3)2 + 2 NO2 + 2 Н2O, 3 Mn + 8 HNO3(разб.) = 3 Mn(NO3)2 + 2 NO + 4 H2O. Марганец может восстанавливать многие оксиды металлов и поэтому используется в металлургии: 5 Mn + Nb2O5 = 5 MnO + 2 Nb, 3 Mn +Fe2 O3 = 3 MnO + 2 Fe. В мелкодисперсном состоянии (порошок) марганец более реакционноспособен, чем в компактном. Получение. Металлический марганец получают восстановлением его прокаленных оксидов алюминием. Так как алюминий очень бурно реагирует с диоксидом марганца, используют прокаленный пиролюзит. При прокаливании пиролюзита образуется оксид марганца Мn3O4, который с алюминием реагирует более спокойно: 3 МnО2 = Мn3О4 + О2, 3 Мn3О4 + 8 Al = 4 Al2O3 + 9 Mn. Для получения ферромарганца используемого в металлургии, смесь железной руды и пиролюзита восстанавливают коксом в электропечах: Fе2О3 + MnO2 + 5 C = 2Fe∙Mn + 5 CO. Содержание марганца в ферромарганце 20-60%. Применение. Марганец в виде ферромарганца используют в черной металлургии. Кислородные соединения марганца. Марганец образует оксиды MnO, Мn2О3, МnО2, MnO3, Мn2О7, гидроксиды Mn(ОН)2, Mn(ОН)4, Н2МnО4, НМnО4 и соответствующие им соединения. Монооксид марганца MnO — это порошок зеленовато-серого цвета, обладающий основными свойствами и поэтому реагирующий с кислотами и кислотными оксидами: MnO + 2 HCl = МnСl2 + Н2О, MnO + SO3 = MnSO4. В воде монооксид марганца практически нерастворим. Гидроксид марганца(II) Mn(OH)2 — белое вещество, легко окисляется на воздухе до бурого гидроксида марганца(IV): 2 Mn(OH)2 + О2 + 2 Н2О = 2 Mn(OH)4. Образуется гидроксид марганца(II) при взаимодействии его солей со щелочами: MnSO4 + 2 КОН = Mn(OH)2 + К2SО4. Он обладает основными свойствами. Он реагирует в кислотами и кислотными оксидами: Mn(ОН)2 + 2 HCl = MnCl2 + 2 Н2О, Mn(ОН)2 + SO3 = MnSO4 + 2 H2O. Гидроксид марганца(II) обладает восстановительными свойствами. В присутствии сильных oкиcлитeлeй он может окисляться, до перманганата: 2 Mn(ОН)2 + 5 KBrO + 2 КОН = 2 КМnО4 + 5 KBr + 3 H2O. При недостаточном количестве окислителя образуется диоксид марганца: 5 Mn(ОН)2 + KBrO = 5 МnО2 + KBr + Н2O. Большинство солей марганца(II) хорошо растворимо в воде. В сухом виде их кристаллогидраты окрашены в слабо-розовый цвет. Нерастворимыми солями марганца (II) являются карбонат MnCO3, сульфид МnS и фосфат Мn3(РО4)2. При действии сильных окислителей в кислой среде марганец(II) в зависимости от количества окислителя может переходить в МnО2 или перманганат: Mn(NO3)2 + PbO2 = MnO2 + Pb(NO3)2, 2 Mn(NO3)2 + 5 PbO2 + 6 HNO3 = 2 HMnO4 + 5 Pb(NO3)2 + 2 H2O. Оксид марганца(III) Mn2O3 встречается в природе в виде минерала браунита. В лаборатории образуется при осторожном нагревании MnO2 при температуре 530-940 °С: 4 MnO2 При более высокой температуре разложение диоксида сопровождается образованием оксида Мn3О4: 3 МnО2 = Mn3O4 + О2. Соединения марганца (III) практического значения не имеют. Диоксид марганца МnO2 или оксид марганца(IV) — вещество темно-серого цвета. При нагревании на воздухе до 530 °С диоксид марганца разлагается, выделяя кислород, как показано выше. В вакууме или в присутствии восстановителя эта реакция протекает значительно интенсивнее. При кипячении диоксида марганца с концентрированной азотной кислотой образуется соль марганца(II) и выделяется кислород: 2 MnO2 + 4 HNO3 = 2 Mn(NO3)2 + 2 H2O + O2. Диоксид марганца в кислой среде проявляет окислительные свойства: МnО2 + 4 HCl = MnCl2 + Cl2 + 2 Н2О, МnО2 + 2 FeSO4 + 2 H2SO4 = MnSO4 + Fe2(SO4)3 + 2 H2O. При сплавлении оксида марганца(IV) со щелочами без доступа воздуха образуется манганит, или манганит(IV): МnО2 + 2 КОН = К2МnО4 + Н2O. В присутствии кислорода воздуха, играющего роль окислителя, при сплавлении образуется соль манганата(VI): 2 МnО2 + 4 КОН + О2 = 2 K2MnO4 + 2 H2O. Манганат калия К2МnO4 самопроизвольно разлагается на перманганат калия и диоксид марганца: 3 К2МnO4 + 2 Н2O = 2 KMnO4 + МnО2 + 4 КОН. Перманганат калия KMnO4 широко применяется в лабораторией практике, промышленности, медицине и быту. Он является очень сильным окислителем. В зависимости от среды марганец в присутствии восстановителя может восстанавливаться до различной степени окисления. В кислой среде он всегда восстанавливается до Mn(II): 2 КМnО4 + 10 KBr + 8 H2SO4 = 2 MnSO4 + 6 K2SO4 + 5 Вr2 + 8 Н2O. Аналогично ведут себя манганат калия К2МnО4 и диоксид марганца. В щелочной среде перманганат калия восстанавливается до манганата: 2 КМnО4 + K2SO3 + 2 КОН = K2SO4 + 2 K2MnO4 + Н2O. 4 КМnО4 + 4 КОН = 4 K2MnO4 + 2 Н2O + O2. В нейтральной или слабощелочной среде перманганат калия восстанавливается до диоксида марганца: 2 КМnO4 + С6Н5OН = 2 КОН + 2 МnО2 + С6Н4СООН, 2 КМnO4 + 3 MnSO4 + 2 Н2O = 5 MnO2 + K2SO4 + 2 H2SO4. Последняя реакция используется в аналитической химии при количественном определении марганца. Раньше перманганат калия получали окислением либо диоксида марганца, либо манганата калия. Диоксид марганца окисляли селитрой при сплавлении со щелочью: МnО2 + KNO3 + 2 КОН = К2МnО4 + KNO2 + Н2О. Образовавшийся манганат калия в растворе самопроизвольно распадался на перманганат калия и диоксид марганца: 3 К2МnO4 + 2 Н2O = 2 KMnO4 + МnО2 + 4 КОН. По второму способу манганат калия окисляли хлором: 2 К2МnO4 + Сl2 = 2 КМnO4 + 2 КСl. В настоящее время перманганат калия получают электролитическим окислением манганата: МnО42 - - e- = MnO4-. Перманганат калия широко применяется как в промышленности, так и в лабораторной практике. Его используют для отбелки хлопка, шерсти, прядильных волокон, осветления масел и окисления различных органических веществ. В лабораторной практике он применяется для получения хлора и кислорода: 2 КМnО4 + 16 HCl = 2 КСl + 2 МnСl2 + 5 Сl2 + 8 Н2O, 2 KMnO4 = K2MnO4 + MnO2 + О2. В аналитической химии перманганат калия применяют для количественного определения веществ, обладающих восстановительными свойствами (Fe2+, Sn4+, AsO33-, Н2О2 и др.). Этот метод анализа называется перманганатометрией. Глава 7.14. ВОСЬМАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ ЭЛЕМЕНТОВ § 7.14.1. Общая характеристика элементов VIII группы К VIII группе относятся элементы подгруппы железа (железо, кобальт и никель), платиновые металлы (рутений, родий, палладий, осмий, иридий и платина), а также благородные газы. На внешнем электронном уровне атомов элементов подгруппы железа (Fe, Co, Ni) находится по два s-электрона и соответственно 6, 7 и 8 d-электронов, которые также принимают участие в образовании химических соединений. Электронная структура внешнего электронного уровня платиновых металлов довольно разнообразна. У рутения и родия имеется по одному s-электрону, у палладия s-электронов нет, а осмий, иридий и платина имеют по два s-электрона. У всех девяти металлов VIII группы d-уровень не застроен, поэтому все они относятся к переходным металлам. Благородные газы имеют застроенную внешнюю электронную оболочку (s2p6), поэтому очень трудно вступают в любые химические реакции. Изменение свойств элементов в подгруппе железа во многом сходно с изменением свойств в подгруппе мышьяка и подгруппе германия: если для железа наиболее устойчивыми являются соединения в степени окисления +3, то для никеля — соединения в степени окисления +2. Кобальт занимает промежуточное положение. Платиновые металлы проявляют не очень большое сходство в пределах триад (Ru, Rh, Pd и Os, Ir, Pt), но их можно разделить на три пары сходных между собой элементов: Ru-Os, Rh-Ir и Pd-Pt. Максимальную степень окисления (+8) в VIII группе проявляют только рутений и осмий (в соединениях RuO4 и OsO4). Максимальная степень окисления остальных элементов различна: для железа она равна +6, для иридия и родня +5, для платины и палладия +4, а для кобальта и никеля +3. Все металлы VIII группы обладают способностью адсорбировать на своей поверхности различные газы и поэтому очень часто применяются как катализаторы в различных реакциях: железо — в реакции синтеза аммиака, никель, палладий и платина — в реакциях гидрирования, платиновые металлы катализируют реакции окисления. Кобальт открыт шведским химиком Ю. Брандтом в 1735 г. Содержание его в земной коре составляет 1,8∙10-3% по массе. Кобальт в основном применяется в металлургии для получения спецсталей и сплавов для буровых наконечников, которые частично заменяют алмазные. Соли кобальта применяются в силикатной промышленности как красители. Никель открыт А. Кронстедтом в 1751 г. Содержание его в земной коре составляет 5,8∙10-3% по массе. Из никеля чеканили монеты. В настоящее время его применяют в металлургии для получения хромоникелевых нержавеющих сталей и покрытий. Металлический никель служит катализатором реакций гидрирования. Из сплавов, содержащих никель, изготовляют электросопротивления (константан), спирали нагревательных приборов (нихром) и др. Соли никеля применяют в керамической промышленности как красители. Из платиновых металлов только платина известна человечеству с глубокой древности. Палладий и родий были открыты У. X. Волластоном соответственно в 1803 и 1804 гг., иридий и осмий — С. Теннантом в 1804 г., а рутений — К. К. Клаусом в 1844 г. (назван в честь России). Содержание платиновых металлов в земной коре составляет (% по массе): платины — 5∙10-7, палладия — 1,3∙10-6, иридия 10-6, родия — 10-7, рутения — 5∙10-7, а осмия — 5∙10-6. Платиновые металлы благодаря прочности, высокой температуре плавления, ковкости, стойкости к агрессивным средам применяются очень широко. Наиболее часто применяют платину. Из нее изготовляют электроды, химическую посуду, хирургические инструменты и ювелирные изделия. Платина в виде сеток или нанесенная на асбест (платинированный асбест) применяется как катализатор, в виде проволоки — для изготовления термопар, позволяющих измерять очень высокие температуры. Сплав иридия с платиной применяется для изготовления платино-платиноиридиевых термопар, а также хирургических инструментов. Палладий по внешнему виду похож на серебро. Благодаря большей устойчивости часто применяется вместо серебра, например при изготовлении зеркал. Палладиевые зеркала не тускнеют и обладают большой отражательной способностью. Палладием часто заменяют золото. В тонкораздробленном состоянии (палладиевая чернь) палладий применяется как катализатор. Рутений и осмий применяются в чистом виде и сплавах с платиной преимущественно как катализаторы различных химических реакции. § 7.14.2. Железо Железо относится к металлам, известным человечеству с глубокой древности. В Древнем Египте из железа изготовляли различную домашнюю утварь. Нахождение в природе. Содержание железа в земной коре составляет 4,65% по массе. В свободном состоянии оно найдено только в метеоритах. Основными минералами, содержащими железо, являются магнитный железняк Fe3O4, красный железняк Fe2O3, бурый железняк 2Fе2О3∙3Н2O, шпатовый железняк, или сидерит, FeCO3 и пирит, или железный колчедан, FeS2. Железо, кроме того, входит в состав почти всех полиметаллических руд и многих горных пород. Физические свойства. Чистое железо — серебристо-белый металл, с плотностью 7,86 г/см3, плавится при температуре 1539 °С, кипит при 3000 °С. Оно обладает хорошей ковкостью, электро- и теплопроводностью, легко намагничивается и размагничивается. Это свойство используется в динамомашинах, электромоторах и электромагнитах. Химические свойства. Обычное железо, содержащее различные примеси, является довольно активным металлом. Уже на воздухе, содержащем пары воды, оно быстро покрывается ржавчиной (корродирует)*: *Железо высокой чистоты на воздухе устойчиво. 4 Fe + 3 О2 + 6 Н2О = 4 Fe(OH)3. Железо активно взаимодействует с хлором, а при нагревании — с кислородом, углеродом и другими неметаллами: 2 Fe + 3 Сl2 = 2 FeCl3 (трихлорид железа), 3 Fe + 2 O2 = Fe3O4 (железная окалина), 3 Fe + С = Fe3С (карбид железа), Fe + S = FeS (сульфид железа), 2 Fe + N2 = 2 FeN (нитрид железа). Железо легко растворяется в разбавленных соляной и серной кислотах. Fe + H2SO4 = FeSO4 + Н2. В концентрированной серной кислоте при обычной температуре оно не растворяется, а при нагревании реакция сопровождается выделением сернистого газа: 2 Fe + 6 H2SO4 = Fe2(SO4)3 + 3 SО2 + 6 Н2О. В разбавленной азотной кислоте железо растворяется хорошо: Fe + 4 HNO3 = Fe(NO3)3 + NO + 2 Н2О, а в концентрированной — пассивируется. С водой при обычных условиях железо не взаимодействует, однако при длительном контакте с водой, содержащей кислород, железо, имеющее примеси, постепенно корродирует. Из растворов солей железо легко вытесняет все металлы, стоящие в ряду напряжений правее него. При этом в отсутствие окислителей образуются соли железа (II): Fe + CuSO4 = FeSO4 + Cu. Соединения железа(II). Оксид железа(II) FeO обладает основными свойствами. Он не взаимодействует с водой, но легко растворяется в кислотах: FeO + 2 HCl = FeCl2 + Н2O. При растворении оксида железа(II) в азотной кислоте образуется нитрат железа(III), так как азотная кислота является сильным окислителем 3 FeO + 10 HNO3 = 3 Fe(NO3)3 + NO + 5 H2O. Оксид железа(II) можно получить восстановлением оксида железа(III) монооксидом углерода при температуре 500 °С: Fe2O3 + СО = 2 FeO + СО2. Соли железа(II) являются восстановителями. Если к раствору соли железа(II) прибавить раствор щелочи, то в осадок выпадет гидроксид железа(II) голубовато-белого цвета: FeSO4 + 2 КОН = Fe(OH)2 + K2SO4. Осадок быстро темнеет, становится черным, а затем бурым. Изменение его цвета объясняется тем, что железо окисляется кислородом до степени окисления +3 и гидроксид железа (II) превращается в гидроксид железа(III): 4 Fe(ОН)2 + O2 + 2 Н2О = 4 Fe(OH)3. В кислой среде железо(II) окисляется значительно медленнее, поэтому соли его могут существовать более длительное время. Из солей железа(II) наибольшее значение имеют железный купорос FeSO4∙7Н2О и дихлорид железа FeCl2. Железный купорос применяется в производстве минеральных красок, при крашении тканей, для борьбы с вредителями сельского хозяйства и др. Дихлорид железа является исходным соединением для получения чистого железа. Соединения железа(III). Оксид железа(III) Fe2O3 — твердое порошкообразное вещество красно-бурого цвета. При высокой температуре переходит в железную окалину: 6 Fе2О3 = 4 Fе3O4 + O2. Оксид железа(III) обладает слабо выраженными амфотерными свойствами — при сплавлении со щелочами или карбонатами щелочных металлов образует ферриты: Fе2О3 + Na2CO3 = 2 NaFeO2 + СО2. Ферриты щелочных металлов при контакте с водой полностью гидролизуются: 2 NaFeO2 + H2O = Fe2O3 + 2 NaOH. Ферриты тяжелых металлов, полученные спеканием порошков оксида железа(III) с оксидами тяжелых металлов (никеля, кобальта, марганца и др.) — очень твердые хрупкие вещества. Они применяются в радиотехнике (ферритовые антенны и сердечники). Оксид железа(III) хорошо растворяется в кислотах, образуя соли железа(III): Fе2O3 + 3 H2SO4 = Fe2(SO4)3 + 3 Н2O. Соли железа(III) сильно гидролизуются, поэтому их водные растворы обладают сильнокислой реакцией. Они являются окислителями: 2 FeCl3 + Н2S = 2 FeCl2 + S + 2 HCl, 2 FeCl3 + 2 KI = 2 FeCl2 + I2 + 2 KCl, 2 FеСl3 + Fe = 3 FeCl2. Если к раствору соли железа(III) прибавить раствор щелочи или аммиака, выпадет бурый осадок гидроксида железа(III), который не растворяется даже в концентрированном растворе щелочи, но легко растворяется в кислотах: FeCl3 + 3 КОН = Fe(ОН)3 + 3 KCl, 2 Fe(OH)3 + 3 Н2SО4 = Fe2(SO4)3 + 6 Н2О. Если же к раствору соли железа(III) прибавить раствор роданида калия KSCN или аммония NH4SCN, то образуется, окрашенный в красный цвет, роданид железа(III): Fe(NO3 )3 + 3 KSCN = Fe(SCN)3 + 3 КNO3. Эта реакция применяется в аналитической химии для определения солей железа(III). Производство чугуна и стали Получение железа и чугуна. Чистое железо получают восстановлением водородом оксида железа(III) или хлорида железа(II): Fе2O3 + 3 Н2 = 2 Fe + 3 Н2О, FeCl2 + Н2 = Fe + 2 HCl. Основная масса железа используется не в чистом виде, а в виде сплавов с углеродом и другими добавками. Эти сплавы называются чугуном или сталью. Для получения чугуна и сталей перерабатывают железный руды, содержащие железо в виде оксидов. Сульфидные руды непригодны для получения железа, так как сера переходит в железо и придает ему свойство горячеломкости. Процесс переработки железных руд делится на первичный и вторичный. При первичной переработке из железной руды получают чугун. С содержанием углерода больше 2%, а при вторичном. из чугуна получают сталь с содержанием углерода меньше 2%. Первичный процесс, т. е. получение чугунов, производится в доменных печах (домнах).
|
|||||||||
|
Последнее изменение этой страницы: 2021-04-05; просмотров: 80; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.146.255.127 (0.177 с.) |
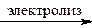 KClO4 + H2,
KClO4 + H2, HBr + HBrO.
HBr + HBrO. С6Н5Вr + HBr,
С6Н5Вr + HBr,


