
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Глава 7.10. Четвертая группа периодической системыСодержание книги Поиск на нашем сайте Соболев А. Д. 43 Курс лекций по общей и неорганической химии 3 том Тула 2011 год
Соболев А. Д. Курс лекций по общей и неорганической химии для учащихся Химического лицея. Т3. Издание 5-е исправленное и дополненное. ОГЛАВЛЕНИЕ Глава 7.10. Четвертая группа периодической системы § 7.10.1. Общая характеристика элементов IV группы................... 5 § 7.10.2. Углерод.................................................................................. 7 § 7.10.3. Углекислый газ и угольная кислота................................. 13 § 7.10.4. Кремний............................................................................... 19 § 7.10.5. Олово................................................................................... 24 § 7.10.6. Свинец................................................................................. 28 Глава 7.1 1. Пятая группа периодической системы § 7.11.1. Общая характеристика элементов V группы.................. 32 § 7.11.2. Азот...................................................................................... 34 § 7.11.3. Азотный ангидрид и азотная кислота.............................. 41 § 7.11.4. Фосфор................................................................................. 47 § 7.11.5. Фосфорный ангидрид и фосфорные кислоты................. 51 Глава 7.1 2. Шестая группа периодической системы § 7.12.1. Общая характеристика элементов VI группы................. 56 § 7.12.2. Сера...................................................................................... 58 § 7.12.3. Серный ангидрид и серная кислота................................. 65 § 7.12.4. Хром..................................................................................... 74 Глава 7.13. Седьмая группа периодической сис темы § 7.13.1. Общая характеристика элементов VII группы............... 79 § 7.13.2. Фтор..................................................................................... 81 § 7.13.3. Хлор..................................................................................... 83 § 7.13.4. Кислородные соединения хлора....................................... 89 § 7.13.5. Бром...................................................................................... 92 § 7.13.6. Иод....................................................................................... 96 § 7.13.7. Марганец............................................................................. 98 Глава 7.14. Вось мая группа периодической системы § 7.14.1. Общая характеристика элементов VIII группы............ 104 § 7.14.2. Железо................................................................................ 107 § 7.14.3. Производство чугуна и стали.......................................... 110 Глава 7.15. Металлы § 7.15.1. Общие свойства металлов............................................... 117 Глава 7.10. ЧЕТВЕРТАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ ЭЛЕМЕНТОВ § 7.10.1. Общая характеристика элементов IV группы IV группа состоит из двух подгрупп: подгруппа А или главная подгруппа включает углерод, кремний и подгруппу германия: германий, олово и свинец, и подгруппа Б или побочная подгруппа титана: титан, цирконий и гафний. На внешнем электронном уровне у элементов главной подгруппы находится четыре электрона (s2р2), поэтому они могут присоединять по четыре электрона и образовывать восьмиэлектронную оболочку или за счет перехода s-электрона на р-орбиталь образовывать четыре неспаренных электрона. По этой причине для углерода и кремния наиболее характерными степенями окисления является +4 или -4. Для германия более характерны и более устойчивы соединения со степенью окисления +4, а для свинца — со степенью окисления +2. Олово занимает промежуточное положение. У элементов подгруппы титана заполняется d-уровень, поэтому они называются переходными или d-элементами. На внешнем электронном уровне их атомов также находится по четыре электрона (d2s2). Однако атомы титана, циркония и гафния не могут присоединять электроны и поэтому не образуют соединений с отрицательной степенью окисления. Как и в побочной подгруппе V группы (подгруппе ванадия), в подгруппе титана наблюдается увеличение устойчивости соединений с максимальной степенью окисления: титан образует соединения со степенью окисления +3, а для циркония и гафния такие соединения не известны. Элементы подгруппы германия по свойствам отличаются от первых двух элементов IV группы — углерода и кремния: углерод и кремний — типичные неметаллы, а в подгруппе германия при переходе от германия к свинцу наблюдается нарастание металлических свойств. Германий был открыт немецким химиком К. Винклером в 1886 г. Содержание его в земной коре составляет 1,4∙10-3%. Длительное время он не находил практического применения, сейчас он является одним из основных полупроводников. Электропроводность германия сильно зависит от температуры и чистоты вещества. В качестве полупроводника может быть использован только германий в котором сумма примесей не превышает 10-6%. Олово и свинец широко применяются в промышленности. Титан был открыт У. Грегором в 1791 г. Содержание его в земной коре составляет 0,45%. Титан используют в основном для получения сталей. Его добавка увеличивает прочность и ковкость стали, а также прочность медных сплавов. Титан завоевывает все большее признание как заменитель сталей. Раньше титан считали хрупким металлом, но хрупкость ему придают примеси оксида и нитрида титана, образующиеся при его переплавке на воздухе. Титан, переплавленный в вакууме, очень пластичен и по прочности не уступает некоторым сортам стали. Легкий (почти в 1,5 раза легче стали) и стойкий к действию кислорода воздуха (благодаря защитной оксидной пленке) титан может конкурировать со сталью в таких отраслях промышленности, как самолето-, судо- и моторостроение. Титан применяется также в оптике; стекло, покрытое тонким слоем металла, отличается большим коэффициентом светопреломления. Диоксид титана находит применение в производстве минеральных красок (титановые белила), а также глазурей в фарфоровой и фаянсовой промышленности. Соли титана(III) применяются в лабораторной практике в качестве восстановителей. Металлический цирконий впервые был получен Й. Я. Берцелиусом в 1824 г. (диоксид циркония открыл М. Г. Клапрот в 1789 г.). Содержание его в земной коре составляет 0,017%. Применяется в металлургии добавка циркония увеличивает твердость и пластичность стали, делает более устойчивым к действию морской воды алюминий. Металлический цирконий применяется также в качестве конструкционного материала в ядерной технике. Диоксид циркония отличается очень высокой температурой плавления и устойчивостью к агрессивным средам при высоких температурах. Поэтому он применяется для изготовления огнеупоров. Карбид циркония очень тверд и используется для резания стекла и изготовлении шлифовальных порошков. Гафний был открыт Д. Хевеши и Д. Костером в 1922 г. Содержание его в земной коре составляет 10-4%. Гафний является постоянным спутником циркония и отделить его от последнего весьма трудно. Гафний применяют в рентгеноспектрографии для изготовления телескопов. § 7.10.2. Углерод Углерод относится к числу элементов, известных человечеству с давних времен. Нахождение в природе. Углерод находится в природе как в свободном состоянии, так и в соединениях. Содержание его в земной коре 0,02%. В свободном кристаллическом состоянии углерод встречается в виде двух аллотропных видоизменений: алмаза и графита. Алмаз встречается очень редко в виде отдельных кристаллов. Графит образует мощные залежи. Термическим разложением органических соединений можно получить различные формы черного углерода. Раньше его считали особой аморфной модификацией, но теперь доказано, что он имеет кристаллическую решетку такого же типа, как графит. Искусственно получены — карбин, молекулы которого имеют линейное строение и фуллерены, объемные структуры напоминающие мячи. В связанном состоянии углерод встречается в карбонатах, основными минералами которых являются кальцит СаСО3, входящий в состав известняка, мела и мрамора, магнезит МgСО3, доломит СаСО3∙МgСО3, железный шпат или сидерит FеСО3 и малахит СuСО3∙Cu(ОН)2. Кроме того, углерод — основная составная часть каменных и других углей, нефти, горючих природных газов и всех живых организмов. Физические свойства. Аллотропические видоизменения углерода резко отличаются друг от друга. Алмаз — прозрачное вещество, самое твердое из всех природных веществ. Он служит эталоном твердости, которая оценивается по десятибалльной системе числом 10, такая твердость алмаза обусловлена особой структурой его кристаллической решетки. Алмаз плохо проводит тепло и не проводит электричество. При нагревании без доступа воздуха он превращается в графит. В настоящее время найдены условия получения алмазов искусственным способом из графита (нагревание графита при 3000 °С и давлении 70-100 тыс. атм.). Синтетические алмазы широко применяются в технике. Графит — темно-серое вещество с металлическим блеском. Он имеет слоистую структуру и поэтому сравнительно мягок (оставляет след на бумаге). Графит хорошо проводит электричество (но хуже, чем металлы), очень тугоплавок. Черный (аморфный) углерод представляет собой пористое вещество черного цвета. Характерные представители этой модификации углерода — сажа, кокс, древесный уголь. Они не встречаются в чистом виде, а обычно содержат различные примеси. Химические свойства. Наиболее реакционноспособным является черный углерод, за ним идут графит и алмаз. При обычной температуре углерод довольно инертен, но при нагревании реагирует со многими веществами: кислородом, серой, оксидами металлов и неметаллами. При взаимодействии кислорода с углеродом в зависимости от количества кислорода образуется монооксид или диоксид углерода и выделяется большое количество теплоты: 2 С + O2 С + O2 = СО2. Углерод — сильный восстановитель, отнимая кислород у многих оксидов, он восстанавливает вещества до свободного состояния: ZnO + C = Zn + CO, SiO2 + 2 С = Si + 2 СО. Углерод взаимодействует с металлами с образованием карбидов: 4 Al + 3 С = Аl4С3 (карбид алюминия), Ca + 2 С = СаС2 (карбид кальция). При взаимодействии карбидов с водой или кислотой выделяется либо метан, либо ацетилен: Аl4C3 + 12 HCl = 4 АlСl3 + 3 СН4, СаС2 + 2 Н2О = Ca(ОН)2 + С2Н2. Ряд карбидов имеет состав, который не подчиняется общепринятым представлениям о валентности, например Fе3С. Карбиды металлов образуются также при реакции углерода с оксидами металлов: CaO + 3 С = СаС2 + СО. При взаимодействии избытка углерода с диоксидом кремния (песком или кварцем) кроме кремния образуется карбид кремния (карборунд), который отличается очень большой твердостью: SiO2 + 3 С = SiС + 2 СО. С галогенами углерод непосредственно не взаимодействует. Соединения углерода с галогенами получают из других его соединений, например углеводородов. Получение. Раньше графит получали только из его природных залежей. В настоящее время его получают из кокса. Через массу кокса, смешанного со смолой и песком, пропускают переменный ток большой силы. В такой электрической дуге через 24-36 ч кокс превращается в графит. Полученный графит по качеству и чистоте превосходит природный. Сажу получают термическим разложением углеводородов: С3Н8 = 3 С + 4 Н2. Применение. Алмазы применяются при изготовлении наконечников буров, резании стекла, протягивании тонкой проволоки, для получения специальных шлифовальных порошков, а также в ювелирном деле. Хорошо отшлифованные прозрачные кристаллы — бриллианты — являются драгоценными камнями. Графит широко применяется в электротехнике для изготовления электродов, которые во многих электроустановках заменяют платиновые. Графит идет также на изготовление тиглей для переплавки металлов, специальных термостойких смазок, карандашей. Сажу используют при вулканизации каучука, а также для изготовления красок, туши и сапожного крема. Каменный уголь, кокс применяются как восстановители в металлургических процессах. Древесный уголь используют как поглотитель (адсорбент). Адсорбция. Некоторые вещества способны поглощать молекулы других веществ из газов, паров и растворов и удерживать их на своей поверхности. Поглощение газов, паров и растворенных веществ поверхностью других веществ называется адсорбцией. Вещества, которые поглощают, называются адсорбентами. Процесс адсорбции протекает тем интенсивнее, чем больше поверхность адсорбента. Для увеличения поверхности адсорбент измельчают или делают пористым. Одним из лучших адсорбентов является древесный уголь. Он хорошо адсорбирует различные газы, пары и растворенные вещества. Если водный раствор красителя прокипятить с древесным углем и профильтровать, то фильтрат окажется бесцветным (весь краситель поглотится углем). Высокая адсорбционная способность древесного угля обусловлена его большой пористостью, а следовательно, и большой поверхностью. Улучшить адсорбционные качества угля можно обработкой его перегретым паром, который удаляет из пор все загрязняющие вещества, увеличивая общую поверхность угля. Такой уголь называется активированным. Его применяют для очистки спирта от сивушных масел, сахарного сиропа — от окрашенных веществ, для улавливания бензина из природных газов, а также для очистки воздуха от отравляющих веществ (последнее было использовано в фильтрующем противогазе, предложенном Н. Д. Зелинским в период первой мировой войны 1914-1918 гг.). Активированный уголь в виде таблеток применяют при отравлениях и желудочных заболеваниях для удаления вредных веществ из организма. Его применяют также как катализатор. Хорошими адсорбентами являются также силикагель и алюмогель (частично обезвоженные кремниевая кислота и гидроксид алюминия) и различные синтетические смолы. Монооксид углерода СО. При неполном сгорании углерода или продуктов, содержащих углерод, образуется монооксид углерода, или угарный газ, СО. Монооксид углерода — ядовитый газ без цвета и запаха. При температуре -192 °С, он сжижается, а при -205 °С затвердевает. Растворимость монооксида углерода в воде низкая. Отравляющее действие его состоит в том, что он необратимо взаимодействует с гемоглобином крови, который после этого теряет способность переносить кислород от легких к тканям. По химическим свойствам монооксид углерода — восстановитель. Он хорошо горит, выделяя большое количество теплоты: 2 СО + O2 = 2 СО2. Монооксид углерода может отнимать кислород от оксидов металлов, что используется в металлургических процессах: FeO + СО = Fe + СО2. В присутствии активированного угля, играющего роль катализатора монооксид углерода присоединяет хлор, образуя фосген, который применялся как боевое отравляющее вещество: СО + Сl2 = СОСl2. При высокой температуре (400 °С) и давлении 300 атм. монооксид углерода реагирует с водородом, образуя метиловый спирт: СО + 2 Н2 При повышенной температуре монооксид углерода взаимодействует со щелочами, образуя соли муравьиной кислоты (формиаты): СО + NaOH = HCOONa. При взаимодействии монооксида углерода с аммиаком образуется очень ядовитое вещество — синильная кислота: СО + NН3 = НСN + Н2О. В лабораторных условиях монооксид углерода можно получить действием концентрированной серной кислоты на муравьиную или щавелевую кислоту при нагревании: НСООН Н2С2О4 Серная кислота здесь играет роль водоотнимающего агента. В промышленности монооксид углерода получают газификацией твердого топлива. Монооксид углерода чаще всего образуется при пропускании диоксида углерода (углекислого газа) над раскаленным углем: СО2 + С = 2 СО + 171,5 кДж. Монооксид углерода находит широкое применение. Он входит в состав искусственного газообразного топлива, а также используется в органическом синтезе. Соединения олова(IV) Диоксид олова SnО2, проявляет амфотерные свойства. Он плохо растворяется как в кислотах, так и в растворах щелочей. Реакция сплавления со щелочами протекает довольно легко: SnО2 + 2 КОН = К2SnО3 + Н2О. Образуются соли оловянной кислоты — станнаты. При нейтрализации щелочного раствора олова(IV) кислотой или кислого раствора щелочью выпадает гидроксид олова(IV), который хорошо растворяется в избытке кислоты или щелочи: SnСl4 + 4 КОН = 4 КСl + Sn(ОН)4, Sn(ОН)4 + 2 КОН = К2[Sn(ОН)6], К2[Sn(ОН)6] + Н2SO4 = К2SO4 + Sn(ОН)4 + 2 Н2О, Sn(ОН)4 + 2 H2SО4 = Sn(SO4)2 + 4 Н2О. Олово(IV) может в присутствии восстановителя переходить в олово(II): SnСl4 + Sn = 2 SnСl2 SnСl4 + Fe = SnСl2 + FеСl2 Сульфид олова(IV) SnS2, нерастворим в кислотах, но растворим в щелочах и сульфиде аммония: SnS2 + 6 КОН = К2[Sn(ОН)6] + 2 К2S, SnS2 + (NН4)2S = (NН4)2SnS3. Образовавшаяся соль отличается от станната натрия тем, что в ней кислород замещен серой. Такие соединения называются тиосолями. Сульфид олова(IV) SnS2, называют иногда сусальным золотом и применяют при изготовлении красок для золочения. Соединения олова(II) Действуя щелочью на кислый раствор дихлорида олова, можно получить гидроксид олова(II): SnСl2 + 2 КОН = 2 КСl + Sn(ОН)2. Он обладает амфотерными свойствами и легко растворяется как в кислотах, так и в растворах щелочей: Sn(ОН)2 + 2 HCl = SnСl2 + 2 Н2О, Sn(ОН)2 + 2 КОН = К2[Sn(ОН)4]. На воздухе он окисляется до гидроксида олова(IV): 2 Sn(ОН)2 + О2 + 2 Н2О = 2 Sn(ОН)4. Соли оловянистой кислоты (станниты) неустойчивы и подвергаются реакции диспропорционирования: 2 К2[Sn(ОН)4] = К2[Sn(ОН)6] + Sn + 2 КОН. Все соединения олова(II) малоустойчивы и окисляются кислородом воздуха, переходя в соединения олова(IV). Соли олова(II) подвержены гидролизу. Моносульфид олова SnS нерастворим в кислотах, щелочах и сульфиде аммония, но растворим в полисульфиде аммония. SnS + (NH4)2S2 = (NH4)2SnS3. Растворение сулъфидов олова в полисульфиде аммония используется в аналитической химии для отделения ионов многих других металлов. § 7.10.6. Свинец Свинец, как и олово, известен человеку с давних времен. Нахождение в природе. Содержание свинца в земной коре составляет 1,6∙10-3%, что намного меньше, чем содержание таких редких металлов, как стронций, цирконий, рубидий, лантан и др. Обычно свинец встречается в виде сульфида РbS, называемого свинцовым блеском. Он входит в состав полиметаллических сульфидных руд. Физические свойства. Свинец — металл голубоватого цвета. На воздухе его поверхность окисляется и делается матовой. Он плавится при температуре 327,4 °С, кипит при 1740 °С, легко образует сплавы с оловом и другими металлами. Химические свойства. На холоду свинец довольно инертен, но при нагревании легко вступает в реакцию с кислородом, серой и хлором: 2 Рb + O2 = 2 PbO (монооксид свинца или свинцовый глет), Рb + S = PbS (сульфид свинца), Рb + Сl2 = РbСl2 (хлорид свинца). Свинец хорошо растворяется в азотной кислоте, но плохо — в соляной и серной, так как образует труднорастворимый сульфат или хлорид свинца, который препятствует его дальнейшему растворению: 3 Рb + 8 НNО3 = 3 Рb(NО3)2 + 2 NО + 4 Н2О, Рb + Н2SО4 = PbSO4 + Н2, Рb + 2 HCl = РbСl2 + Н2. Ацетат образует со свинцом такой прочный комплекс, что в ацетате аммония легко растворяется даже труднорастворимый сульфат свинца: РbSO4 + 2 СН3СООNН4 = Рb(СН3СОО)2 + (NН4)2SO4. Эта реакция используется в аналитической химии для отделения свинца от труднорастворимых сульфатов других металлов. При сплавлении свинца со щелочами в присутствии окислителей он образует растворимые соединения: Рb + КNО3 + 2 КОН = К2РbО2 + КNО2 + Н2О. Получение. Свинец получают из свинцовых концентратов, которые выделяют путем обогащения из полиметаллических сульфидных руд. Вначале сульфидный концентрат обжигают: 2 PbS + 3 О2 = 2 PbO + 2 SO2, а затем проводят так называемую конвертерную плавку, при которой оксид свинца восстанавливается сульфидом свинца: PbS + 2 PbO = 3 Рb + SО2. Применение. Металлический свинец применяется при изготовлении сернокислотных аккумуляторов, экранирования кабелей, защиты от радиоактивных и рентгеновских лучей, изготовления анодов, использующихся при электролитическом выделении металлов из сернистого электролита, и для футеровки (обкладки) аппаратов, в которых проводятся реакции в сернокислом растворе. Кроме того, свинец используют для получения антифрикционных, типографских и других легкоплавких сплавов. Монооксид свинца PbO. Желтый или красный порошок, не растворяется в воде, но растворяется в кислотах и щелочах: PbO + 2 НNО3 = Рb(NО3)2 + Н2О, PbO + 2 КОН + Н2О = К2[Рb(ОН)4]. Реакция монооксида свинца со щелочью значительно легче протекает при сплавлении: PbO + 2 КОН = К2РbО2 + Н2О. Это объясняется тем, что монооксид свинца обладают основными свойствами в большей степени, чем кислотными. Гидроксид свинца(II) Рb(ОН)2. Вещество белого цвета хорошо растворимо как в кислотах, так и в щелочей: Рb(ОН)2 + 2 НNO3 = Pb(NО3 )2 + 2 Н2О, Рb(ОН)2 + 2 КОН = К2[Рb(ОН)4]. При взаимодействии монооксида и гидроксида свинца(II) со щелочами образуются плюмбиты. Соли свинца(II) (кроме Рb(NO3)2 и Рb(СН3СОО)2) нерастворимы в воде. Соединения свинца(II) очень устойчивы. Перевести соединения свинца(II) в соединения свинца(IV) можно только действием сильного окислителя или анодным окислением: Рb(СН3СОО)2 + СаОСl2 + Н2О = РbО2 + 2 СН3СООН + СаСl2, Рb(NО3)2 + 2 Н2О - 2е- = РbО2 + 2 НNО3 + 2 Н+ (на аноде), 2 Н+ + 2е- = Н2 (на катоде). Реакция окисления ацетата свинца хлорной известью используется для получения диоксида свинца в промышленности. Диоксид свинца РbО2. Вещество коричневого цвета, очень трудно растворяется в кислотах и немного лучше — в растворах щелочей (кислотные свойства выражены сильнее, чем основные). Сульфат свинца(IV) образуется только при кипячении диоксида свинца в концентрированной серной кислоте: РbО2 + 2 Н2SО4 = Рb(SO4)2 + 2 Н2О. При растворении диоксида свинца в растворе щелочи образуются соли свинцовой кислоты — плюмбаты: РbО2 + 2 КОН + 2 Н2О = К2[Рb(ОН)6] (растворение), РbО2 + 2 КОН = К2РbО3 + Н2О (плавление). Диоксид свинца обладает сильными окислительными свойствами, особенно в кислой среде. Он может окислять даже соединения марганца(II) до перманганата: 2 МnSO4 + 5 РbО2 + 3 Н2SО4 = 2 НМnO4 + 5 РbSO4 + 2 Н2О. При нейтрализации раствора Рb(SO4)2 выпадает гидроксид свинца(IV) бурого цвета: Рb(SО4)2 + 4 КОН = Рb(ОН)4 + 2 К2SО4. Оксиды свинца применяют для получения свинцово-глицериновой замазки, антикоррозионного красителя — сурика, основного карбоната 2РbСО3∙Рb(ОН)2, который является основой свинцовых белил. Все соединения свинца очень ядовиты. На окислительных свойствах четырехвалентного свинца основана работа свинцового аккумулятора. В сернокислотных аккумуляторах свинцовые пластины помещают в раствор серной кислоты. При этом они покрываются слоем сульфата свинца. При зарядке аккумулятора пластины одного полюса отдают электроны и сульфат свинца превращается в диоксид свинца: РbSO4 + 2 Н2О - 2е- = РbО2 + Н2SO4 + 2 Н+. Сульфат свинца на другом полюсе присоединяет электроны и восстанавливается до свободного свинца: РbSO4 + 2 Н+ + 2е- = Рb + Н2SO4. Таким образом, в заряженном аккумуляторе одним полюсом являются свинцовая пластина, покрытая диоксидом свинца, а другим — чистая свинцовая пластина. При разрядке аккумулятора свинец чистой свинцовой пластины отдает электроны и превращается в сульфат свинца(II): Рb - 2е- + Н2SO4 = РbSО4 + 2 Н+. Диоксид свинца присоединяет электроны, также превращаясь в сульфат свинца(II): РbО2 + 2е- + Н2SO4 = РbSО4 + 2 OН-, 2 Н+ + 2 OН- = 2 H2О. Следовательно, при разрядке аккумулятора поток электронов направлен от свинцовой пластины (-) к пластине, покрытой диоксидом свинца (+). Глава 7.11. ПЯТАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ ЭЛЕМЕНТОВ § 7.11.1. Общая характеристика элементов V группы К элементам V группы Периодической системы Д. И. Менделеева относятся азот, фосфор, подгруппа мышьяка (мышьяк, сурьма и висмут) и подгруппа ванадия (ванадий, ниобий и тантал). Азот, фосфор и подгруппа мышьяка составляют главную подгруппу, а подгруппа ванадия — побочную. Элементы главной подгруппы на внешнем электронном уровне имеют по пять электронов (s2p3). Поэтому они могут присоединять по три электрона, образуя восьмиэлектронную внешнюю оболочку, или за счет перехода s-электрона на d-уровень иметь пять неспаренных электронов и вследствие этого проявлять степень окисления +3 или +5. Атом азота не имеет d-уровня, поэтому для образования соединений, в которых его степень окисления +5, он вынужден отдавать один электрон атому кислорода и образовывать четыре электронные пары. Такое состояние малоустойчиво, поэтому азотная кислота и нитраты обладают очень сильными окислительными свойствами. В подгруппе мышьяка устойчивость соединений изменяется следующим образом: для мышьяка более устойчивы соединения мышьяка (V), а для висмута — висмута (III). Соединения сурьмы занимают промежуточное положение. У элементов побочной подгруппы идет застройка d-уровня. Все они имеют на внешнем электронном уровне по пять электронов, но у ванадия и тантала это d3s2-, а у ниобия d4s1-электроны. Поэтому высшая степень окисления у этих элементов достигается за счет s- и d-электронов. Ванадий наряду со степенью окисления +5 проявляет степень окисления +4 (соли ванадила типа VOSO4), а для ниобия и тантала наиболее характерны соединения со степенью окисления +5. Содержание мышьяка в земной коре составляет 1,7∙ 10-4%. Металлический мышьяк используют только в виде очень малой добавки к свинцу при изготовлении дроби. Соединения мышьяка применяют для борьбы с вредителями сельского хозяйства, при изготовлении некоторых красок, в стекольной промышленности и медицине. Все соединения мышьяка очень ядовиты. Содержание сурьмы в земной коре 5∙10-5%. Она обладает данным свойством увеличивать твердость мягких металлов и используется для получения различных сплавов с оловом, свинцом и др. Соединения сурьмы применяются в резиновой промышленности и медицине. Висмут был открыт А. Лавуазье в середине XVIII в. Содержание его в земной коре составляет 9∙10-7%. Металлический висмут используют как добавку к легкоплавким сплавам. Соединения висмута применяются в силикатной промышленности: оксид висмута вместе с оксидом свинца — для получения оптического стекла, а основной нитрат висмута — для окраски фарфора. Соединения висмута применяются также для получения медицинских и косметических препаратов. Ванадий был открыт А. М. дель Рио в 1801 г., Н. Г. Сефстрёмом в 1830 г. и Г. Роско в 1869 г. Содержание его в земной коре составляет 9∙10-3%. Он применяется в металлургической промышленности. Добавка ванадия к стали повышает ее ковкость, вязкость и упругость. Эти стали используются в моторостроении. Оксид ванадия (V) — очень хороший катализатор реакций окисления и в настоящее время с успехом применяется вместо платины во многих технологических процессах. Ниобий в виде оксида был выделен английским химиком Ч. Хатчетом в 1801 г. из минерала колумбита и назван колумбием. В 1844 г. Г. Розе отделил от тантала очень сходный с колумбием металл и назвал его ниобием. Позднее было доказано, что колумбий и ниобий — один и тот же элемент (и теперь ниобий иногда называют колумбием). Ниобий применяют в металлургической промышленности для получения сталей, отличающихся большой кислотоусуойчивостью. Тантал был открыт А. Г. Экебергом в 1802 г. Содержание его в земной коре составляет 2,5∙10-4%. Он, как и ниобий, применяется для получения кислотоустойчивых сталей, а как кислотостойкий металл — вместо платины в агрессивных средах. Тантал не оказывает вредного действия на ткани живого организма, поэтому применяется в хирургии. Из него изготовляют хирургические инструменты. § 7.11.2. Азот Азот впервые был выделен из воздуха английским химиком Д. Резерфордом в 1772 г. Содержание его в земной коре составляет 1,9∙10-3%. Нахождение в природе. Азот встречается в свободном состоянии и соединениях. Свободный азот составляет 78,16% объема воздуха. Над 1 км2 земной поверхности в воздухе находится около 8 млн. т азота. В связанном состоянии азот встречается в нитрате натрия, или натриевой (чилийской) селитре NaNO3, огромные залежи которого находятся в Чили. Он входит в состав белковых веществ в многих природных органических соединений. По словам известного советского микробиолога В. Л. Омелянского, азот более драгоценен с общебиологической точки зрения, чем самые редкие из благородных металлов. Физические свойства. Азот — бесцветный газ, без запаха, при -195,8 °С переходит в жидкое состояние, а при -210 °С затвердевает. В 1 объеме воды при 20 °С растворяется 0,0154 объема азота (значительно меньше, чем кислорода). Химические свойства. При комнатной температуре азот малоактивен. При температуре электрической дуги он соединяется с кислородом, образуя монооксид: N2 + О2 При высокой температуре взаимодействует с металлами, образуя нитриды: 3 Mg + N2 = Mg3N2. При высоких температуре и давлении в присутствии катализатора азот реагирует также с водородом. Важнейшим продуктом взаимодействия азота с водородом является аммиак: N2 + 3 Н2 Кроме аммиака известны другие соединения азота с водородом гидразин N2H4, гидроксиламин NН2ОН и азидная кислота HN3. Получение. В промышленности азот получают ректификацией (перегонкой) жидкого воздуха. В лабораторных условиях азот можно получить разложением нитрита аммония: NH4NO2 = N2 + 2 Н2O. Так как нитрит аммония очень неустойчив, удобнее для получения азота нагревать смесь концентрированных растворов нитрита калия или натрия и хлорида аммония: NH4Cl + NaNO2 = NaCl + N2 + 2 Н2O. Для получения азота в лабораторных условиях можно использовать также разложение аммиака над оксидом меди: 3 CuO + 2 NН3 = 3 Cu + N2 + 3 Н2O. В свободном состоянии выделяется азот также при сжигании азотсодержащих органических веществ. Применение. Основная масса получаемого в промышленности азота используется для производства аммиака и цианамида кальция. Для получения цианамида в специальных печах нагревают карбид кальция а атмосфере азота: СаС2 + N2 = CаCN2 + С. Азотом наполняют электролампы (создание инертной среды). Значительные количества азота используются в лабораторной практике для создания инертной атмосферы и как газ носитель в газовой хроматографии. Аммиак. Бесцветный газ, с резким характерным запахом. При охлаждении до -33,6 °С он сжижается, а при температуре -77,8 °С затвердевает. Повышая давление, аммиак легко перевести в жидкое состояние даже при комнатной температуре. В 1 объеме воды растворяется около 700 объемов аммиака. В концентрированном растворе содержится 25% аммиака, плотность такого раствора составляет 0,91 г/см3. Раствор аммиака в воде называется аммиачной водой или нашатырным спиртом. При растворении аммиака в воде происходит образование гидроксида аммония: NH4OH NH4OH При нагревании растворимость аммиака резко уменьшается и он улетучивается из раствора. Аммиак хорошо горит в атмосфере кислорода, хуже — на воздухе, образуя в отсутствие катализатору азот и воду, а и присутствии платинового катализатора — монооксид азота и воду: 4 NH3 + 3 O2 = 2 N2 + 6 H2O, 4 NH3 + 5 O2 = 4 NO + 6 H2O. При высокой температуре аммиак может взаимодействовать с металлами, образуя нитриды и свободный водород: 2 Al + 2 NH3 = 2 AlN + 3 Н2. Гидроксид аммония обладает всеми свойствами оснований. Он взаимодействует с кислотами и кислотными оксидами: NН3∙Н2O + H2SO4 = NH4HSO4 + Н2О, NН3∙Н2O + NH4HSO4 = (NH4)2SO4 + H2O, 2 NН3∙Н2O + CO2 = (NH4)2CO3 + H2O. Аммиак легко взаимодействует с кислотами, образуя аммонийные соли: NН3 + HCl = NH4Cl. При нагревании аммонийные соли, кроме NH4NO3 и NH4NO2, разлагаются на аммиак и кислоту, которые, охлаждаясь, образуют исходную соль. В лабораторных условиях аммиак получают действием на соли аммония щелочью при нагревании: NН4Cl + КОН = KCl + NH3 + H2O. В промышленности аммиак получают синтезом из водорода и азота: N2 + 3 Н2 Катализатором этой реакции служит железо с добавками оксидов алюминия и калия. Процесс протекает при температуре 500-550 °С и давлении 200-800 атм. В некоторых установках применяется давление до 1000 атм. Аммиак образуется также как побочный продукт при коксовании углей. До разработки метода синтеза аммиака из азота в водорода его получал так называемым цианамидным методом: из карбида кальция CaC2 получали цианамид кальция CaCN2, который затем обрабатывали водяным паром: CaC2 + N2 = CaCN2 + С, CaCN2 + 3 H2O = СаСО3 + 2 NH3. Большое количество вырабатываемого в промышленности аммиака применяется для получения азотной кислоты и азотных удобрений. Аммиак используется как холодильный агент в холодильных установках, лабораторной практике и медицине (нашатырный спирт — 10%-ный водный раствор аммиака). Оксиды азота. Азот образует несколько оксидов: гемиоксид азота N2O, монооксид азота NO, азотистый ангидрид, или сесквиоксид азота N2O3, диоксид азота NO2 и азотный ангидрид или гемипентаоксид азота N2O5. Гемиоксид и монооксид азота — несолеобразующие оксиды, остальные — солеобразующие. Гемиоксид азота N2O — газ без цвета и запаха. При -89 °С он переходит в жидкое состояние, а при -91 °С затвердевает. В 1 объеме воды растворяется 1,3 объема гемиоксида азота при 0 °С и 0,6 объема при 25 °С. Гемиоксид азота очень неустойчив и легко разлагается на кислород и азот: 2 N2O = 2 N2 + О2. Так как образовавшаяся смесь значительно богаче кислородом, чем воздух, то все вещества горят в ней как в кислороде; а тлеющая лучина вспыхивает. Гемиоксида азота получают термическим разложением нитрата аммония: NH4NO3 = N2O + 2 Н2O. Эта реакция протекает спокойно при температуре до 300 °С, при более высокой температуре может произойти взрыв. Гемиоксид а
|
||
|
Последнее изменение этой страницы: 2021-04-05; просмотров: 120; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.2 (0.042 с.) |

 2 СО,
2 СО, СH3ОН.
СH3ОН.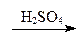 Н2О + СО,
Н2О + СО, 2 NO.
2 NO.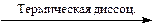 NH3 + H2O,
NH3 + H2O,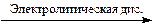 NH4+ + OH-.
NH4+ + OH-.


