Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Серный ангидрид и серная кислота
Серный ангидрид, или триоксид серы SO3. Представляет собой бесцветную жидкость с температурой кипения 45 °С, превращающуюся при температуре ниже 17 °С в белую кристаллическую массу. Крайне гигроскопичен. Соединяясь с водой, образует серную кислоту: SO3 + Н2О = H2SO4. При растворении серного ангидрида в воде выделяется большое количество теплоты и, если прибавить к воде большое количество серного ангидрида сразу, может произойти взрыв. Серный ангидрид хорошо растворяется в концентрированной серной кислоте, образуя олеум. Содержание серного ангидрида в олеуме достигает 60%. Серный ангидрид обладает всеми свойствами кислотного оксида. Как промежуточный продукт он применяется в производстве серной кислоты, как самостоятельный — при получении органических сульфосоединений. Серная кислота H2SO4. Безводная серная кислота — тяжелая маслянистая бесцветная жидкость, затвердевающая при 10,4 °С. Очень гигроскопична. При нагревании 100%-ной серной кислоты выше 200 °С она частично разлагается, выделяя серный ангидрид. Раствор, содержащий 98,3% серной кислоты и имеющий плотность 1,841 г/см3, кипит и перегоняется без разделения при 336,5 °С. Такие растворы называются азеотропными смесями. Серная кислота поглощает влагу, выделяя огромное количество теплоты. Поэтому нельзя приливать воду к кислоте, так как это может привести к разбрызгиванию раствора и даже к взрыву. Следует приливать кислоту к воде небольшими порциями, помешивая раствор. Разбавленная серная кислота проявляет все характерные свойства сильных кислот. Она реагирует с основными оксидами, гидроксидами и солями, в ней растворяются металлы, расположенные в ряду напряжений левее водорода. При растворении металлов в разбавленной серной кислоте образуются сульфаты металлов и выделяется водород: Zn + H2SO4(разб.) = ZnSO4 + Н2. При растворении железа, олова и других металлов, проявляющих несколько степеней окисления, образуются сульфаты металлов с низшей степенью окисления. Например: Fe + H2SO4(разб.) = FeSO4 + H2, Sn + H2SO4(разб.) = SnSO4 + Н2. Концентрированная серная кислота по химическим свойствам резко отличается от разбавленной. Она почти не диссоциирует, без нагревания не взаимодействует с железом (пассивирует его), что позволяет транспортировать и хранить ее в стальных цистернах.
Концентрированная серная кислота обладает сильными окислительными свойствами. Она окисляет некоторые металлы, расположенные в ряду напряжений после водорода, (например, медь, серебро, ртуть), и многие неметаллы (например, углерод, серу, фосфор). При этом выделяется не водород, а продукты восстановления серы(VI): SO2, S или H2S. Степень окисления этих продуктов зависит как от концентрации серной кислоты, так и от активности восстановителя; чем сильнее восстановитель, тем глубже процесс восстановления. Так, металлы, расположенные в ряду напряжений после водорода в непосредственной близости от него, восстанавливают концентрированную серную кислоту до SO2 : Hg + 2 H2SO4 = HgSO4 + SO2¯ + 2 H2O. При растворении свинца в горячей концентрированное серной кислоте образуется кислая соль: Pb + 3 H2SO4 = Pb(HSO4)2 + SO2 + 2 H2O. Железо окисляется горячей концентрированней серной кислотой до степени окисления +3: 2 Fe + 6 H2SO4 = Fe2(SO4)3 + 3 SO2 + 6 Н2O. Более активными металлами (Mg, Al, Zn) концентрированная серная кислота (с концентрацией 25% и выше) восстанавливается до свободной серы и сероводорода: Zn + 2 H2SO4(конц.) = ZnSO4 + SO2 + 2 H2O, 3 Zn + 4 H2SO4(разб.) = 3 ZnSO4 + S¯ + 4 Н2О, 4 Mg + 5 H2SO4(очень paзб.) = 4 MgSO4 + H2S + 4 H2O. Концентрированная серная кислота очень активно взаимодействует с неметаллами. Реакцию растворения углерода в горячей концентрированной серной кислоте можно представить уравнением С + 2 H2SO4 = СО2 + 2 SO2 + 2 Н2О. При окислении серы горячей концентрированной серной кислотой в качестве продукта окисления и продукта восстановления образуется диоксид серы: S + 2 H2SO4 = 3 SO2 + 2 Н2O. Концентрированная серная кислота окисляет бромид- и иодид-ионы до свободных брома и иода: 2 KBr + 2 H2SO4 = K2SO4 + SO2 + Вr2 + 2 Н2O, 2 KI + 2 H2SO4 = K2SO4 + SO2 + I2 + 2 H2O. Поэтому HBr и HI нельзя получить по реакции двойною обмена. Концентрированная серная кислота не может окислить хлорид-ионы до свободного хлора, что дает возможность получать HCl по реакции двойного обмена: NaCl + Н2SO4(конц.) = NaHSO4 + HCl. Серная кислота отнимает воду у многих органических соединений, содержащих водород и кислород (углеводы, клетчатка и др.), обугливая их. Серная кислота двухосновная, поэтому образует средние (сульфаты) и кислые (гидросульфаты) соли.
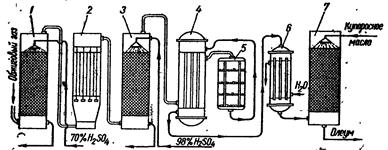
Сульфаты свинца PbSO4 и кальция CaSO4 (средние соли) слаборастворимы, а сульфат бария BaSO4 и стронция SrSO4 практически нерастворимы в воде и кислотах. Получение и применение серной кислоты. Существуют два промышленных способа получения серной кислоты: контактный и нитрозный. При контактном способе получения серной кислота сульфидную руду (чаще всего железный колчедан FeS2) обжигают в специальных колчеданных печах. При этом получается обжиговый газ, содержащий приблизительно 9% сернистого ангидрида. Перед тем как произвести окисление сернистого газа в серный ангидрид, обжиговый газ очищают от целого ряда примесей, которые могут затруднить и даже сделать невозможным последующее окисление. Одной из таких примесей является пыль, которая может отравить катализатор. Очистка от пыли производится в специальных устройствах — циклон-аппаратах и электрофильтрах. Схема дальнейшей переработки обжигового газа приведена на рис. 12.1. Обжиговый газ проходит башню 1, в которую подают 70%-ный раствор серной кислоты (орошают серной кислотой) противотоком, т. е. навстречу поступающему газу. В этой башне обжиговый газ охлаждается и очищается от остатков пыли.
Рис. 12.1. Схема контактного способа производства серной кислоты; 1 — охладительная башня; 2 — электрофильтр; 3 — осушительная башня; 4 — теплообменник; 5 -контактный аппарат; 6 — холодильник; 7 — поглотительная башня. Кроме сернистого ангидрида, в обжиговом газе всегда присутствуют As2O5, небольшое количество серного ангидрида SO3 и водяные пары, отравляющие применяемые катализаторы. Водяные пары не являются каталитическим ядом, но снижают активность катализатора и приводят к потере серной кислоты из-за образованием туманообразной серной кислоты, которая может реагировать с веществами контактной массы и понижать ее активность). Кроме того, туманообразная серная кислота очень плохо растворяется в концентрированной серной кислоте и поэтому в башне 7 не задерживается и вместе с выхлопными газами может уйти в атмосферу. Очистка обжигового газа от As2O5 и гуманобразной серной кислоты осуществляется в электрофильтре 2. В башне 3, которая орошается концентрированной серной кислотой, обжиговый газ высушивается, после чего поступает в контактный аппарат 5. Растворы кислот после орошения в поглотительных башнях 1 и 3 охлаждаются и вновь подаются на орошение. В контактном аппарате производится окисление сернистого ангидрида в серный. Эта реакция является экзотермической. Однако образующийся серный ангидрид термически малоустойчив и при высокой температуре может снова разлагаться на кислород и сернистый газ: 2 SO2 + O2 При низкой температуре окисление идет очень медленно и значительная часть сернистого газа, проходя через контактный аппарат, не успевает окислиться. Поэтому, чтобы достигнуть максимальной степени окисления сернистого газа и в то же время избежать разложения серного ангидрида, скорость газа регулируют таким образом, чтобы температура в контактном аппарате поддерживалась в пределах 470-490 °С. Это достигается с помощью теплообменника 4, в котором обжиговый газ нагревается газами, выходящими из контактного аппарата. В теплообменнике газ нагревается до температуры около 450 °С а выходящие газа охлаждаются до температуры около 200 °С.
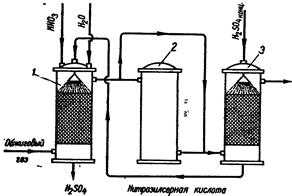
В контактом аппарате 5, на полках помещается катализатор V2O5 с различными добавками — контактная масса, на поверхности которой происходит окисление сернистого газа. Выходящий ее теплообменника 4 газ дополнительно охлаждается водой в холодильнике 6 и поступает в башню 7, которая орошается концентрированной серной кислотой (купоросным маслом). В промышленной установке таких башен может быть несколько. Серный ангидрид растворяется в концентрированной серной кислоте, образуя олеум — раствор SO3 в безводной серной кислоте. Полученный олеум транспортируют в стальных цистернах к месту потребления, где из него, разбавлением водой, получают серную кислоту нужной концентрации. При нитрозном способе получения серной кислоты окисление сернистого газа осуществляется оксидами азота. Схема процесса показана на рис. 12.2. Обжиговый газ подается в продукционную башню 1, орошаемую нитрозилсерной кислотой NOHSO4. Для запуска процесса сернистую кислоту окисляют азотной кислотой согласно уравнениям: SO2 + H2O = H2SO3, 3 Н2SО3 + 2 HNO3 = 3 H2SO4 + 2 NO + Н2О.
Рис. 12.2. Схема нитрозного способа получения серной кислоты: 1 — продукционная башня; 2 — окислительная башня; 3 — поглотительная башня. Оксиды азота вместе с выхлопными газами (азот и кислород) подаются в башню 2 для окисления монооксида азота в диоксид. Поток газа регулируют таким образом, чтобы 50% газа проходило через окислительную башню 2, а 50% — миновало ее. Таким образом, в поглотительную башню 3 попадает газовая смесь, содержащая монооксид и диоксид азота в эквимолярном соотношении, вследствие чего образуется азотистый ангидрид: NO + NO2 При низкой температуре равновесие сдвигается в сторону образования азотистого ангидрида N2O3, а при повышении температуры — в сторону образования монооксида и диоксида азота. В поглотительное башне 3 азотистый ангидрид реагирует с концентрированной серной кислотой, образуя нитрозилсерную кислоту: N2O3 + 2 Н2SO4 Эта реакция может протекать только с концентрированной серной кислотой. При разбавлении водой нитрозилсерная кислота вновь разлагается на серную кислоту и оксиды азота. Нитрозилсерная кислота подается на орошение в продукционную башню 1, где и разлагается водой, а выделившийся азотистый ангидрид окисляет образующуюся в башне 1 сернистую кислоту:
2 NOHSO4 + Н2О = 2 H2SO4 + N2O3, SO2 + H2O = H2SO4, H2SO4 + N2O3 = H2SO4 + 2 NO. Монооксид азота вновь направляется в окислительную башню 2 и процесс повторяется. Промышленные установки имеют, как правило, 2-3 продукционные и 2-3 поглотительные башни. Оксиды азота, которые не поглотились серной кислотой, улавливаются в санитарной башне (на схеме не показана) в которую подают либо раствор соды Na2CO3, либо раствор извести Ca(OH)2: N2O3 + Na2CO3 = 2 NaNO2 + CO2, 2 NO2 + Na2CO3 = NaNO3 + NaNO2 + CO2, N2O3 + Ca(ОН)2 = Ca(NO2)2 + H2O, 4 NO2 + 2 Ca(ОН)2 = Ca(NO3)2 + Ca(NO2)2 + 2 H2O. Потеря оксидов азота компенсируется введением новых порций азотной кислоты. Концентрация серной кислоты, получаемой нитрозным способом, достигает 70-80%. Серная кислота находит самое широкое применение. Она используется для получения соляной, азотной, фосфорной, плавиковой и многих органических кислот методом обмена, в производстве фосфорных в азотных удобрений, органических сульфосоединений, для очистки различных газов, входит в состав нитрующих смесей, используется в производстве красителей, для зарядки аккумуляторов и др. Широко применяются соли серной кислоты. Сульфат натрия (глауберова соль) Na2SO4∙10Н2О применяется для производства соды и в стекольной промышленности. Сульфат кальция распространен в природе в виде двуводного кристаллогидрата гипса CaSO4∙2H2O и безводной соли ангидрита CaSO4. При нагревании природный гипс теряет значительную часть воды и переходит в полуводный гипс 2CaSO4∙Н2О или СаSО4∙1/2H2O, называемый алебастром. Наиболее интенсивная потеря воды происходит при 120-190 °С. Алебастр энергично присоединяет воду и при этом затвердевает. Это свойство используется в строительной технике. В зависимости от условий термической обработки можно получить полуводный гипс в виде d- и b -модификаций, различающихся физико-химическими свойствами. b-Модификация образуется при нагревании двуводного гипса при нормальном давлении, а d-модификация — при его нагревании под давлением около — 130 кПа. Затвердевая, d-модификация гипса требует меньшего количества воды, а изделия из нее более прочны, чем из b-модификации. Ангидритовые вяжущие материалы получают путем обжига гипсового камня при повышенных температурах (600-700 °С) с различными добавками. При этом получают отделочный гипсовый цемент и кальцинированный гипс (экстрих-гипс). Эти материалы затвердевают значительно медленнее, чем полуводный гипс, и применяются для изготовления строительных растворов и бетонов малой прочности, а также искусственного мрамора, бесшовных настилов полов и др. Сульфат магния, или горькая соль, MgSO4∙7Н2О применяется в медицине как слабительное. Сульфат железа(II), или железный купорос, FeSO4∙7Н2O применяется, для приготовления желтой кровяной соли K4[Fe(CN)6], чернил, для очистки воды и консервирования дерева. Сульфат меди, или медный купорос, CuSO4∙5Н2O применяется для борьбы с различными грибками — вредителями сельского хозяйства, для производства медных покрытий и получения различных соединений меди.
Из растворов, содержащих сульфат трехвалентного металла (Fe3+, Al3+, Сr3+) и сульфат одновалентною металла (К+, NH4+, Rb+) выкристаллизовываются двойные соли типа K2SO4∙Al2(SO4)3∙24Н2O или KAl(SО4)2∙12Н2О. Вместо калия и алюминия могут стоять в любом сочетании перечисленные элементы. Эти соединения называются квасцами. Квасцы существуют только в твердом виде. В растворе они ведут себя как две самостоятельные соли, т. е. как смесь сульфатов трехвалентных металлов. § 7.12.4. Хром Хром был открыт Л. Н. Вокленом в 1797 г. Нахождение в природе. Природные соединения хрома: хромистый железняк FeO∙Сr2О3 и свинцовая красная руда PbCrO4. Большие залежи хромовых руд встречаются на Урале. Физические свойства. Хром — белый блестящий металл, отличающийся твердостью и хрупкостью, с плотностью 7,2 г/см3, температурой плавления 1903 °С и температурой кипения около 2570 °С. На воздухе поверхность хрома покрывается оксидной пленкой, которая предохраняет его от дальнейшего окисления. Добавка углерода и хрому еще больше увеличивает его твердость. Химические свойства. Хром на холоду очень инертен. При нагревании он взаимодействует в кислородом, галогенами, азотом, углеродом, серой: 4 Cr + 3 O2 = 2 Cr2O3 (оксид хрома(III)), 2 Cr + 3 Сl2 = 2 СrСl3 (хлорид хрома(III)), 2 Cr + 3 S = Cr2 S3 (сульфид хрома(III)), 2 Cr + N2 = 2 CrN (нитрид хрома(III)). Сульфид хрома может существовать только в сухом виде. При контакте с водой, даже с ее парами, он полностью гидролизуется: Cr2S3 + 6 H2O = 2 Cr(OH)3 + 3 H2S. При нагревании хром растворяется в соляной и серной кислотах: Cr + H2SO4 = CrSO4 + Н2, Cr + 2 HCl = CrCl2 + Н2. Соединения хрома(II) неустойчивы и легко окисляются до соединений хрома(III): 4 СrСl2 + О2 + 4 HCl = 4 СrСl3 + 2 Н2O B азотной кислоте и царской водке на холоду хром не растворяется, а при кипячении растворяется очень слабо, т.к. азотная кислота его пассивирует. Хром пассивируется и другими сильными окислителями. Получение. В промышленности получают чистый хром и его сплав с железом (феррохром). Чистый хром получают восстановлением его оксида алюминием: Сr2O3 + 2 Al = 2 Cr + Аl2O3. Феррохром бывает двух видов: содержащий и не содержащий углерод. Первый получают восстановлением хромистого железняка коксом: FeO∙Сr2O3 + 4 С = Fe + 2 Cr + 4 СО, второй — восстановлением хромистого железняка алюминием: 3 FeO∙Сr2О3 + 8 Al = 3 Fe + 6 Cr + 4 Аl2O3. Применение. Хромом покрывают железные и стальные детали и инструменты, которые используются в промышленности. Хромирование деталей осуществляется электролитическим методом. Наибольшее количество хрома применяется в металлургии для получения хромистых сталей, отличающихся большой твердостью и прочностью. Они используются для изготовления инструментов, шарикоподшипников и деталей машин, несущих большую нагрузку. Добавка хрома к бронзе, латуни и другим сплавам значительно повышает их твердость. Сплав хрома с никелем и железом (нихром) обладает высоким электрическим сопротивлением и применяется для изготовления спиралей электронагревательных приборов.
|
|||||||||
|
Последнее изменение этой страницы: 2021-04-05; просмотров: 142; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.138.114.94 (0.043 с.) |
 2 SO3.
2 SO3.