
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Кислородные соединения хрома(III).Содержание книги Поиск на нашем сайте
Оксид хрома(III) Cr2О3 является амфотерным. В обычных условиях это порошок зеленого цвета. Он не растворяется в воде, очень слабо растворяется в кислотах и щелочах, а при сплавлении его со щелочами или карбонатами щелочных металлов образует растворимые в воде соли хромистой кислоты — хромиты: Сr2О3 + 2 NaOH = 2 NaCrO2 + H2O, Cr2O3 + K2CO3 = 2 KCrO2 + СО2. Оксид хрома(III) при сплавлении со щелочами в присутствии кислорода воздуха может окисляться до хроматов: 2 Cr2О3 + 8 КОН + 3 O2 = 4 К2СrО4 + 4 Н2O. В лабораторных условиях оксид хрома(III) можно получить термическим разложением дихромата аммония: (NH4)2Cr2O7 = Cr2O3 + N2 + 4 Н2O. В промышленности оксид хрома(III) получают восстановлением дихромата калия коксом или серой: 2 К2Сr2О7 + 3 С = 2 Cr2O3 + 2 K2CO3 + CO2, К2Сr2О7 + S = Cr2O3 + K2SO4. Оксид хрома(III) применяется для получения хрома, а также для изготовления масляных и акварельных красок. Хромовые краски устойчивы к действию влаги и нагреванию. Соли хрома(III) применяются в промышленности для получения хромовой кожи. При действии щелочей на растворы солей хрома(III) выпадает осадок, гидроксида хрома(III) Cr(ОН)3 серовато-голубоватого цвета. Гидроксид хрома(III) обладает амфотерными свойствами. В отличив от оксида гидроксид хрома легкорастворим как в кислотах, так и в щелочах: 2 Cr(ОН)3 + 3 Н2SО4 = Cr2(SO4)3 + 6 H2O. Cr(OH)3 + NaOH = Na[Cr(OH)4], Cr(OH)3 + 3 NaOH = Na3[Cr(OH)6], поэтому его можно осадить, только если не добавлять избытка щелочи. При нагревании гидроксид хрома(III) теряет воду, превращаясь в оксид: 2 Cr(ОН)3 = Cr2O3 + 3 Н2О. Большинство солей хрома(III) хорошо растворимо в воде и легко подвергается гидролизу. Сульфат хрома вместе с сульфатами калия, аммония, рубидия или цезия выкристаллизовывается в виде квасцов Me2SO4∙Cr2(SO4)3∙24Н2О или MeCr(SO4 )2∙12Н2O, где Me — катион калия, аммония, рубидия или цезия. Хромовый ангидрид и хромовые кислоты — соединения, в которых хром содержится в высшем валентном состоянии: +6. Триоксид хрома СrО3 — кислотный оксид, который взаимодействует с водой, основными оксидами и основаниями: СrО3 + Н2О = Н2СrО4, 2 СrО3 + Н2О = Н2Сr2O7, СrО3 + CaO = СаСrО4, СrО3 + 2 КОН = K2CrO4 + Н2O. Хромовый ангидрид может образовывать как хромовую, так в дихромовую кислоты и их соли. Состояние равновесия 2 CrO42 - + 2 Н+ зависит от кислотности среды в кислом растворе основная масса хрома находится в виде дихромата, а в щелочном, где концентрация ионов водорода очень мала, — в виде хромата. Хромовый ангидрид — очень сильный окислитель. Реакции его с некоторыми органическими веществами в присутствии серной кислоты протекают со взрывом: 8 СrО3 + 3 СН3СОСН3 + 12 H2SO4 = 4 Сr2(SO4)3 + 9 CO2 + 9 H2O. Хромовый ангидрид можно получить действием концентрированной серной кислоты на сухие хроматы или дихроматы: К2СrO4 + 2 H2SO4 = 2 KHSO4 + СrО3 + Н2О, K2Cr2O7 + 2 H2SO4 = 2 KHSO4 + 2 CrO3 + Н2O. Хромовый ангидрид применяется как окислитель при различных органических синтезах. Хроматы и дихроматы щелочных металлов и аммония хорошо растворимы в воде. Соли других металлов растворяются трудно. Дихромат калия К2Сr2О7 (хромпик) широко применяется как окислитель в лабораторной практике и химической технологии. Действие хроматов и дихроматов как окислителей проявляется в кислой среде K2Cr2O7 + 6 FеSO4 + 7 Н2SO4 = K2SO4 + Сr2(SO4)3 + 3 Fе2(SО4 )3 + 7 Н2O. При прибавлении раствора железного купороса к раствору дихромата калия оранжевая окраска исчезает и появляется зеленая, обусловленная образованием гидратированных ионов Сr3+. Бромиды и иодиды окисляются дихроматом калия до свободных галогенов: К2Сr2O7 + 6 KI + 7 H2SO4 = Cr2(SO4)3 + 3 I2 + 4 K2SO4 + 7 Н2О. При взаимодействии дихромата калия с иодоводородной и бромоводородной кислотами подкислять раствор не требуется, необходимую кислотность создают сами восстановители, которые являются сильными кислотами: К2Сr2O7 + 14 HBr = 2 KBr + 2 СrВr3 + 3 Вr2 + 7 Н2O. Выделяющийся иод или бром маскирует переход оранжевой окраски растворе в зеленую. В аналитической химии реакция окисления хроматом или дихроматом калия различных ионов используется для их определения. Этот метод анализа называется хроматометрией. Раствор дихромата калия в концентрированной серной кислоте называется хромовой смесью и используется в лабораторной практике для мытья посуды. Он легко удаляет жир с поверхности стекла, окисляя его образующимся хромовым ангидридом и смывая концентрированной серной кислотой. Глава 7.13. СЕДЬМАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ ЭЛЕМЕНТОВ § 7.13.1. Общая характеристика элементов VII группы Элементы, входящие в VII группу периодической системы, делятся на две подгруппы: главную — подгруппу галогенов — и побочную — подгруппу марганца. К подгруппе галогенов относятся фтор, хлор, бром, иод и астат. Первые четыре элемента встречаются в природе, последний получен искусственно и поэтому изучен значительно меньше остальных галогенов. Слово галоген означает солеобразующий, из-за легкости, с которой они со многими металлами образуют соли. Все галогены имеют структуру внешней электронной оболочки s2р5. Поэтому они легко принимают электрон, образуя устойчивую благородногазовую электронную оболочку (s2p6). Наименьший радиус атома в подгруппе — у фтора, у остальных он увеличивается в ряду F < Cl < Br < I < At и составляет соответственно 133; 181; 196; 220 и 270 пм. В таком же порядке уменьшается сродство атомов элементов и электрону. Галогены — очень активные элементы. Они могут отнимать электроны не только у атомов, которые их легко отдают, но и у ионов и даже вытеснять другие галогены, менее активные, из их соединений. Например, фтор вытесняет хлор из хлоридов, хлор — бром из бромидов, а бром — иод из иодидов. Из всех галогенов только фтор, находящийся во II периоде, не имеет незаполненного d-уровня. По этой причине он не может иметь больше одного неспаренного электрона и проявляет валентность только — 1. В атомах других галогенов d-уровень не заполнен, что дает им возможность иметь различное количество неспаренных электронов и проявлять валентность -1, +1, +3, +5 и +7, наблюдающуюся в кислородных соединениях хлора, брома и иода. К подгруппе марганца принадлежат марганец, технеций и рений. В отличие от галогенов элементы подгруппы марганца имеют на внешнем электронном уровне всего два электрона и поэтому не проявляют способности присоединять электроны, образуя отрицательно заряженные ионы. Марганец распространен в природе и широко используется в промышленности. Технеций радиоактивен, в природе не встречается, а получен искусственно (впервые — Э. Сегре и К. Перрье, 1937). Он образуется вследствие радиоактивного распада урана. Рений относится к числу рассеянных элементов. Он не образует самостоятельных минералов, а встречается в качестве спутника некоторых минералов, особенно молибденовых. Он был открыт В. и И. Ноддак в 1925 г. Сплавы, имеющие небольшие добавки рения, обладают повышенной устойчивостью против коррозии. Добавка рения к платине и ее сплавам увеличивает их механическую прочность. Это свойство рения позволяет применять его вместо благородного металла иридия. Платино-платинорениевые термопары работают лучше платино-платиноиридиевых, но их нельзя использовать при очень высоких температурах, так как образуется летучее соединение Re2O7. § 7.13.2. Фтор В свободном состоянии фтор впервые получен французским химиком А. Муассаном в 1886 г. Нахождение в природе. Из солей фтора наиболее распространен в природе флюорит (плавиковый шпат) CaF2. Фтор в виде фторида кальция входит также в состав апатита 3Са3(РO4)2∙CaF2 (или Ca5(PO4 )3F). Физические свойства. В обычных условиях фтор бесцветный, обладающий резким запахом газ, в толстых слоях он окрашен в зеленовато-желтый цвет. При -181,1 °С фтор переходит в жидкое состояние, а при -219,6 °С затвердевает. Растворимость фтора не изучена, так как он разрушает почти все растворители. Химические свойства. На внешнем электронном слое атома фтора находится 7 электронов (s2p5). Так как этот слой расположен ближе к ядру, чем у атомов хлора, брома и иода, фтор сильнее всех галогенов притягивает электроны. Этим объясняется его исключительно высокая химическая активность. Фтор не имеет d-уровня, поэтому не может иметь более одного неспаренного электрона и проявлять другие валентные состояния, кроме единицы. Фтор взаимодействует почти со всеми элементами, причем реакции протекают более энергично, чем с хлором или кислородом. На поверхности некоторых металлов (Pb, Cu, Ni, Mg) образуется плотная пленка фторида, которая препятствует дальнейшему прохождению реакции. Неметаллы в порошкообразном состоянии реагируют со фтором очень энергично, а в компактном — значительно труднее. Углерод в виде сажи сгорает в атмосфере фтора мгновенно, а графит реагирует со фтором только при высокой температуре. С кислородом и азотом фтор непосредственно не взаимодействует. Получение. Свободный фтор из-за высокой реакционной способности выделить очень непросто. Получают его в небольших количествах электролизом расплава дифторида калия KF∙HF в свинцовой аппаратуре (образовавшийся на внутренней поверхности стенок электролизера фторид свинца РbF2 предохраняет аппарат от разрушения). Применение. Свободный фтор применяют для получения фторпроизводных органических соединений, которые используются как сырье для производства фторопластов (тефлон) высокотемпературных смазочных масел и жидкостей для холодильных машин (фреонов). Фтороводород и плавиковая кислота. Фтороводород — газ с резким запахом. При 19,9 °С он переходит в жидкое состояние, а при -83,1 °С затвердевает. Жидкий фтороводород смешивается с водой в любых соотношениях. Раствор фтороводорода в воде называется плавиковой кислотой. В отличие от других галогеноводородных кислот плавиковая кислота относится к слабым кислотам. Она хорошо реагирует со многими металлами, основными оксидами, основаниями и солями. В присутствии сильных кислот в ней растворяются многие редкие металлы, которые в других кислотах не растворяются (титан, цирконий, ниобий, тантал и др.). Плавиковая кислота образует со многими металлами очень прочные комплексные фториды: H3FeF6, H2TiF6, H3AlF6. Натриевая соль Na3AlF6 даже в расплаве диссоциирует е образованием иона AlF63-. Фтороводород и плавиковая кислота реагируют с диоксидом кремния с образованием летучего соединения SiF4: SiO2 + 4 HF = SiF4 + 2 H2O. Так как в состав стекла входит значительное количество диоксида кремния, плавиковая кислота разъедает стекло, поэтому хранить ее можно в посуде, изготовленной из полимерных материалов (полиэтилена, фторопласта или эбонита), или в стеклянной, покрытой изнутри слоем парафина. Фтороводород применяется для получения фторорганических соединений, в производстве фторопластов, металлургии редких металлов, а также как травильный агент при обработке поверхности некоторых металлов. Получают фторододород действием концентрированной серной кислоты на плавиковый шпат CaF2: CaF2 + H2SO4 = CaSO4 + 2 HF. Фтороводород образуется также как побочный продукт при переработке апатитов. Кислородсодержащих кислот фтор не образует, хотя соединения фтора с кислородом известны. § 7.13.3. Хлор Хлор был открыт шведским химиком К. В. Шееле в 1774 г. Нахождение в природе. Из-за высокой активности хлор в свободном состоянии в природе не встречается. Широко известны его природные соединения — хлориды щелочных и щелочноземельных металлов, наиболее распространенными из которых являются каменная (поваренная) соль NaCl, сильвинит — смесь хлоридов калия и натрия — и карналлит КСl∙MgCl2∙6Н2О. Как примеси к названным минералам встречаются хлориды других металлов. Значительное количество хлоридов различных металлов содержится в морской воде. Физические свойства. При обычных условиях хлор — газ желто-зеленого цвета с резким запахом, ядовит. Он в 2,5 раза тяжелее воздуха. В 1 объеме воды при 20 °С растворяется около 2 объемов хлора, такой раствор называется хлорной водой. При атмосферном давлении хлор при -34 °С переходит в жидкое состояние, а при -101 °С затвердевает. При комнатной температуре он переходит в жидкое состояние только при давлении 6 атм. Хлор хорошо растворим во многих органических растворителях, особенно в тетрахлориде углерода, с которым не взаимодействует. Химические свойства. На внешнем электронном уровне атома хлора находятся 7 электронов (s2p5), поэтому он легко присоединяет электрон, образуя анион Cl-. Благодаря наличию незаполненного d-уровня в атоме хлора могут появляться 1, 3, 5 и 7 неспаренных электронов, поэтому в кислородсодержащих соединениях он может иметь степень окисления +1, +3, +5 и +7. В отсутствие влаги хлор довольно инертен, но в присутствии даже следов влаги активность его резко возрастает. Он хорошо взаимодействует с металлами: 2 Fe + 3 Сl2 = 2 FeCl3 (хлорид железа(III)), Cu + Cl2 = CuCl2 (хлорид меди(II)). и многими неметаллами: Н2 + Cl2 = 2 HCl (хлороводород), 2 S + Cl2 = S2Cl2 (хлорид серы(I)), Si + 2 Cl2 = SiCl4 (хлорид кремния(IV)), 2 Р + 5 Сl2 = 2 PCl5 (хлорид фосфора(V)). С кислородом, углеродом и азотом хлор в непосредственное взаимодействие не вступает. При растворении хлора в воде образуется две кислоты: хлороводородная, или соляная, и хлорноватистая: Сl2 + Н2О При взаимодействии хлора с холодными растворами щелочей образуются соответствующие соли этих кислот. Сl2 + 2 КОН = KCl + КСlO + Н2О, Сl2 + 2 NaOH = NaCl + NaClO + Н2O. Полученные растворы называются жавелевой водой, которая, как и хлорная вода, обладает сильными окислительными свойствами благодаря наличию иона ClO- и применяется для отбеливания тканей и бумаги. С горячими растворами щелочей хлор образует соответствующие соли соляной и хлорноватой кислот: 3 Сl2 + 6 NaOH = 5 NaCl + NaClO3 + 3 Н2О, 3 Сl2 + 6 КОН = 5 KCl + KClO3 + 3 Н2О. Образовавшийся хлорат калия называется бертолетовой солью. Хлор — сильный окислитель, поэтому легко взаимодействует со сложными веществами, в состав которых входят элементы, способные окисляться до более высокого валентного состояния: 2 FeCl2 + Сl2 = 2 FеСl3, H2SO3 + Cl2 + Н2О = H2SO4 + 2 HCl. Получение. В лабораторных условиях хлор получают действием концентрированной соляной кислоты на различные окислители, например диоксид марганца (при нагревании), перманганат калия или бертолетову соль: МnО2 + 4 HCl = MnCl2 + Cl2 + 2 Н2O, 2 КМnО4 + 16 HCl = 2 KCl + 2 МnСl2 + 5 Сl2 + 8 Н2O, KClO3 + 6 HCl = KCl + 3 Сl2 + 3 Н2O. В промышленности хлор получают электролизом растворов или расплавов хлоридов щелочных металлов. При электролизе расплава хлорида щелочного металла на катоде выделяется щелочной металл, а на аноде — хлор: 2 NaCl 2 Na+ + 2 е- = 2 Na, 2 Cl- - 2 е- = Сl2. В растворе хлорид щелочного металла диссоциирует на ионы: NaCl Вода как слабый электролит также диссоциирует на ионы: Н2O При пропускании электрического тока через такой раствор на катоде из двух катионов — Na+ и H+ — разряжается катион менее активного водорода, а на аноде из двух анионов — ОН- и Cl- — хлорид-ион: 2 Н+ + 2е- = Н2, 2 Cl- - 2е- = Cl2, 2 NaCl + 2 H2O По мере протекания электролиза в катодном пространстве накапливаются ионы ОН- и образуется едкий натр. Так как хлор может реагировать со щелочью, катодное и анодное пространства разделяют полупроницаемой диафрагмой из асбеста. Применение. Ежегодное мировое потребление хлора превышает 1 млн. т. Он используется для отбеливания бумаги и тканей, обеззараживания питьевой воды, производства различных ядохимикатов, соляной кислоты, хлорорганических веществ и растворителей, а также в лабораторной практике. Хлороводород и соляная кислота. Хлороводород — бесцветней газ с резким, удушливым запахом. При атмосферном давлении и температуре -84 °С он переходит в жидкое состояние, а при -112 °С затвердевает. Хлороводород в 1,26 раза тяжелее воздуха. В 1 л воды при 0 °С растворяется около 500 л хлороводорода. Сухой хлороводород довольно инертный и не реагирует даже с активными металлами, а в присутствии следов влаги такая реакция протекает довольно энергично. Хлороводород может присоединяться к непредельным углеводородам по месту двойной или тройной связи, образуя хлорорганические соединения. В лабораторных условиях хлороводород получают действием концентрированной серной кислоты на сухой хлорид натрия NaCl + H2SO4 = NaHSO4 + HCl, 2 NaCl + Н2SO4 = Na2SO4 + 2 HCl. Первая из этих реакций протекает при слабом нагревании, а вторая — при более высокой температуре. Получать хлороводород в лаборатории лучше по первому уравнению и серной кислоты следует брать столько, сколько требуется для образования гидросульфата натрия. В промышленности хлороводород получают действием концентрированной серной кислоты на сухой хлорид натрия при высокой температуре (по второму уравнению), а также сжиганием водорода в атмосфере хлора. H2 + Cl2 = 2 HCl. Раствор хлороводорода в воде называется соляной кислотой. Это сильная кислота, она реагирует со всеми металлами, стоящими в ряду напряжений левее водорода, с основными и амфотерными оксидами, основаниями и солями. Fe + 2 HCl = FeCl2 + H2, CuO + 2 HCl = CuCl2 + H2O, ZnO + 2 HCl = ZnCl2 + H2O, Fe(OH)3 + 3 HCl = FeCl3 + 3 H2O, AgNO3 + HCl = AgCl¯ + HNO3, Na2CO3 + 2 HCl = 2 NaCl + Н2О + CO2. Кроме свойств, присущих сильным кислотам, эта кислота характеризуется также восстановительными свойствами: концентрированная соляная кислота реагирует с различными сильными окислителями с образованием свободного хлора. Большинство хлоридов хорошо растворяются в воде и полностью диссоциируют на ионы. Слаборастворимыми являются хлорид свинца PbCl2, хлорид серебра AgCl, хлорид ртути(I) Hg2Cl2 (каломель) и хлорид меди(I) CuCl. Соляную кислоту получают растворением хлороводорода в воде. Этот процесс осуществляют в специальных поглотительных башнях, в которых жидкость подается сверху вниз, а газ — снизу вверх (принцип противотока). В такой башне свежие порции воды в верхней части башни встречаются с газовым потоком, содержащим уже мало хлороводорода, а газ с высоким содержанием хлороводорода в нижней части башни встречается с концентрированной соляной кислотой. Так как растворимость газа в жидкости прямо пропорциональна концентрации его в газовой фазе и обратно пропорциональна концентрации его в растворе, при этом методе достигается полное извлечение хлороводорода из газа и получение концентрированного раствора соляной кислоты. Насыщенный при комнатой температуре водный раствор хлороводорода может содержать не более 42% хлороводорода и его плотность не превышает 1,20 г/cм3. Поступающая в продажу соляная кислота содержит 36-37% хлороводорода и имеет плотность 1,19 г/см3. Соляную кислоту хранят и транспортируют в стальных цистернах, покрытых изнутри кислотоупорной резиной, или в стеклянных баллонах. Хлороводород, соляная кислота и ее соли широко используют в промышленности и лабораторной практике. Хлороводород применяют в органическом синтезе для получения хлорорганических соединений. Соляную кислоту используют для получения солей, травления металлов, а также как реактив в химических лабораториях. Из солей соляной кислоты наибольшее применение находят: каменная, или поваренная, соль NaCl. Она используется как сырье для получения хлора, металлического натрия, едкого натра, хлороводорода и соды, а также в пищевой промышленности; хлорид калия KCl применяется как калийное удобрение, а также как сырье для получения других солей калия и едкого кали; хлорид кальция CaCl2. Безводная соль применяется для высушивания газов и многих органических жидкостей и как осушительный агент в эксикаторах. При этом образуется кристаллогидрат CaCl2∙nH2O (n = 2-6). Насыщенный водный раствор хлорида кальция используют для обогащения сырья флотационным методом; хлорид бария ВаСl2 применяется как ядохимикат в сельском хозяйстве; хлорид цинка ZnCl2 используется при пайке для снятия пленки оксидов (травление металла), а также для пропитки деревянных предметов с целью предохранения их от гниения при закапывании в землю.
|
||||
|
Последнее изменение этой страницы: 2021-04-05; просмотров: 142; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.41 (0.011 с.) |

 2 HCrO7-
2 HCrO7-  2 Na + Cl2,
2 Na + Cl2,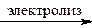 2 NaOH + Cl2 + H2.
2 NaOH + Cl2 + H2.


