
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Глава 7.1 1. Пятая группа периодической системы
§ 7.11.1. Общая характеристика элементов V группы.................. 32 § 7.11.2. Азот...................................................................................... 34 § 7.11.3. Азотный ангидрид и азотная кислота.............................. 41 § 7.11.4. Фосфор................................................................................. 47 § 7.11.5. Фосфорный ангидрид и фосфорные кислоты................. 51 Глава 7.1 2. Шестая группа периодической системы § 7.12.1. Общая характеристика элементов VI группы................. 56 § 7.12.2. Сера...................................................................................... 58 § 7.12.3. Серный ангидрид и серная кислота................................. 65 § 7.12.4. Хром..................................................................................... 74 Глава 7.13. Седьмая группа периодической сис темы § 7.13.1. Общая характеристика элементов VII группы............... 79 § 7.13.2. Фтор..................................................................................... 81 § 7.13.3. Хлор..................................................................................... 83 § 7.13.4. Кислородные соединения хлора....................................... 89 § 7.13.5. Бром...................................................................................... 92 § 7.13.6. Иод....................................................................................... 96 § 7.13.7. Марганец............................................................................. 98 Глава 7.14. Вось мая группа периодической системы § 7.14.1. Общая характеристика элементов VIII группы............ 104 § 7.14.2. Железо................................................................................ 107 § 7.14.3. Производство чугуна и стали.......................................... 110 Глава 7.15. Металлы § 7.15.1. Общие свойства металлов............................................... 117 Глава 7.10. ЧЕТВЕРТАЯ ГРУППА ПЕРИОДИЧЕСКОЙ СИСТЕМЫ ЭЛЕМЕНТОВ § 7.10.1. Общая характеристика элементов IV группы IV группа состоит из двух подгрупп: подгруппа А или главная подгруппа включает углерод, кремний и подгруппу германия: германий, олово и свинец, и подгруппа Б или побочная подгруппа титана: титан, цирконий и гафний. На внешнем электронном уровне у элементов главной подгруппы находится четыре электрона (s2р2), поэтому они могут присоединять по четыре электрона и образовывать восьмиэлектронную оболочку или за счет перехода s-электрона на р-орбиталь образовывать четыре неспаренных электрона. По этой причине для углерода и кремния наиболее характерными степенями окисления является +4 или -4. Для германия более характерны и более устойчивы соединения со степенью окисления +4, а для свинца — со степенью окисления +2. Олово занимает промежуточное положение.
У элементов подгруппы титана заполняется d-уровень, поэтому они называются переходными или d-элементами. На внешнем электронном уровне их атомов также находится по четыре электрона (d2s2). Однако атомы титана, циркония и гафния не могут присоединять электроны и поэтому не образуют соединений с отрицательной степенью окисления. Как и в побочной подгруппе V группы (подгруппе ванадия), в подгруппе титана наблюдается увеличение устойчивости соединений с максимальной степенью окисления: титан образует соединения со степенью окисления +3, а для циркония и гафния такие соединения не известны. Элементы подгруппы германия по свойствам отличаются от первых двух элементов IV группы — углерода и кремния: углерод и кремний — типичные неметаллы, а в подгруппе германия при переходе от германия к свинцу наблюдается нарастание металлических свойств. Германий был открыт немецким химиком К. Винклером в 1886 г. Содержание его в земной коре составляет 1,4∙10-3%. Длительное время он не находил практического применения, сейчас он является одним из основных полупроводников. Электропроводность германия сильно зависит от температуры и чистоты вещества. В качестве полупроводника может быть использован только германий в котором сумма примесей не превышает 10-6%. Олово и свинец широко применяются в промышленности. Титан был открыт У. Грегором в 1791 г. Содержание его в земной коре составляет 0,45%. Титан используют в основном для получения сталей. Его добавка увеличивает прочность и ковкость стали, а также прочность медных сплавов. Титан завоевывает все большее признание как заменитель сталей. Раньше титан считали хрупким металлом, но хрупкость ему придают примеси оксида и нитрида титана, образующиеся при его переплавке на воздухе. Титан, переплавленный в вакууме, очень пластичен и по прочности не уступает некоторым сортам стали. Легкий (почти в 1,5 раза легче стали) и стойкий к действию кислорода воздуха (благодаря защитной оксидной пленке) титан может конкурировать со сталью в таких отраслях промышленности, как самолето-, судо- и моторостроение. Титан применяется также в оптике; стекло, покрытое тонким слоем металла, отличается большим коэффициентом светопреломления. Диоксид титана находит применение в производстве минеральных красок (титановые белила), а также глазурей в фарфоровой и фаянсовой промышленности. Соли титана(III) применяются в лабораторной практике в качестве восстановителей.
Металлический цирконий впервые был получен Й. Я. Берцелиусом в 1824 г. (диоксид циркония открыл М. Г. Клапрот в 1789 г.). Содержание его в земной коре составляет 0,017%. Применяется в металлургии добавка циркония увеличивает твердость и пластичность стали, делает более устойчивым к действию морской воды алюминий. Металлический цирконий применяется также в качестве конструкционного материала в ядерной технике. Диоксид циркония отличается очень высокой температурой плавления и устойчивостью к агрессивным средам при высоких температурах. Поэтому он применяется для изготовления огнеупоров. Карбид циркония очень тверд и используется для резания стекла и изготовлении шлифовальных порошков. Гафний был открыт Д. Хевеши и Д. Костером в 1922 г. Содержание его в земной коре составляет 10-4%. Гафний является постоянным спутником циркония и отделить его от последнего весьма трудно. Гафний применяют в рентгеноспектрографии для изготовления телескопов. § 7.10.2. Углерод Углерод относится к числу элементов, известных человечеству с давних времен. Нахождение в природе. Углерод находится в природе как в свободном состоянии, так и в соединениях. Содержание его в земной коре 0,02%. В свободном кристаллическом состоянии углерод встречается в виде двух аллотропных видоизменений: алмаза и графита. Алмаз встречается очень редко в виде отдельных кристаллов. Графит образует мощные залежи. Термическим разложением органических соединений можно получить различные формы черного углерода. Раньше его считали особой аморфной модификацией, но теперь доказано, что он имеет кристаллическую решетку такого же типа, как графит. Искусственно получены — карбин, молекулы которого имеют линейное строение и фуллерены, объемные структуры напоминающие мячи. В связанном состоянии углерод встречается в карбонатах, основными минералами которых являются кальцит СаСО3, входящий в состав известняка, мела и мрамора, магнезит МgСО3, доломит СаСО3∙МgСО3, железный шпат или сидерит FеСО3 и малахит СuСО3∙Cu(ОН)2. Кроме того, углерод — основная составная часть каменных и других углей, нефти, горючих природных газов и всех живых организмов. Физические свойства. Аллотропические видоизменения углерода резко отличаются друг от друга. Алмаз — прозрачное вещество, самое твердое из всех природных веществ. Он служит эталоном твердости, которая оценивается по десятибалльной системе числом 10, такая твердость алмаза обусловлена особой структурой его кристаллической решетки. Алмаз плохо проводит тепло и не проводит электричество. При нагревании без доступа воздуха он превращается в графит. В настоящее время найдены условия получения алмазов искусственным способом из графита (нагревание графита при 3000 °С и давлении 70-100 тыс. атм.). Синтетические алмазы широко применяются в технике. Графит — темно-серое вещество с металлическим блеском. Он имеет слоистую структуру и поэтому сравнительно мягок (оставляет след на бумаге). Графит хорошо проводит электричество (но хуже, чем металлы), очень тугоплавок.
Черный (аморфный) углерод представляет собой пористое вещество черного цвета. Характерные представители этой модификации углерода — сажа, кокс, древесный уголь. Они не встречаются в чистом виде, а обычно содержат различные примеси. Химические свойства. Наиболее реакционноспособным является черный углерод, за ним идут графит и алмаз. При обычной температуре углерод довольно инертен, но при нагревании реагирует со многими веществами: кислородом, серой, оксидами металлов и неметаллами. При взаимодействии кислорода с углеродом в зависимости от количества кислорода образуется монооксид или диоксид углерода и выделяется большое количество теплоты: 2 С + O2 С + O2 = СО2. Углерод — сильный восстановитель, отнимая кислород у многих оксидов, он восстанавливает вещества до свободного состояния: ZnO + C = Zn + CO, SiO2 + 2 С = Si + 2 СО. Углерод взаимодействует с металлами с образованием карбидов: 4 Al + 3 С = Аl4С3 (карбид алюминия), Ca + 2 С = СаС2 (карбид кальция). При взаимодействии карбидов с водой или кислотой выделяется либо метан, либо ацетилен: Аl4C3 + 12 HCl = 4 АlСl3 + 3 СН4, СаС2 + 2 Н2О = Ca(ОН)2 + С2Н2. Ряд карбидов имеет состав, который не подчиняется общепринятым представлениям о валентности, например Fе3С. Карбиды металлов образуются также при реакции углерода с оксидами металлов: CaO + 3 С = СаС2 + СО. При взаимодействии избытка углерода с диоксидом кремния (песком или кварцем) кроме кремния образуется карбид кремния (карборунд), который отличается очень большой твердостью: SiO2 + 3 С = SiС + 2 СО. С галогенами углерод непосредственно не взаимодействует. Соединения углерода с галогенами получают из других его соединений, например углеводородов. Получение. Раньше графит получали только из его природных залежей. В настоящее время его получают из кокса. Через массу кокса, смешанного со смолой и песком, пропускают переменный ток большой силы. В такой электрической дуге через 24-36 ч кокс превращается в графит. Полученный графит по качеству и чистоте превосходит природный. Сажу получают термическим разложением углеводородов: С3Н8 = 3 С + 4 Н2. Применение. Алмазы применяются при изготовлении наконечников буров, резании стекла, протягивании тонкой проволоки, для получения специальных шлифовальных порошков, а также в ювелирном деле. Хорошо отшлифованные прозрачные кристаллы — бриллианты — являются драгоценными камнями.
Графит широко применяется в электротехнике для изготовления электродов, которые во многих электроустановках заменяют платиновые. Графит идет также на изготовление тиглей для переплавки металлов, специальных термостойких смазок, карандашей. Сажу используют при вулканизации каучука, а также для изготовления красок, туши и сапожного крема. Каменный уголь, кокс применяются как восстановители в металлургических процессах. Древесный уголь используют как поглотитель (адсорбент). Адсорбция. Некоторые вещества способны поглощать молекулы других веществ из газов, паров и растворов и удерживать их на своей поверхности. Поглощение газов, паров и растворенных веществ поверхностью других веществ называется адсорбцией. Вещества, которые поглощают, называются адсорбентами. Процесс адсорбции протекает тем интенсивнее, чем больше поверхность адсорбента. Для увеличения поверхности адсорбент измельчают или делают пористым. Одним из лучших адсорбентов является древесный уголь. Он хорошо адсорбирует различные газы, пары и растворенные вещества. Если водный раствор красителя прокипятить с древесным углем и профильтровать, то фильтрат окажется бесцветным (весь краситель поглотится углем). Высокая адсорбционная способность древесного угля обусловлена его большой пористостью, а следовательно, и большой поверхностью. Улучшить адсорбционные качества угля можно обработкой его перегретым паром, который удаляет из пор все загрязняющие вещества, увеличивая общую поверхность угля. Такой уголь называется активированным. Его применяют для очистки спирта от сивушных масел, сахарного сиропа — от окрашенных веществ, для улавливания бензина из природных газов, а также для очистки воздуха от отравляющих веществ (последнее было использовано в фильтрующем противогазе, предложенном Н. Д. Зелинским в период первой мировой войны 1914-1918 гг.). Активированный уголь в виде таблеток применяют при отравлениях и желудочных заболеваниях для удаления вредных веществ из организма. Его применяют также как катализатор. Хорошими адсорбентами являются также силикагель и алюмогель (частично обезвоженные кремниевая кислота и гидроксид алюминия) и различные синтетические смолы. Монооксид углерода СО. При неполном сгорании углерода или продуктов, содержащих углерод, образуется монооксид углерода, или угарный газ, СО. Монооксид углерода — ядовитый газ без цвета и запаха. При температуре -192 °С, он сжижается, а при -205 °С затвердевает. Растворимость монооксида углерода в воде низкая. Отравляющее действие его состоит в том, что он необратимо взаимодействует с гемоглобином крови, который после этого теряет способность переносить кислород от легких к тканям. По химическим свойствам монооксид углерода — восстановитель. Он хорошо горит, выделяя большое количество теплоты:
2 СО + O2 = 2 СО2. Монооксид углерода может отнимать кислород от оксидов металлов, что используется в металлургических процессах: FeO + СО = Fe + СО2. В присутствии активированного угля, играющего роль катализатора монооксид углерода присоединяет хлор, образуя фосген, который применялся как боевое отравляющее вещество: СО + Сl2 = СОСl2. При высокой температуре (400 °С) и давлении 300 атм. монооксид углерода реагирует с водородом, образуя метиловый спирт: СО + 2 Н2 При повышенной температуре монооксид углерода взаимодействует со щелочами, образуя соли муравьиной кислоты (формиаты): СО + NaOH = HCOONa. При взаимодействии монооксида углерода с аммиаком образуется очень ядовитое вещество — синильная кислота: СО + NН3 = НСN + Н2О. В лабораторных условиях монооксид углерода можно получить действием концентрированной серной кислоты на муравьиную или щавелевую кислоту при нагревании: НСООН Н2С2О4 Серная кислота здесь играет роль водоотнимающего агента. В промышленности монооксид углерода получают газификацией твердого топлива. Монооксид углерода чаще всего образуется при пропускании диоксида углерода (углекислого газа) над раскаленным углем: СО2 + С = 2 СО + 171,5 кДж. Монооксид углерода находит широкое применение. Он входит в состав искусственного газообразного топлива, а также используется в органическом синтезе.
|
|||||||||
|
Последнее изменение этой страницы: 2021-04-05; просмотров: 60; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.217.220.114 (0.033 с.) |
 2 СО,
2 СО, СH3ОН.
СH3ОН.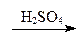 Н2О + СО,
Н2О + СО,


