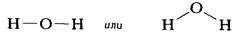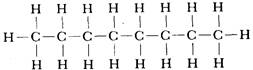Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Изотопами называются атомы одного химического элемента с разным числом нейтронов.Содержание книги
Поиск на нашем сайте
У химического элемента хлора (Cl) есть два изотопа, изотоп с 18 нейтронами (75,53% всех атомов хлора, встречающихся в природе) и изотоп с 20 нейтронами (24,47%). Чтобы записать символ изотопа, слева от символа элемента указывают нижним индексом его порядковый номер, а верхним индексом — массовое число (суммарное число протонов и нейтронов) изотопа. Таким образом, символы двух естественных изотопов хлора записывают как 3517Cl и 3717Cl. Наличие нижнего индекса не обязательно, т. к. все атомы хлора содержат в своем ядре 17 протонов, поэтому символы изотопов обычно записывают без указания нижнего индекса — 35Cl и 37Cl. Обсуждая эти изотопы, говорят «хлор-35» и «хлор-37». Для того чтобы атом был устойчивым, он, как правило, должен иметь в ядре немного больше нейтронов, чем протонов. Ядра, содержащие слишком много элементарных частиц одного сорта, неустойчивы и подвергаются радиоактивному распаду.
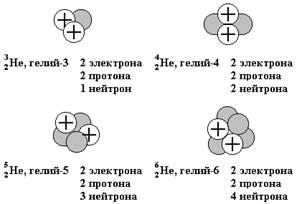
Рис. 1.1. Состав четырех изотопов гелия (Не). Все атомы гелия (рис. 1.1) содержат по два протона и, следовательно, по два электрона, но число нейтронов у них разное. В природе большинство атомов гелия имеет по два нейтрона (гелий-4) и реже одного раза на миллион встречаются атомы гелия с одним нейтроном (гелий-3). Другие изотопы гелия — гелий-5 и гелий-6 — неустойчивы и могут существовать очень непродолжительное время в ядерных реакциях. Размеры ядер атомов на рисунке очень сильно увеличены. Если бы они были такими, диаметр атома должен был бы достигать примерно 0,5 км. Пример 1.1. Сколько протонов, нейтронов и электронов содержится в атоме ванадия-51? Запишите символ этого изотопа. Решение. Порядковый номер ванадия (см. периодическую систему химических элементов) равен 23, а массовое число изотопа равно 51 (по условию). Следовательно, он содержит 23 протона, 23 электрона и 51 – 23 = 28 нейтронов. Его символ 5123V (или 51V). Полная масса атома называется его атомной массой * и приблизительно равна сумме масс всех протонов, нейтронов и электронов, входящих в состав атома. На самом деле масса атома меньше, суммы масс всех входящих в состав атома частиц, т.к. когда из протонов и нейтронов образуется ядро атома, часть их массы превращается в энергию, которая выделяется в окружающую среду, этот дефект массы и есть источник энергии в реакциях ядерного синтеза. Атом невозможно разделить на составляющие его элементарные частицы, не подведя к нему извне энергию связи притонов и нейтронов в атомном ядре. * В практической химии раньше пользовались терминами «атомный вес» и «молекулярный вес», хотя во всех этих случаях подразумеваются массы, а не веса. Пример 1.2. Вычислите дефект массы при образовании атома углерода-12 из протонов, нейтронов и электронов. Решение. Поскольку порядковый номер каждого атома углерода равен 6, углерод-12 имеет 6 протонов и 6 электронов. Для вычисления суммарной массы всех этих частиц воспользуемся данными приведенными выше: Протоны: 6∙1,00728 а.е.м. = 6,04368 а.е.м. Нейтроны: 6∙1,00867 а.е.м. = 6,05202 а.е.м. Электроны: 6∙0,00055 а.е.м. = 0,00330 а.е.м. Суммарная масса частиц: 12,09900 а.е.м. По определению шкалы атомных единиц массы, масса одного атома углерода-12 точно равна 12 а.е.м. Следовательно, в процессе образования этого атома из составляющих его элементарных частиц суммарная масса последних должна уменьшиться на 0,0990 а. е. м. Пример 1.3. Вычислите ожидаемую атомную массу изотопа хлора, содержащего 20 нейтронов. Сравните ее с атомной массой этого изотопа, приведенной в таблице. Решение. Указанный изотоп хлора содержит 17 протонов и 20 нейтронов. Протоны: 17∙1,00728 а.е.м. = 17,1238 а.е.м. Нейтроны: 20∙1,00867 а.е.м. = 20,1734 а.е.м. Электроны: 17∙0,00055 а.е.м. = 0,0094 а.е.м. Суммарная масса частиц: 37,3066 а.е.м. Действительная (наблюдаемая) атомная масса: 36,966 а.е.м. Дефект массы: 0,341 а.е.м. Каждый изотоп элемента характеризуется порядковым номером (суммарным числом протонов), массовым числом (суммарным числом протонов и нейтронов) и атомной массой (массой атома, выраженной в атомных единицах массы). Дефект массы при образовании атома очень мал, поэтому массовое число обычно совпадает с атомной массой изотопа, округленной до ближайшего целого числа. Так, атомная масса хлора-37 равна 36,966, что после округления дает 37. Если в природе встречается несколько изотопов одного элемента, то экспериментально наблюдаемая атомная масса (естественная) должна быть равна средневзвешенному значению атомных масс отдельных изотопов. Это средневзвешенное значение определяется следующим образом: хлор существует в природе в виде смеси из 75,53% хлора-35 (атомная масса 34,97 а. е. м.) и 24,47% хлора-37 (36,97 а. е. м.), поэтому средневзвешенное значение масс этих изотопов равно: A(Clприр.) = (0,7553∙34,97) + (0,2447∙36,97) = 35,462 (а.е.м). Атомные массы, указанные в периодической таблице, представляют собой во всех случаях средневзвешенные значения атомных масс изотопов, встречающихся в природе, и именно этими значениями мы будем пользоваться в дальнейшем, за исключением тех случаев, когда будет конкретно обсуждаться какой-нибудь отдельный изотоп. Изотопы различаются свойствами чувствительными к массе, например скоростью диффузии. Пример 1.4. Магний (Mg) в основном состоит из трех естественных изотопов: 78,70% атомов магния имеют атомную массу 23,985 а.е.м., 10,13% — 24,986 а.е.м. и 11,17% — 25,983 а.е.м. Сколько протонов и нейтронов содержится в каждом из этих трех изотопов? Как следует записать символы каждого изотопа? Наконец, чему равно средневзвешенное значение их атомных масс? Решение. Все изотопы магния содержат по 12 протонов. Изотоп с атомной массой 23,985 а.е.м. имеет массовое число 24 (суммарное число протонов и нейтронов), следовательно, он имеет 24 - 12 = 12 нейтронов. Символ этого изотопа 24Mg. Аналогично находим, что изотоп с атомным весом 24,986 а.е.м. имеет массовое число 25, содержит 13 нейтронов и имеет символ 25Mg. Третий изотоп (25,983 а.е.м.) имеет массовое число 26, содержит 14 нейтронов и имеет символ 26Mg. Средняя атомная масса магния находится следующим образом: A(Mgприр.) (0,7870∙23,985) + (0,1013∙24,986) + (0,1117∙25,983) = 24,31 (а.е.м). Пример 1.5. Бор имеет два естественных изотопа: 10В и 11В. Известно, что 80,22%, его атомов представляют собой изотоп 11В с атомной массой 11,009 а. е. м. Пользуясь значением естественной атомной массы, приведенным в таблице Д. И. Менделеева, вычислите атомную массу изотопа 10В. Решение. Если 80,22% всех атомов бора представляют собой изотоп 11В, то 100,00 - 80,22 = 19,78% составляют изотоп с неизвестной атомной массой. Обозначая эту неизвестную атомную массу как W, можно записать: A(Bприр.) = (0,8022∙11,009) + (0,1978∙W) = 10,81 а. е. м. Следовательно, W = (10,81 - 8,831)/0,1978 = 10,01 а. е. м. Молекулы Образование атомов из элементарных частиц, является предметом рассмотрения ядерной физики. Когда атомы настолько сближаются друг с другом, что внешние электроны одного атома могут взаимодействовать с внешними электронами других атомов, между атомами возникают силы притяжения, удерживающие их вместе — химическая связь. В простейших случаях связь возникает в результате обобществления двух электронов между парой атомов, причем каждый из связанных атомов поставляет для этого по одному электрону. Связи, возникающие в результате обобществления электронов, называются ковалентными связями, а два или несколько атомов, связанных воедино ковалентными связями, называют молекулой. Молекула ¾ частица способная к самостоятельному существованию и представляющая совокупность атомов связанных между собой ковалентными связями. Молекулу можно изобразить в виде химической формулы, которая показывает качественный и количественный состав вещества.
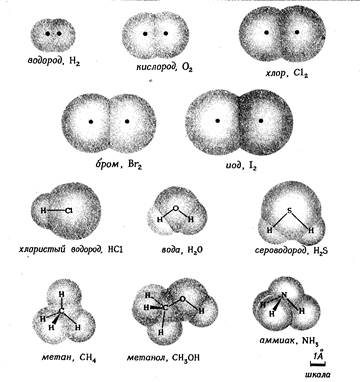
Рис. 1.2. Форма и относительные размеры некоторых простых молекул. Каждая пара связанных атомов как бы проникает друг в друга, потому что их электронные облака перекрываются между собой. Принято изображать молекулы таким образом, что расширяющаяся линия указывает связь, направленную от плоскости рисунка в сторону наблюдателя, а пунктирная линия указывает связь, уходящую за плоскость рисунка в сторону от наблюдателя. В графических формулах молекул ковалентная связь, возникающая в результате обобществления пары электронов, схематически изображается прямой линией, соединяющей связанные атомы. Так, в молекуле воды один атом кислорода (О) связан с двумя атомами водорода (Н). Графическая формула этой молекулы может быть изображена двумя способами:
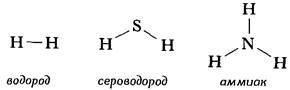
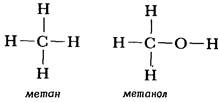
Второй вариант графической формулы воды учитывает тот факт, что молекула воды не линейна; две связи Н-О образуют угол 105° друг с другом. Молекулы газообразного водорода, сероводорода, аммиака, метана и метанола (метилового спирта) имеют следующие структурные формулы:
Графические формулы указывают только связи между атомами молекулы. Они не дают сведений о трехмерной структуре (или форме) молекул. Рис.1.2 дает представление о форме и относительном объеме нескольких молекул. Угол между связями в молекулах, содержащих более двух атомов, может принимать различные значения. В молекуле сероводорода равен 92°; четыре атома, присоединенных к центральному атому углерода в метане, направлены к четырем вершинам тетраэдра. Графическая формула неразветвленного октана, одного из компонентов бензина, такова:
Каждая из указанных выше графических формул может быть сведена к сжатой молекулярной формуле, которая показывает, сколько атомов каждого элемента имеется в молекуле, но совсем или почти совсем не дает сведений о том, как эти атомы соединены между собой. Молекулярная формула водорода Н2, воды Н2О, сероводорода H2S, аммиака NН3, метана СН4, метанола (метилового спирта) СН3ОН или СH4О, а октана C8H18. Формула октана может быть также записана в такой форме: СН3-СН2-СН2-СН2-СН2-СН2-СН2-СН3
|
||||
|
Последнее изменение этой страницы: 2021-04-05; просмотров: 301; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.220 (0.007 с.) |