Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Глава 7. 3. Воздух. Инертные газы
Воздух Сами того не замечая, мы живем на дне огромного воздушного океана. Та смесь газов, которая образует атмосферу, необходима для нас более, чем что-либо другое. Человек может прожить несколько недель без пищи, несколько дней без воды, но не может прожить и нескольких минут без воздуха. В воздухе таятся огромные, пока почти неиспользованные запасы энергии: вследствие неодинакового поглощения солнечных лучей различными участками земной поверхности создаётся неравномерный нагрев воздуха и возникают ветры, за счёт которых могут быть получены многие миллиарды киловатт-часов электроэнергии ежегодно. Общая масса атмосферы равна 5,2·1015 т, т. е. составляет менее одной миллионной от массы всего земного шара (6,0·1021 т). Однако на долю каждого человека всё же приходится более 1,5 млн. т воздуха. Около 90% массы атмосферы заключено в слое высотой до 16 км и лишь одна миллионная — выше 100 км. В древности воздух считался индивидуальным веществом. По учению греческого философа Анаксимена, воздух является началом всего сущего, а позднее он стал рассматриваться в качестве одного из основных элементов природы. То обстоятельство, что воздух имеет массу, было известно уже Аристотелю. Александрийский учёный Герон (62-150 гг. н. э.) писал о воздухе следующее: «Сосуды, которые кажутся большинству людей пустыми, на самом деле не пусты, а наполнены воздухом... Воздух образован частицами маленькими и лёгкими, в своём большинстве невидимыми... Отсюда должно быть принято, что воздух материален. Приведённый в движение, он становится ветром (так как ветер есть нечто иное, как воздух в движении)». Первые указания на сложность состава воздуха имеются в сочинениях древних китайских химиков. Из европейцев такое мнение впервые высказал Леонардо да Винчи (конец XV века). Оно было подтверждено опытным путём и стало общепринятым лишь около XVIII века. О силе ветра. Сила ветра измеряется специальными приборами (анемометрами) и обычно оценивается по 12-бальной шкале. Тихий ветер (1) лишь отклоняет дым из трубы, при сильном (6) качаются верхушки деревьев, а ураган (12) причиняет большие разрушения. Воздух имеет сложный состав. Его основные составные части можно подразделить на три группы: постоянные, переменные и случайные. К первым относятся кислород (около 21% по объёму), азот (около 78%) и так называемые инертные газы (около 1%). Содержание этих составных частей практически не зависит от того, в каком месте земного шара взята проба сухого воздуха. Ко второй группе относятся углекислый газ (0,02-0,04%) и водяной пар (до 3%). Содержание случайных составных частей зависит от местных условий: вблизи металлургических заводов к воздуху часто бывают примешаны заметные количества сернистого газа, в местах, где происходит распад органических остатков, — аммиака и т. д. Помимо различных газов, воздух всегда содержит большее или меньшее количество пыли.
Кроме перечисленных газов воздух постоянно содержит следы (т. е. ничтожные количества) озона, водорода, метана, аммиака, оксидов азота и угарного газа. По мере совершенствования методов газового анализа число таких, практически незаметных составных частей воздуха постепенно возрастает. Атмосферная пыль содержит частицы диаметром от 10-7 до 10-2 см (из которых наиболее мелкие не оседают даже в неподвижном воздухе). Помимо пылинок, возникающих на земной поверхности (частиц почвы, дыма, пыльцы растений и т.д.), некоторое значение имеют пылинки вулканического и даже космического происхождения. Подсчитано, что на Землю ежегодно оседает около 5 млн. т космической пыли, (поверхность Земли равна 510 млн. км2), поэтому на квадратный метр приходится лишь сотая доля грамма. Абсолютная запылённость воздуха может быть в отдельных местах очень различной. Его относительная запылённость быстро уменьшается с высотой.
Кубический сантиметр комнатного воздуха обычно содержит миллионы пылинок. Общая запылённость воздуха возрастает. Было установлено, что за десятилетие с 1957 по 1967 г. помутнение атмосферы над Тихим океаном увеличилось на 30%. Количество пыли, выпадающей в большом городе, огромно. Было подсчитано, что на каждый м2 в Нью-Йорке ежемесячно выпадает до 17 г пыли, а в Токио — даже вдвое больше. Каждый кубический сантиметр воздуха городов содержит несколько тысяч микроорганизмов.
Освобождение от пыли является первой стадией получения кондиционированного воздуха, который, помимо чистоты, характеризуется постоянными температурой и влажностью. Кондиционирование воздуха важно для некоторых отраслей промышленности, а также картинных галерей, музеев и т. д. Находящийся над Землей воздух давит на неё с силой более одного килограмма на каждый квадратный сантиметр поверхности. Эту величину легко подсчитать, зная, что нормальное атмосферное давление уравновешивается столбом ртути (r(Hg) = 13,6 г/см3) высотой 760 мм. Общее давление атмосферы может быть разложено на давления отдельных составляющих её газов — в этом случае говорят об их парциальных (частичных) давлениях. Например, из общей величины в 101325 Па на долю кислорода приходится 101,325·0,21 = 21,28 кПа. Соотношение между постоянными составными частями воздуха в нижних слоях атмосферы с высотой почти не меняется. Вся жизнь на земной поверхности развивалась в условиях атмосферного давления, поэтому мы не замечаем его, подобно тому как глубоководные рыбы не замечают колоссальных давлений на больших глубинах океана, тогда как на глубине 11 км давление превышает 1,01·108 Па. Изменение среднего атмосферного давления с высотой над уровнем моря:
Налагаемая атмосферным давлением на живые организмы нагрузка гораздо значительнее, чем это представляется с первого взгляда. Общая поверхность человеческого тела составляет в среднем около 20 тыс. см2. Это значит, что человек незаметно для себя испытывает постоянную нагрузку в размере примерно 20 т. Непосредственно примыкающий к поверхности Земли слой атмосферы характеризуется довольно закономерным изменением температуры — последняя понижается примерно на 6 град с каждым километром высоты. Слой этот — тропосфера — простирается на высоту около 18 км у экватора и 7 км у полюсов. Между ним и Землёй существует известная разность потенциалов, причём тропосфера заряжена положительно, а земная поверхность отрицательно. Основное значение для поддержания разности потенциалов имеет постоянное поступление в атмосферу множества мельчайших капелек морской воды, срываемых с гребней океанских волн и приобретающих при этом значительный положительный заряд. Более высокие слои атмосферы принято делить на стратосферу (приблизительно до 40 км), мезосферу (40-80 км), термосферу (80-800 км) и экзосферу (выше 800 км). Границы между этими слоями не являются чёткими и несколько изменяются в зависимости от широты местности, времени года и общего состояния атмосферы. Верхняя граница того или иного слоя носит название соответствующей «паузы». Так, граница между тропосферой и стратосферой называется тропопаузой. На высотах порядка нескольких тысяч километров экзосфера постепенно переходит в межпланетный газ. Помимо приведённой выше общей классификации атмосферных слоёв, для некоторых из них применяются другие названия. Так, слой высотой 30-80 км, в котором преимущественно протекают химические реакции под действием солнечных лучей, иногда называют хемосферой, слой выше 80 км, характеризующийся большим относительным содержанием заряженных частиц — ионосферой.
Основной химический состав атмосферы примерно до 1000 км остаётся азотно-кислородным. В противоположность монотонно уменьшающемуся давлению, температурная кривая имеет минимум на высоте около 20 км, максимум около 50 км и новый минимум в мезопаузе. После этого температура начинает расти, достигая примерно 900 °С уже на высоте 200 км. Плотность атмосферы на больших высотах последовательно уменьшается. Общий характер высотного изменения температуры воздуха был предугадан Аристотелем. Он делил атмосферу на три слоя, из которых прилегающий к Земле пригоден для жизни, следующий сильно охлажден, а самый верхний, наоборот, сильно нагрет.
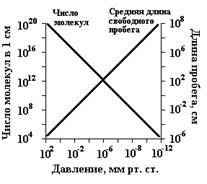
Рис. 3.1. Основныехарактеристики вакуума. По молекулярно-кинетической теории температура газа определяется средней энергией движения составляющих его частиц. «Совершенно очевидно, что имеется достаточное основание теплоты в движении. А так как движение не может происходить без материи, то необходимо, чтобы достаточное основание теплоты заключалось в движении какой-то материи», — писал в 1745 г. М. В. Ломоносов. Термометр изолирован от излучений, он показал бы очень низкую температуру, ниже -200 °С. Дело в том, что термометр (дающий практически интересующие нас оценки) регистрирует не энергию движения каждой отдельной частицы, а общую энергию, сообщаемую ему ударами окружающих частиц. Таких ударов за единицу времени тем больше, чем больше молекул в единице объема газа. Каждый кубический сантиметр воздуха земной поверхности содержит 2,7·1019 молекул. Вакуум. Жидкий воздух Обычно достигаемый в лабораториях вакуум («пустота»), при котором столкновения молекул между собой уже сравнительно редки, соответствует давлению примерно в 0,13 Па. При каком вакууме в каждом кубическом сантиметре разреженного газа остается еще около 3·1013 частиц. Даже с помощью самых совершенных методов современной техники не удается достигнуть вакуума, при котором в кубическом сантиметре газа оставалось бы менее 1000 частиц. Между тем кубический сантиметр межпланетного пространства содержит лишь десятки частиц, а межзвездного — еще гораздо меньше. Именно поэтому «межзвездное пространство одновременно и исключительно холодно и чрезвычайно горячо» (Эддингтон). Фактическая температура находящегося в межпланетном пространстве тела соответствует средней энергии движения его собственных частиц. Она определяется в основном лучепоглощением и лучеиспусканием этого тела. Например, обращенная к Солнцу сторона Луны (на ее экваторе) нагревается до +120 °С, а обратная осаждается до -150 °С. Так как одни поверхности (особенно-зеркальная) сильно затрудняют обмен лучистой энергией, а другие (особенно — шероховатая черная) такому обмену очень способствуют, путем изменения характера направленных к Солнцу и от него поверхностей находящегося в межпланетном пространстве тела можно регулировать его температуру.
Масса литра воздуха при нормальных условиях (1,293 г), а его средняя молярная масса воздуха равна 22,4·1,293 = 29 г/моль. Пример 1. Вычислим плотность хлора по отношению к воздуху. Молекулярная формула хлора — Cl2, молярная масса — 35,5·2 = 71. Как вытекает из закона Авогадро, данный газ во столько раз тяжелее (легче) воздуха, во сколько раз его молярная масса больше (меньше) средней молярной массы воздуха. Следовательно, плотность хлора по отношению к воздуху будет 71:29 = 2,45, т. е. хлор приблизительно в 2,5 раза тяжелее воздуха. При достаточном охлаждении воздух переходит в жидкое состояние. Жидкий воздух можно довольно долго сохранять в сосудах с двойными стенками, из пространства между которыми для уменьшения теплопередачи выкачан воздух. Подобные сосуды используются, например, в термосах. Свободно испаряющийся при обычных условиях жидкий воздух имеет температуру около -190 °С. Состав его непостоянен, так как азот улетучивается быстрее кислорода. По мере удаления азота цвет жидкого воздуха изменяется от голубоватого до бледно-синего (цвет жидкого кислорода). До XIX века считали, что газы являются таковыми по самой своей природе, и вопрос о их сжижении даже не возникал. Лишь в 20-х годах XIX века, применяя значительные давления, удалось получить в жидком состоянии хлор, аммиак, диоксид углерода и ряд других веществ «газообразной природы». Однако оставались еще многие, в частности основные газы воздуха — кислород и азот, которые, несмотря на все усилия, не сжижались. На них перенесли то представление, которое раньше было общим и стали считать их «постоянными» газами. Только в 1877 г. впервые удалось получить в жидком состоянии один из этих «постоянных» газов — кислород. Вслед за тем были сжижены и все другие. Причина неудач ранних попыток сжижения газов лежала в том, что еще неясна была сущность различия между газообразным и жидким состоянием вещества. В обоих случаях имеет место и взаимное притяжение молекул, и их взаимное расталкивание. Жидкое состояние вещества характеризуется преобладанием первого, газообразное — второго. Взаимное притяжение молекул практически не зависит от температуры. Напротив, обусловленное их ударами друг о друга взаимное расталкивание, весьма сильно зависит от температуры, так как ее величина определяет скорость движения молекул и их кинетическую энергию. Газ может быть переведен в жидкое состояние лишь тогда, когда стяжение получает преобладание над расталкиванием или по крайней мере становится равным ему. Та температура, при которой расталкивание уравновешивается стяжением, характеризуется отсутствием различия между жидкостью и ее паром и называется критической. Существование такой температуры было впервые установлено Д. И. Менделеевым (1861 г.).
Критическая температура различна для разных веществ и, например, для хлора равна +144 °С. Поэтому, применив достаточное давление, хлор можно перевести в жидкое состояние и без его охлаждения. Критические температуры основных газов воздуха лежат, наоборот, очень низко: кислорода при -118 °С и азота при -147 °С. Поэтому воздух можно перевести в жидкое состояние, лишь охладив его предварительно ниже указанных температур. Между тем исследователи раннего периода пытались получить жидкий воздух, применяя высокие давления, но не заботясь о достаточном охлаждении.
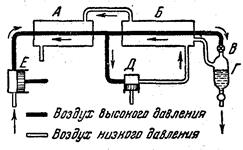
Рис. 3.2. Принципиальная схема установки для получения жидкого воздуха. Трудно сжижаемые газы научились сжижать используя их свойства охлаждаться при расширении, если газ многократно сжимать и выпускать его в большой сосуд, то он будет охлаждаться и когда его температура достигнет критической он начнет сжижаться. Принципиальная схема установки для получения жидкого воздуха показана на рис. 3.2. Предварительно освобожденный от пыли, влаги и углекислого газа воздух сжимается компрессором (Е) до 2·107-2,5·107 атм. (при одновременном охлаждении водой), проходит первый теплообменник (А) и затем разделяется на два потока. Большая часть направляется в детандер (Д) — поршневую машину, работающую за счет расширения воздуха. Последний, значительно охладившись в детандере, омывает оба теплообменника и, охладив текущий навстречу сжатый воздух, покидает установку. Другой поток сжатого воздуха, охлажденный еще более во втором теплообменнике (Б). направляется через вентиль (В) в расширительную камеру (Г), после чего покидает установку вместе с воздухом из детандера. Вскоре наступает момент, когда в расширительной камере достигается температура сжижения воздуха, а затем он уже непрерывно получается в жидком состоянии.
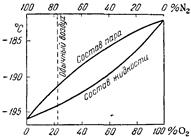
Рис. 3.3. Температура кипения и состав жидкого воздуха. В 1938 г. П. Л. Капицей был разработан метод получения жидкого воздуха при низком давлении — всего 5-6 атм. Основной особенностью этого метода является замена поршневых механизмов компрессора и детандера турбинными. Наиболее простое экспериментальное определение критической температуры жидкостей производят следующим образом. В толстостенной стеклянной трубке запаивают небольшое количество исследуемого вещества. На границе раздела жидкости и ее пара образуется мениск. При постепенном нагревании трубки в ней все время увеличивается давление, а потому жидкость целиком не испаряется, и мениск отчетливо виден. Вблизи критической температуры он становится все более плоским и, наконец, исчезает. Та температура, при которой происходит исчезновение мениска (т. е. поверхности раздела двух фаз), и является критической температурой исследуемого вещества. В жидкости относительно преобладает кислород, в паре — азот. Например, при -190 °С жидкость содержит около 60% кислорода, пар — только 30%. Этим и обусловлено то обстоятельство, что по мере испарения воздуха жидкость обогащается кислородом, причем температура ее кипения постепенно повышается. Одновременно возрастает и плотность жидкого воздуха (приблизительно 0,94 г/см3 для нормального состава). Температура его затвердевания также зависит от состава, причем наинизшая она (-223 °С) при содержании 78% кислорода.
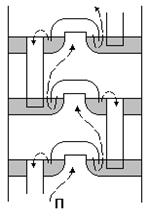
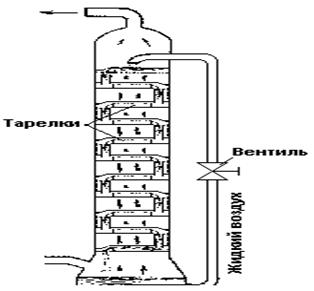
Рис. 3.4. Схема работы тарелок разделительной колонны. Отделение друг от друга жидкостей с близкими температурами кипения осуществляется обычно в разделительных колоннах. Основной задачей такой колонны является создание потока пара (П), направленного вверх, и потока жидкости, стекающей вниз (рис. 3.4). Для обоих потоков при помощи специальных приспособлений — «тарелок» — обеспечиваются условия наиболее тесного соприкосновения, что ведет к постоянному обмену молекулами. При этом у вещества с более низкой точкой кипения (например, азота) молекулы чаще попадают в поток пара, а с более высокой (например, кислорода) — в поток жидкости. Колонна работает непрерывно и тем полнее разделяет оба вещества, чем больше в ней «тарелок». Общая схема колонны для разделения воздуха показана на рис. 3.5.
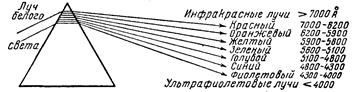
Рис. 3.5. Общая схема колонны для разделения воздуха. Сжатый воздух хранят в стальных баллонах, рассчитанных на давление 150 атм. По действующим техническим условиям баллоны эти должны иметь черную окраску с белой надписью: «Воздух сжатый». При температурах жидкого воздуха свойства многих веществ резко изменяются. Например, жёлтая при обычных условиях сера становится белой. Такие жидкости и газы, как спирт, диоксид углерода и т. п., при соприкосновении с жидким воздухом затвердевают. Свинцовая пластинка после погружения в жидкий воздух издаёт при ударе ясный металлический звон, резина становится настолько хрупкой, что при ударе разбивается на куски, и т. д. Химические реакции при температуре жидкого воздуха вообще очень сильно замедляются. Однако благодаря большой концентрации в нём кислорода (концентрацией называется количество вещества в единице объёма или массы), смешанные с жидким воздухом горючие вещества горят гораздо энергичнее, чем в обычных условиях. Например, смоченная жидким воздухом вата сгорает со вспышкой подобно бездымному пороху. На этом основано применение жидкого воздуха для взрывных работ в горном деле, где используются патроны с пропитанными им горючими материалами. Подобное взрывчатое вещество (оксиликвит) по силе взрыва лишь немногим уступает динамиту, при этом оно дешевле и безопасней в обращении. Ещё эффективнее оксиликвиты на основе жидкого кислорода, которые изготовляются пропитыванием органических поглотителей (древесных опилок, углей) жидким кислородом. Инертные газы. Открытие аргона Благородные газы — гелий, неон, аргон, криптон, ксенон и радон — раньше выделяли в нулевую группу. В последнее время их помещают в главную подгруппу VIII группы. В 1892 г. Дж. Рэлей, исследуя плотность различных газов, заметил, что 1 л азота, полученного из азотосодержащих веществ, имел массу 1,251 г, а 1 л азота, полученного из воздуха — 1,257 г. Это различие в третьем десятичном знаке натолкнуло ученого на мысль, что в азоте, полученном из воздуха, содержатся какие-то неизвестные газы. После отделения кислорода (пропусканием воздуха над раскаленной медью): 2 Cu + O2 = 2 CuO и азота (пропусканием над раскаленным магнием): 3 Mg + N2 = Mg3N2 получили газ в количестве 1% первоначального объема воздуха. Этот газ не вступал ни в какие химические реакции и был назван аргоном (недеятельным или инертным). Таким образом был открыт первый благородный газ. Это открытие называют «торжеством третьего десятичного знака». Позже оказалось, что полученный газ представляет собой смесь нескольких газов. В этой смеси оказался и гелий, линии которого были обнаружены в солнечном спектре еще в 1868 г. Когда гелий и аргон поместили в нулевую группу периодической системы элементов в порядке возрастания их атомных масс, между ними оказалось незаполненное место. Это послужило поводом к дальнейшим поискам. В 1898 г. У. Рамзай и М. Траверс открыли криптон (скрытый) и неон (новый). При перегонке смеси благородных газов У. Рамзай установил, что остаток после отгонки аргона содержал еще один благородный газ, и назвал его ксеноном (чужой). В 1899 г. Р. Б. Оуэнc, Э. Резерфорд, Э. Дорн и А. Дебьерн обнаружили в продуктах распада радия еще один благородный газ, который назвали радоном. Таким образом, нулевая группа оказалась заполненной. Вопрос об атомности молекулы аргона был разрешен при помощи кинетической теории. Согласно последней, количество тепла, которое нужно затратить для нагревания моля газа на один градус, зависит от числа атомов в его молекуле. При постоянном объеме моль одноатомного газа требует 13 Дж, двухатомного — 21 Дж. Для аргона опыт давал 13 Дж, что и указывало на одноатомность его молекулы. То же относится и к другим инертным газам. Следующий по времени открытия инертный газ — гелий («солнечный») был обнаружен на Солнце раньше, чем на Земле. Это оказалось возможным, благодаря разработанному в 50-х годах XIX века методу спектрального анализа. Если тонкий пучок «белого» солнечного света направить на стеклянную призму, он разлагается на лучи различных цветов радуги (рис. 3.6). Каждый луч может быть охарактеризован определенной длиной волны (l) или частотой колебаний (n), т. е. числом волн, сменяющихся за одну секунду.*
Рис. 3.6. Разложение солнечного луча призмой. * Греческие буквы l, и n читаются соответственно «лямбда» и «ню». Выражаемые ими величины легко могут быть переведены друг в друга, так как они связаны соотношением: l·n = с, где с — скорость света (3·108 м/сек). Отсюда следует, что чем меньше l, тем больше n, и обратно. Для измерения длин световых волн (и других очень малых длин) обычно применяются следующие единицы: микрон (мк, m) = 0,001 мм = 10-4 см; миллимикрон (ммк, mm) = 0,001 мк = 10-7 см; ангстрем (А) = 0,1 ммк = 10-8 см. По международному соглашению (1960 г.) при образовании кратных и дольних единиц рекомендуется использовать определенные приставки к основным единицам (м, г и др.). Ниже приводятся соответствующие множители, названия отвечающих им приставок, их русские (верхняя строка) и латинские обозначения:
В этой системе обозначений 1 микрон = 1 мкм, 1 миллимикрон = 1 нм и 1 ангстрем = 0,1 нм = 100 пм. По обе стороны от видимого спектра располагаются невидимые лучи: инфракрасные и ультрафиолетовые, которые могут быть обнаружены и изучены при помощи различных физических методов.
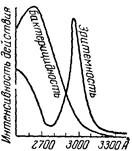
Рис. 3.7. Биологическая активность ультрафиолетовых лучей. Они обладают рядом интересных особенностей. Как видно из рис. 3.7, ультрафиолетовые лучи при определенных длинах волн обладают сильным бактерицидным (убивающим бактерии), а при несколько больших — эритемным (вызывающим загар кожи) действием. Облучение ими в умеренных дозах благотворно влияет на организм человека. Установлено, что насекомые весьма чувствительны к ультрафиолетовым лучам, которые привлекают их даже сильнее, чем обычный видимый свет. На долю инфракрасных лучей приходится около 50% всей доходящей до Земли солнечной энергии, и они имеют основное значение для жизни растений. Лучи эти почти не задерживаются туманом, что позволяет фотографировать земную поверхность сквозь облачный покров. Инфракрасные лучи испускаются всяким нагретым предметом, в том числе каждым теплокровным животным (характерные длины волн порядка 0,01 мм). Исследованием, проведенным на гремучих змеях, было выяснено, что они имеют в передней части головы специальные теплочувствительные органы и при охоте руководствуются главным образом тепловым излучением своих жертв. Высокочувствительные приемники в инфракрасном диапазоне улавливают разности температур до тысячных долей градуса. Такое «тепловидение» позволяет решать ряд важных задач — от медицинской диагностики некоторых заболевании до точного определения местонахождения самолетов в полной темноте. Если внести в пламя горелки какую-нибудь летучую при нагревания соль натрия, оно окрасится в желтый цвет, при внесении летучих соединений меди — в сине-зеленый цвет и т. д. Каждый химический элемент при достаточном, нагревании испускает лучи определенных, характерных для него длин волн. Определение длин световых волн осуществляется с помощью спектроскопа. Прибор этот и дал возможность по спектру солнца установить его химический состав. Еще в 1868 г. были таким путем обнаружены линии, не отвечающие ни одному из известных веществ. Эти линии приписали новому элементу — гелию. На земле он был впервые (1895 г.) найден в газах, выделяющихся при нагревании минерала клевеита. Через несколько лет после открытия аргона и гелия (в 1898 г.) были выделены из воздуха еще три инертных газа: неон («новый»), криптон («скрытый») и ксенон («чуждый»). Насколько трудно было их обнаружить, видно из того, что 1 м3 воздуха, наряду с 9,3 л аргона, содержит лишь 18 мл неона, 5 мл гелия, 1 мл криптона и 0,09 мл ксенона. Последний инертный газ — радон был открыт в 1900 г. при изучении некоторых минералов.
|
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-04-05; просмотров: 135; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.0.240 (0.047 с.) |