Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Получение и применение кислорода⇐ ПредыдущаяСтр 15 из 15
В лабораторных условиях кислород можно получить: 1) разложением перманганата калия при нагревании: 2 КМnO4 = К2МnО4 + МnО2 + O2 2) разложением бертолетовой соли в присутствии диоксида марганца как катализатора: 2 КСlO3 = 2 KCl + 3 О2 3) разложением нитратов щелочных или щелочноземельных металлов: 2 KNO3 = 2 KNO2 + О2 4) разложением оксида ртути: 2 HgO = 2 Hg + O2 5) электролизом воды, к которой для увеличения электропроводности добавляют щелочи или сульфаты щелочных металлов. 2 H2O + H2SO4 Этот метод применяется также для промышленного получения кислорода. В полевых условиях для получения кислорода удобно пользоваться тесной смесью 100 вес. ч. КСlО3 с 13 вес. ч. МnО2 и небольшим количеством угольной пыли. Смесь эта — т. н. оксигенит — начинает выделять кислород при ее поджигании. Очистка от СО2 может быть осуществлена пропусканием выделяющегося газа сквозь сосуд с влажной гашеной известью. Основным источником промышленного получения кислорода является жидкий воздух. Выделяемый из него кислород содержит обычно лишь незначительные примеси азота и тяжелых инертных газов. Для получения особо чистого кислорода пользуются иногда разложением воды электрическим током. Применение. Кислород широко применяется в технике. Процессы окисления в кислороде протекают значительно интенсивнее, чем на воздухе. Кроме того, повышается температура пламени, так как теплота не расходуется на нагревание азота, содержащегося в воздухе. Поэтому технический кислород применяют для интенсификации окислительных процессов в химической и металлургической промышленности: в реакциях окисления органических веществ, для обжига руд, выплавки чугунов и сталей, при резке металлов, в горнодобывающей промышленности. Чистый кислород используется в медицине, кислородных приборах для работы под землей, под водой, на больших высотах и как окислитель ракетного топлива. Ежегодная мировая добыча кислорода исчисляется миллионами тонн. Окислительные процессы протекают гораздо энергичнее в чистом кислороде, чем на воздухе. Например, тлеющая лучинка вспыхивает и ярко горит в кислороде. Такой же эффект из всех бесцветных газов дает только гемиоксид азота, почти не встречающийся в практике. Поэтому проба на тлеющую лучинку часто служит для доказательства того, что испытуемый газ является именно кислородом.
Кислород широко применяется для получения высоких температур, которые достигаются путем сжигания различных горючих газов (водорода, светильного газа и т. д.) в смеси не с воздухом, а с чистым кислородом. Особенно распространено применение кислорода в смеси с ацетиленом (температура пламени около 3000 °С) для сварки и резки металлов. В медицине вдыхание чистого кислорода иногда назначается при некоторых отравлениях, заболеваниях легких и др. Очень большое практическое значение имеет использование кислорода (чаще — обогащенного им воздуха) для интенсификации ряда важнейших производственных процессов металлургической и химической промышленности. Кислород держат в голубых баллонах с черной надписью «Кислород» Большие его количества хранят и перевозят в жидком состоянии. Для этого служат специальные емкости («танки») с хорошей теплоизоляцией. Исправный танк на 1 т теряет за час не более 4 кг кислорода (путем испарения сквозь отверстие в верхней части). Ракетное топливо. Используемое в ракетах реактивное топливо обычно слагается из горючего вещества и окислителя. Оно должно одновременно удовлетворять ряду условий (скорость сгорания, теплотворная способность, температура пламени, характер продуктов сгорания, плотность и др.), далеко не всегда совместимых друг с другом. Важной числовой характеристикой такого топлива является его удельный импульс (удельная тяга). Чем он больше, тем меньший расход топлива требуется для получения заданной тяги. Удельный импульс определяется как отношение развиваемой тяги (кГ) к секундному расходу топлива (кГ/с) и обычно не превышает 300 с. Например, удельный импульс часто применяемой в небольших ракетах смеси спирта с кислородом (при наиболее принятых условиях сопоставления — давлении около 20 атм. в камере сгорания) составляет примерно 250 с (а смеси керосина с кислородом — примерно 300 с). Круговорот кислорода в природе. В результате разнообразных процессов окисления кислород постоянно переходит из свободного состояния в связанное. Однако количество свободного кислорода остается практически неизменным, так как убыль его компенсируется жизнедеятельностью растений.
Из всего кислорода, содержащегося в земной коре, воздухе, а также в составе оксидов, солей и воды, круговороту подвергается только кислород содержится в свободном состоянии в воздухе. При окислении углерода и водорода, содержащихся в различных видах топлива, образуются углекислый газ и вода. Для сжигания углей, нефтепродуктов, древесины, различных природных, попутных и образующихся в производстве газов (генераторный, коксовый, доменный) расходуется огромное количество кислорода. Значительную его часть поглощают при дыхании живые организмы. Однако количество кислорода в атмосфере остается практически неизменным. Это достигается жизнедеятельностью растений, которые поглощают углекислый газ и воду и с помощью особых катализаторов — ферментов — под действием солнечной энергии (фотосинтез) превращают их в углеводы, освобождая свободный кислород: n CO2 + n Н2О = (СН2О)n + n О2 Выделяющийся кислород попадает в атмосферу и компенсирует ту его часть, которая расходуется на окислительные процессы. Таким образом, постоянное количество кислорода в атмосфере обусловлено жизнедеятельностью растительного и животного мира. Озон В 1840 г. было получено газообразное вещество, состоящее из молекул О3 и сильно отличающееся по свойствам от обычного кислорода (О2). Новый газ, обладающий характерным запахом, назвали озоном (по-гречески — «пахучий»). Подобно обычному кислороду, озон представляет собой простое вещество. Он является аллотропическим видоизменением кислорода. Для молекулы его вероятна структурная формула O=O=O с четырехвалентным атомом кислорода в центре. Газообразный озон голубоватого цвета, в жидком состоянии он становится темно-синим, в твердом ¾ почти черным. Температура плавления озона -192 °С, температура кипения -112 °С. Во всех агрегатных состояниях озон способен взрываться от удара. Растворимость его в воде гораздо больше, чем кислорода. Критическая температура озона равна -12 °С, критическое давление 55 атм. Плавление твердого озона требует затраты лишь 2 кДж/моль и сопровождается заметным уменьшением плотности (от 1,73 до 1,61 г/см3). Плотность жидкого озона при температуре кипения составляет 1,46 г/см3, а теплота испарения равна 15 кДж/моль. С жидким кислородом озон смешивается в любых отношениях при температуре выше -180 °С (под давлением), тогда как ниже этой температуры происходит разделение жидкости на два слоя. Под нормальным давлением озона 100 объемов воды растворяют при обычных температурах около 45 объемов этого газа. Еще лучшим его растворителем является четыреххлористый углерод, один объем которого в тех же условиях поглощает около трех объемов озона. Такой раствор имеет красивый голубой цвет. Окислительные свойства озона выражены более ярко, чем кислорода. Это объясняется тем, что озон малоустойчив и легко распадается на молекулярный и атомарный кислород, последний всегда более активен. Поэтому озон окисляет многие вещества, стойкие к действию кислорода. Так, иодид калия, не взаимодействующий с кислородом, легко окисляется озоном: О3 = О2 + О О3 + 2 KI + Н2O = I2 + О2 + 2 КОН
Иодкрахмальная бумага (бумажные полоски, смоченные раствором иодида калия и крахмальным клейстером) при наличия в воздухе озона моментально синеет.
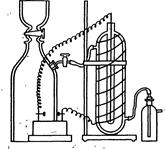
Рис. 4.1. Озонатор. В лаборатории озон можно получить в озонаторе (рис. 4.1), подвергая электрическому разряду сухой кислород или воздух.
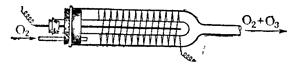
Рис. 4.2. Простейший озонатор. Применяемый для этого в лабораторных условиях прибор — озонатор — схематически изображен на рис. 4.2. (концы проводов присоединяют к полюсам индукционной катушки высокого напряжения). Тихий разряд происходит в пространстве между стенками внутреннего и внешнего стеклянных сосудов. Выходящий из озонатора кислород содержит несколько процентов озона. Его образование сопровождается уменьшением объема, так как по реакции 3 О2 = 2 О3 из 3 объемов кислорода получается 2 объема озона. Обычно используемый для получения озона тихий разряд возникает в газе при малых плотностях тока. Для повышения выхода О3 в озонатор следует вводить осушенный и охлажденный кислород (при замене его воздухом в плохо сконструированных аппаратах наряду с О3 могут частично получаться окислы азота). Образование озона идет в две стадии: первой является распад под действием тихого разряда молекулы кислорода на атомы (O2 + 500 кДж = O + O), второй — соединение атомов кислорода с не распавшимися молекулами (O + O2 = О3 + 105 кДж). Более или менее значительный процент озона содержится в кислороде, образующемся при распаде различных пероксидных соединений. Небольшие количества озона можно получить слабым нагреванием (в пробирке) персульфата аммония с концентрированной азотной кислотой или действием концентрированной Н2SO4 на ВаО2. С хорошим выходом (более 20 вес. %) озон может быть получен в больших количествах электролизом концентрированных (40 вес. %) водных растворов хлорной кислоты при низких температурах (ниже -50 °С) и уменьшенном давлении (10 кПа). Озон сравнительно легко самопроизвольно переходит в кислород, что сопровождается значительным выделением энергии. Следовательно, образование озона связано с поглощением такого же количества энергии. Это вытекает из общего принципа термохимии, согласно которому при образовании любого соединения поглощается (выделяется) точно такое же количество энергии, какое выделяется (поглощается) при его распаде на исходные вещества. У земной поверхности озон образуется главным образом при грозовых разрядах, а также при окислении некоторых смолистых веществ хвойных деревьев.
В связи с этим заметные его количества обычно содержатся в воздухе хвойных лесов, где окислению подвергается древесная смола, и на берегу моря, где окисляются выброшенные прибоем водоросли. Очень небольшое содержание озона в воздухе благотворно действует на организм человека, особенно при болезнях дыхательных путей, но высокая концентрация его приводит к отравлению. Среднее содержание озона в воздухе у земной поверхности составляет обычно от 0,01 до 0,06 мг/м3. Общее его содержание в атмосфере соответствует слою газа толщиной приблизительно в 3 мм (при нормальном давлении). Основная масса озона сосредоточена в высоких слоях воздуха (10-30 км), где он образуется из кислорода под действием ультрафиолетовых лучей Солнца с длиной волны до 185 нм. Более длинные волны (200–320 нм с максимумом действия при 255 нм) вызывают, наоборот, распад озона. Таким образом, в атмосфере существует подвижное равновесие между процессами образования и распада озона, на поддержание которого затрачивается около 5% всей идущей к Земле солнечной энергии. Поглощение озоном коротковолнового излучения Солнца имеет очень большое биологическое значение: если бы эти «жесткие» лучи свободно достигали земной поверхности, они быстро убили бы всю жизнь на ней. Запах озона становится заметным при концентрации его более 1:108 по объему. Продолжительное пребывание в атмосфере с содержанием озона порядка 1:106 вызывает раздражительность, чувство усталости и головную боль. При более высоких концентрациях к этим симптомам добавляются тошнота, кровотечение из носа и воспаление глаз. В производственных условиях озон может образовываться всюду, где происходят электрические разряды или действует коротковолновое излучение. Повышенное его содержание часто обнаруживается, например, в рентгеновских кабинетах. Максимально допустимой концентрацией озона в закрытых помещениях считается 0,1 мг/м3. Распад молекулы озона инициируется ее столкновением с какой-либо другой частицей (Х). Действительный ход превращения озона в обычный кислород хорошо описывается следующими уравнениями: О3 + X = X + О2 + О и затем О + О3 = 2 О2 Почленное сложение этих двух реакций (с сокращением одинаковых членов) приводит к суммарному уравнению: 2 О3 = 3 О2 Взрывоопасность озона резко уменьшается при полном исключении возможности его соприкосновения даже со следами способных окисляться веществ. Эффективным путем повышения стабильности (устойчивости) озона является предварительное пропускание молекулярного кислорода сквозь слой нагретого до 700 °С оксида меди. Газообразные смеси озона с кислородом взрывобезопасны лишь при содержании в них более 80 объемн. % кислорода. После некоторого поверхностного окисления довольно хорошо противостоят действию озона Cu, Ni и Sn. Не разрушается озоном также сплав железа (не содержащего углерода) с 25% хрома. Практическое применение озона основано на его сильном окисляющем и стерилизующем действии. Под действием озона погибают не только бактерии, но и грибковые образования, и вирусы. Озонированным воздухом пользуются для дезинфекции помещений (холодильных складов и др.), устранения неприятных запахов (в курительных комнатах и т. д.), стерилизации питьевой воды, кондиционирования воздуха и проведения некоторых других окислительных процессов. Сжигание горючих веществ в атмосфере озона создает возможность резкого ускорения сгорания и получения более высоких температур, чем при сжигании тех же веществ в кислороде. Поэтому озон представляет большой интерес для реактивной техники.
Чистое вещество Весьма важным практическим вопросом, возникающим при различных химических работах, является вопрос о чистоте веществ. Определяя, например, состав какого-либо загрязненного примесями соединения путем его химического анализа, можно получить результаты, приводящие к неверной формуле. Аналогично легко прийти к ошибочным выводам при изучении характера протекания химических реакций, т. е. получить ложное представление о свойствах участвующих в них элементов. Применяемые для химических работ вещества должны быть достаточно чистыми. Проверку чистоты вещества можно провести с двух сторон: исходя из его состава или из его свойств. На практике часто параллельно используют оба подхода, так как они хорошо дополняют друг друга. Простейшим (но не всегда легко выполнимым) методом проверки чистоты вещества является количественный анализ: близкое совпадение найденного процентного содержания отдельных элементов с вычисленным по молекулярной формуле указывает обычно на отсутствие в изучаемом веществе значительных количеств примесей. Однако, каждый анализ связан с некоторыми неточностями, даже самые благоприятные его результаты не дают еще возможности говорить об отсутствии загрязнений. Отсутствие или наличие (а также количественное содержание) определенных примесей можно установить путем специальных проб. В этом и заключается часто применяемый метод контроля чистоты вещества исходя из его состава. В основе контроля чистоты веществ по их свойствам лежит закон постоянства свойств (Пруст, 1806 г.): свойства чистого вещества не зависят от его происхождения и предыдущей обработки. Закон этот строго соблюдается только для газов и жидкостей, тогда как у твердых веществ может иметь место изменение некоторых свойств в зависимости от обработки. Поэтому применительно к твердым веществам законом постоянства свойств приходится пользоваться с известной осторожностью. Из отдельных свойств веществ для контроля их чистоты лучше всего подходят те, которые могут быть измерены и выражены числом. Имея для какого-либо вещества точно установленный ряд характеризующих его констант (постоянных), на основании закона постоянства свойств следует ожидать, что точно такие же значения соответствующих констант будет иметь любой другой образец того же вещества, если он достаточно чист. Поэтому для контроля чистоты вещества нужно определить те или иные его константы и сравнить полученные результаты с уже имеющимися данными для заведомо чистого образца. Практически чаще всего определяют следующие константы: плотность, температуру плавления и температуру кипения, показатель преломления. Необходимость предварительной очистки веществ при работах с ними была ясна уже М. В. Ломоносову. В программе работ химика (1745 г.) он писал: «Нужны и в химических трудах употребительные натуральные материи сперва со всяким старанием вычистить, чтобы в них никакого постороннего примесу не было, от которого в других действиях обман быть может». При установлении констант веществ приходится считаться с двумя основными источниками ошибок. Один из них можно условно назвать химическим, другой — физическим. Первый обусловлен недостаточной предварительной очисткой исследуемого образца, второй — недостаточным совершенством методики самого определения константы. Ярким примером ошибки по первой причине могут служить результаты установления точки плавления урана. До 1930 г. для этого элемента (неопределенной степени чистоты) разными авторами указывались точки плавления от 1600 до 1850 °С. В 1930 году для урана с чистотой 99,9% было найдено значение 1689±3 °С. Вопрос казался, таким образом, окончательно разрешенным. Между тем точка плавления урана, тщательно очищенного (в связи с работами по атомной энергии), оказалась равной 1133 °С (±2°). Следовательно, наличие лишь 0,1% примесей вызвало в данном случае ошибку при определении точки плавления более чем на 500 град. Хотя столь резкое влияние примесей обычно не наблюдается, однако возможность существенных неточностей при установлении констант недостаточно очищенных веществ необходимо учитывать всегда. Ошибки методики определения можно подразделить на две группы — касающиеся ее надежности и степени точности. Очевидно, что результаты, получаемые с ненадежной по той или иной причине методикой, сами не могут быть надежными. Что касается степени точности, то она определяется главным образом характером применяемой методики, выбор которой до известной степени зависит от условий определения. Например, для измерения низких и высоких температур приходится пользоваться разными приемами, характеризующимися совершенно различной точностью. В результате при низких температурах термические константы веществ могут быть установлены несравненно точнее, чем при высоких. Так, для точки плавления кислорода дается значение -218,79 °С, а для точки плавления рения 3180±20 °С. Очистка веществ Так как плотность представляет собой массу единицы объема, нахождение ее сводится к взвешиванию точно известного объема исследуемого вещества. Для газов результаты выражают обычно массой литра (при нормальных условиях), для жидких и твердых веществ — массой одного кубического сантиметра (при температуре опыта). Числовые значения констант во многих случаях устанавливают не непосредственно измерением, а с помощью того или иного расчета (как среднее из нескольких определений и т. д.), который сам по себе часто может быть выполнен с любой степенью точности. Но «недостаток математического образования легче всего обнаруживается в чрезмерной точности вычислений» (Хаген). Очевидно, что получаемые значения не должны даваться с большей точностью, чем они могут быть определены. Например, температуру плавления кислорода можно (но обычно не нужно) давать с точностью до второго десятичного знака, но бессмысленно указывать хотя бы первый десятичный знак для температуры плавления рения, потому что в данном случае не имеют сколько-нибудь существенного значения даже единицы градусов. Так как излишнее обилие цифр лишь затемняет суть дела, приводить значения констант целесообразно только с той точностью, которая соответствует задачам их использования. Взвешивание газа можно производить в любом сосуде точно известного объема. Для определения плотности жидких и твердых веществ пользуются обычно специальным прибором — пикнометром. Он представляет собой колбочку, снабженную пришлифованной стеклянной пробкой с тонким внутренним капилляром, наличие которого способствует более точному соблюдению постоянства объема при заполнении пикнометра. Объем прибора (включая капилляр) находят взвешиванием его с водой. Пикнометрическое определение плотности жидкости сводится к простому взвешиванию ее в пикнометре. Зная его массу и объем, легко затем найти и искомую плотность жидкости. При определении плотности твердого вещества сначала взвешивают частично заполненный им пикнометр, что дает массу взятого для исследования образца. После этого дополняют пикнометр водой (или какой-либо другой не взаимодействующей с исследуемым веществом жидкостью, плотность которой известна) и снова взвешивают. Разность обоих взвешиваний позволяет определить объем незаполненной жидкостью части пикнометра, т. е. объем взятого для исследования образца. Отсюда уже легко найти и искомую плотность твердого вещества. Для быстрых, но не очень точных определений плотности жидкостей часто пользуются ареометром. Он представляет собой стеклянный поплавок, шкала которого проградуирована в единицах плотности. Отсчет производят по точке шкалы, находящейся на уровне поверхности жидкости. Обычно в лабораториях имеется набор ареометров для различных интервалов плотности. Температура, при которой происходит переход вещества из твердого состояния в жидкое или обратно, большей частью заметно изменяется при наличии в нем примесей. Поэтому ее определение может служить хорошим методом проверки чистоты исследуемого образца. Практически можно идти двумя путями, исходя либо из твердого, либо из жидкого состояния. В первом случае определяется температура плавления исследуемого вещества, во втором — температура его затвердевания (замерзания). Так как результат обоих определений должен быть одинаков, выбор метода зависит от удобства пользования им. Обычно более удобным оказывается определение температуры плавления.
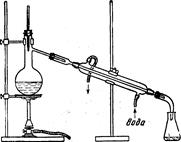
Рис. 4.3. Простейшая установка для перегонки жидкостей.
Рис. 4.4. Простейшая установка для определения температур плавления. При определении температур плавления сравнительно легкоплавких веществ чаще всего пользуются простой установкой, показанной на рис. 4.4. Исследуемое вещество тонко растирают в ступке и полученный порошок набивают в кончик наплавленного с одной стороны тонкостенного стеклянного капилляра. Последний резиновым кольцом прикрепляют к термометру, шарик которого погружают в стакан с какой-либо достаточно высококипящей прозрачной жидкостью. Затем начинают медленно подогревать стакан на маленьком пламени горелки, все время водя вверх и вниз кольцеобразной мешалкой и наблюдая за состоянием вещества в капилляре. Как только его содержимое станет прозрачным, замечают показание термометра. Это и будет температура плавления исследуемого вещества. Хотя температура кипения и менее чувствительна к влиянию примесей, чем температура плавления (замерзания), ею все же часто пользуются для контроля чистоты вещества. Особенно удобно осуществлять этот контроль при самом процессе очистки жидкостей путем их перегонки (рис. 4.3), так как температура кипения чистой жидкости должна при этом оставаться все время неизменной. Напротив, у загрязненных примесями веществ температура кипения в процессе перегонки обычно изменяется. Таким образом, здесь получаются одновременно два показателя чистоты: само числовое значение температуры кипения и степень его постоянства. Так как температура кипения сильно зависит от внешнего давления (понижаясь по мере его уменьшения), при производстве определении оно должно отмечаться. Если вещество малоустойчиво при нагревании, прямое определение его точки кипения иногда становится невозможным. Между тем знание этой константы желательно для сравнительной (с другими) характеристики данного вещества. В подобных случаях определяют давление его пара при ряде более низких температур (когда вещество еще не разлагается) и строят соответствующую кривую, а затем находят точку кипения путем экстраполяции этой кривой к давлению 760 мм рт. ст. Подобным же образом обычно устанавливают точки кипения высококипящих веществ. Если какое-либо вещество при соответствующем испытании ведет себя как чистое, это еще не значит, что оно совсем не содержит примесей. Действительно, каждый метод контроля чистоты характеризуется определенной чувствительностью к тем или иным загрязнениям. Полученное при пользовании им указание на чистоту исследуемого образца гарантирует, следовательно, только то, что содержание в этом образце примесей меньше некоторого предельного, отвечающего чувствительности избранного метода контроля. Практически не существует абсолютно чистых веществ. Вместе с тем содержание примесей в отдельных образцах может быть весьма различным. Для вырабатываемых химической промышленностью продуктов применяются специальные наименования, обозначающие ту или иную степень их чистоты. Так, содержащий значительное количество примесей продукт носит название «технического». По мере его очистки последовательно получаются следующие торговые сорта: «чистый», «чистый для анализа», «химически чистый». Каждому из них отвечает максимально допускаемое государственным стандартом (ГОСТ) содержание отдельных примесей (в %). В качестве примера ниже приведены требования к серной кислоте:
Химически чистое состояние близко к тому пределу чистоты, до которого можно довести вещество в условиях обычного заводского производства. При необходимости дальнейшей очистки она осуществляется с помощью специальных методик. Для контроля чистоты пользуются при этом каким-либо особенно чувствительным методом (например, спектральным анализом). При контроле чистоты веществ путем определения температуры кипения приходится считаться с возможностью существования азеотропных смесей жидкостей, т. е. смесей, кипящих при постоянной температуре и без изменения своего состава. Наиболее известным примером является азеотропная смесь спирта с водой (96 вес. % спирта). От чистых жидкостей азеотропные смеси отличаются тем, что с изменением давления меняются не только их температуры кипения, но и состав. Требуемая в том или ином случае степень чистоты исходных веществ может быть очень различной: иногда приходится подвергать дальнейшей очистке «химически чистые» продукты, иногда достаточно иметь «технические». Поэтому с практической точки зрения чистота вещества является понятием относительным. Каждая последующая очистка препарата резко повышает его стоимость, поэтому следует избегать пользования материалами более высокой чистоты, чем это необходимо для успешного выполнения проводимой работы. Запросы ряда отраслей техники (полупроводники, атомная энергетика и др.) потребовали получения некоторых простых веществ и их соединений в гораздо более свободном от примесей состоянии, чем это достигалось ранее. Такая глубокая очистка требует разработки не только особых приемов и условий ее проведения, но и особых методов контроля чистоты. Последняя часто суммарно характеризуется «числом девяток» процентного содержания очищаемого вещества. Если ранее «три девятки» (99,9%) во многих случаях считались уже хорошим показателем чистоты, то в настоящее время отдельные вещества могут быть доведены до чистоты в «десять девяток» (т. е. 99,99999999%) и даже более. Свойства тщательно очищенных веществ иногда резко отличаются от обычных для них. Например, очень чистый цинк практически не растворяется в кислотах (тоже очень чистых), а очень чистый хром теряет характерную для него в обычном состоянии исключительную твердость и становится пластичным.
|
|||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-04-05; просмотров: 80; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.137.164.241 (0.05 с.) |
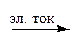 H2SO4 + 2 H2 + O2.
H2SO4 + 2 H2 + O2.