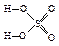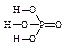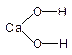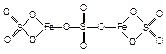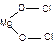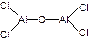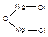Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Химические формулы и уравнения
Дляобозначения состава молекул простых и сложных веществ пользуются химическими формулами. Все молекулы данного вещества одинаковы, поэтому химическая формула выражает состав не только отдельной молекулы, но и всего химического соединения. Химическая формула вещества показывает, из каких элементов состоит данное вещество и сколько атомов каждого элемента входит в состав его молекулы. Химическая формула позволяет вычислить молекулярную массу веществ, а также массу и процентное содержание входящих в его состав элементов. Пример 11. Вычислим процентный состав карбоната калия. Молярная масса M(K2CO3) = 2·39,1 + 12 + 3·16 = 138,2 г/моль. Следовательно, содержание калия равно 56,59% Если известно процентное содержание каждого элемента, входящего в состав данного вещества, можно установить формулу этого вещества. Пример 12. Выведем формулу углеводорода, содержащего 83,72% углерода и 16,28% водорода. Плотность паров этого углеводорода по водороду равна 43. Предположим, что в молекулу этого углеводорода входят x атомов углерода и y атомов водорода, т. е. углеводород имеет формулу CxHy. Масса углерода в этом соединении составит 12·x, а водорода 1·y. Очевидно, соотношение масс углерода и водорода будет равно соотношению процентного содержания этих элементов в углеводороде: 12x: y = 83,72: 16,28 Разделим соответствующие члены этой пропорции на атомные массы углерода и водорода:
Разделим числа в правой части пропорции на меньшее из них — 6,98: x: y = 1: 2,33 а затем умножим числа в правой части пропорции на 3: x: y = 3: 6,99 Из найденного видно, что в исходном углеводороде на 3 атома углерода приходится 7 атомов водорода. Этому условию отвечает ряд соединений: C3H7, C6H14, C9H21 и т. д. Химическая формула, показывающая соотношение атомов в молекуле, выраженное минимальными числами, называется простейшей. Следовательно, C3H7 является простейшей формулой искомого углеводорода. Для нахождения истинной химической формулы соединения необходимо знать его молекулярную массу. По условию задачи плотность углеводорода по водороду равна 43. Следовательно, его молярная масса согласно уравнению М = 2 DH2 будет равна 2·43 = 86 г/моль. Найденная величина вдвое превышает молярную массу, отвечающую простейшей формуле C3H7, следовательно, истинная формула искомого углеводорода C6H14.
Пример 13. Выведем простейшую формулу соединения, содержащего 17,1% кальция, 1,7% водорода, 26,5% фосфора и 54,7% кислорода. Запишем формулу искомого соединения следующим образом: CaXHyPzOv. Принимая во внимание процентный состав соединения, записываем: 40x: y: 31z: 16v = 17,1: 1,7: 26,5: 54,7, и далее: x: y: z: v = x: y: z: v = 0,43: 1,7: 0,86: 3,42. Разделив числа в правой части соотношения на меньшее из них, получим: x: y: z: v = 1: 3,85: 2: 7,95. Полученные данные позволяют заключить, что простейшая формула искомого соединения — CaH4P2O8 или Ca(H2PO4)2. Часто для большей наглядности химические соединения изображают графически, показывая последовательность, в которой атомы соединены друг с другом в молекуле данного вещества. При этом символ каждого элемента снабжается количеством черточек, равным валентности элемента в этом соединении. Изображая те или иные соединения графически, необходимо следить, чтобы все единицы валентности атомов, входящих в молекулу этого соединения, были взаимно насыщены. При графическом изображении молекул кислородсодержащих кислот необходимо помнить, что атомы водорода, способные замещаться металлом, всегда соединяются с кислотообразующим элементом через атом кислорода: H—O—Cl Хлорноватистая кислота Серная кислота Ортофосфорная кислота В молекулах оснований гидроксо-группа ОН всегда присоединяется к атому металла посредством атома кислорода Na—O—H Гидроксид натрия Гидроксид кальция Ниже приведены графические формулы сульфата железа (III) Fe2(SO4)3 (а), гипохлорита магния Mg(OCl)2 (б), оксохлорида магния Mg2OCl2 и оксохлорида алюминия Al2OCl4 (г):
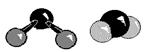
a б в г Графическое изображение формул не всегда отражает действительное расположение и связи атомов в молекуле вещества. Поэтому нельзя отождествлять графическое изображение со структурной формулой. С помощью пространственных моделей можно наглядно представить связи между атомами и их взаимное расположение. Шаро-стержневые модели молекул делают наглядным относительное положение атомов в пространстве, но не соответствуют действительному соотношению атомных радиусов и длин химических связей.
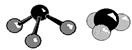
Масштабные пространственные модели молекул, сделанные на усечении шаров (Стюарт, Бриглеб и др.), широко используются для установления возможной степени сближения групп в молекуле. На рис. 2.1приведено несколько способов изображения молекул водорода, воды и аммиака.
Рис. 2.1. Способы изображения молекул. Химические уравнения. Выражение реакции при помощи химических формул называется химическим уравнением. Химические уравнения показывают, какие вещества вступают в химическую реакцию и какие вещества образуются в результате этой реакции. Уравнение составляется на основе закона сохранения массы и показывает количественные соотношения веществ, участвующих в химической реакции. В качестве примера рассмотрим взаимодействие гидроксида калия с фосфорной кислотой: Н3РО4 + 3 КОН = К3РО4 + 3 Н2О. Из уравнения видно, что 1 моль ортофосфорной кислоты (98 г) реагирует с 3 моль гидроксида калия (3·56 г). В результате реакции образуется 1 моль фосфата калия (212 г) и 3 моль воды (3·18 г). Подписав под формулами веществ, принимавших участие в реакции их массы: Н3РО4 + 3 КОН = К3РО4 + 3 Н2О 98 168 212 54 98 + 168 = 266 г; 212 + 54 = 266 гвидим, что масса веществ, вступивших в реакцию, равна массе продуктов реакции. Уравнения химической реакции позволяет производить различные расчёты, связанные с данной реакцией. Пример 14. Определить массу фосфата калия, который получится при нейтрализации фосфорной кислоты гидроксидом калия массой 42 г. В соответствии с приведённым выше химическим уравнением вычислим число молей гидроксида калия пошедшего на нейтрализацию: n(KOH) = 42/56 = 0,75 (моль), следовательно: n(K3PO4) = 1/3n(KOH) = 0,25 (моль), m(K3PO4) = (39·3 + 31 + 16·4)·0,25 = 212·0,25 = 53 г. В уравнении реакции коэффициенты перед газообразными веществами показывают не только соотношение масс реагирующих газов, но и их объёмные соотношения. Это позволяет рассчитать объёмы участвующих в реакции газов непосредственно по уравнению минуя вычисления массы газа. Пример 15. При взаимодействии металлического натрия с водой выделилось 280 мл водорода (при н. у.). Сколько граммов натрия вступило в реакцию? Запишем уравнение реакции взаимодействия натрия с водой: 2 Na + 2 H2O = 2 NaOH + H2 n(H2) = 0,28/22,4 = 0,0125 (моль) = 1/2n(Na) n(Na) = 0,025 моль, m(Na) = 23·0,025 = 0,575 г.
|
||||||||||||||||||
|
Последнее изменение этой страницы: 2021-04-05; просмотров: 58; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 13.58.82.79 (0.024 с.) |
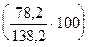 , содержание углерода — 8,68%
, содержание углерода — 8,68% 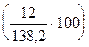 , содержание кислорода — 34,73%
, содержание кислорода — 34,73% 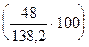 .
.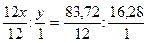 , х: y = 6,98: 16,28
, х: y = 6,98: 16,28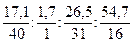 ;
;