Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
О промышленном производстве лекарственных препаратов
Промышленное производство лекарственных пре- паратов включает широкое использование машин, аппаратов, поточных механизированных и автомати- зированных линий. Оно предусматривает массовый, серийный выпуск препаратов по стандартным пропи- сям, рассчитанным на среднего потребителя. Укрупненное фармацевтическое производство со- стоит из комплекса специализированных цехов. Цех — основное производственное подразделение, специали- зированное для выполнения однородных процессов (дробильный, экстракционный, фасовочный и т. д.) или для выпуска однотипной продукции (таблеточный, ам- пульный, аэрозольный и др.). Каждый цех имеет не- сколько участков, где осуществляются однотипные операции, составляющие технологический процесс. Например, таблеточный цех имеет участки смешива- ния ингредиентов, гранулирования, сушки гранулята, прессования и др. Работа промышленных предприятий характери- зуется строгой регламентацией и планированием про- изводства. Производственный процесс проводится в определенных стандартных условиях, предусмотрен- ных точными инструкциями, объединенными в одни сводный документ — регламент. Регламент представ- ляет собой совокупность правил, определяющих по- рядок деятельности фармацевтического предприятия по выпуску готовой продукции. В нем дается харак- теристика исходных продуктов, полуфабрикатов и го- тового продукта, указаны последовательность стадий технологического процесса, режим обработки матери- алов по стадиям, аппаратурная схема, методы анализа, правила по технике безопасности, производственной
Рис. 59. Этапы получения продуктов микробиологического синтеза. гигиене и другие условия производства. Регламент яв- ляется законом производства, отступление от него не- допустимо. За соблюдением регламента следит отдел технического контроля. В фармацевтическом производстве технологиче- ские процессы подразделяются на химические, связан- ные с химическим синтезом лекарственных веществ и физические. К последним относятся механические, связанные с обработкой твердых материалов (из- мельчение, просеивание, смешивание, дозирование, прессование), гидромеханические (перемешивание жидкостей, эмульгирование, фильтрование), тепловые (испарение, конденсация, плавление), массообменные (растворение, кристаллизация, сушка, экстракция, рек- тификация). Все эти процессы требуют соответству- ющего аппаратурного оформления, т. е. выполняются с использованием специальных машин и аппаратов.
Основным исходным материалом для изготовле- ния лекарственных препаратов являются активные фармацевтические субстанции, которые могут быть получены путем химического или биологического синтеза, а также путем переработки лекарственного растительного сырья или тканей и органов животных. Лекарственные препараты имеют определенную лекарственную форму, т. е. удобное для применения состояние. Существуют твердые (порошки, таблет- ки, гранулы), жидкие (растворы, суспензии, эмуль- сии) и мягкие (мази, суппозитории) лекарственные формы. Этапы химического синтеза определенного лекарственного вещества могут включать процессы смешивания ингредиентов реакции, их термической обработки, экстракционного или хроматографическо- го разделения продуктов реакции, упаривания, кри- сталлизации, сушки и т. п. Основные этапы микробиологического синтеза антибиотиков, ферментов, органических кислот и т. п. показаны на схеме (рис. 59). Из лекарственного растительного сырья готовят сборы, порошки, настойки, экстракты, а также полу- чают максимально очищенные экстракционные препа- раты или препараты индивидуальных веществ. Из животного сырья получают гормоны, фермен- ты и препараты неспецифического действия. Они мо- гут представлять собой высушенные, обезжиренные и измельченные ткани или экстракты (максимально очищенные или препараты индивидуальных веществ). В основу гомеопатической фармации положен принцип потенцирования (динамизации) — особая технология приготовления гомеопатических лекарств. Сущность этого принципа состоит в том, что процесс включает в себя поэтапное снижение концентрации исходного гомеопатического вещества в носителе (растворе или порошке) в 10 или 100 раз на каждом этапе путем интенсивного встряхивания, растирания и перемешивания. В результате получают препараты, в которых содержание исходной субстанции снижено до ничтожных значений.
Для современной фармацевтической промышлен- ности характерно непрерывное совершенствование и комплексное применение новых технологических подходов, основанных на понимании механизма дей- ствия и фармакологического эффекта лекарственного вещества и направленных к общей цели — созданию более эффективных и безопасных медицинских пре- паратов. Современное фармацевтическое производство требует от персонала понимания смысла и значения каждой ступени технологического процесса и строгого контроля выполнения требований регламента. В связи с этим центральное место в общем направлении раз- вития фармацевтической технологии наряду с химией и биотехнологией принадлежит микробиологии, науч- ный поиск и развитие этих направлений определяют успех развития всей отрасли. Существенная часть требований к качеству фар- мацевтической продукции и к условиям производства контролируется микробиологом: стерильность, ми- кробная контаминация сырья и нестерильных лекар- ственных средств, соблюдение правил производствен- ной гигиены, предусмотренных GMP. Эти требования должны быть хорошо известны всем участникам про- изводственного процесса и неукоснительно соблю- даться с сознанием важности тщательного выполне- ния каждого из них. С появлением фармацевтических препаратов, по- лучаемых с использованием методов генетической ин- женерии, более 80% стерильных лекарственных форм готовят асептично, поскольку эти вещества лабильны и не могут быть простерилизованы в готовом виде. Лекарственные препараты, приготовленные с исполь- зованием асептичной технологии, превосходят по сво- ему качеству препараты, производимые ранее. Техникой работы в асептичных условиях должны владеть не только микробиологи, но и химики, а также весь персонал, от которого зависит выпуск микробио- логически безопасной продукции.
Производство антибиотиков
Получение препаратов антибиотиков − сложный и многоступенчатый процесс. Он слагается из ком- плекса последовательных исследований, которые мож- но свести в основном к следующим этапам: 1) изыскание микроорганизмов-антагонистов в природе и выделение их в чистую культуру; 2) изучение спектра действия и определение ан- тибиотической активности выделенных культур анта- гонистов; 3) подбор условий культивирования продуцентов антибиотиков; 4) первичная идентификация антибиотика на ран- них этапах изучения; 5) выделение и химическая очистка активно действующего начала из культуральной жидкости и клеток, а также сравнение полученного антибио- тика по биологическим и химическим показателям с уже известными препаратами для выявления новых свойств полученных веществ; 6) изучение механизма действия и испытание ток- сических и лечебных качеств антибиотиков на живот- ных; 7) разработка технологии получения антибиотика в лаборатории и внедрение ее в промышленное произ- водство; 8) получение из исходных штаммов новых гено- типов микроорганизмов, обладающих повышенной активностью, путем мутаций и рекомбинаций метода- ми генетической и клеточной инженерии (рис. 60). Для получения новых антибиотиков помимо изы- скания новых или генетически измененных продуцен- тов используют следующие методические подходы:
1) получение из исходного антибиотика препара- та с новыми свойствами путем химической или био- химической модификации его молекулы; 2) направленный биосинтез путем биохимиче- ской модификации структуры, полученной химиче- ским методом; 3) химический синтез с использованием природ- ных структур в качестве шаблонов; 4) мутасинтез. Этот метод включает следующие этапы: а) получение мутантов — идиотрофов, требу- ющих для образования антибиотика определенный фрагмент его молекулы (предшественник); б) получение химическими методами аналога этого предшественника (мутасинтона); в) культивирование идиотрофа на среде, содержа- щей мутасинтон. При этом идиотроф включает мута- синтон в молекулу продуцируемого им антибиотика. В результате получаются новые (мутасинтетические) структуры. 5) Получение гибридных антибиотиков, т. е. ве- ществ, продуцируемых генетическими гибридами; ги- бридный антибиотик может содержать структуры двух различных метаболитов. От антибиотиков, получаемых перечисленными выше методами, они отличаются тем, что представляют собой продукт комбинации генов. Основные этапы получения гибридных антибио- тиков: а) выбор продуцента, образующего известный антибиотик; б) изыскание нового микроорганизма для гибри- дизации; в) исследование биохимических путей синтеза антибиотика, интермедиатов и ферментов; г) определение генов, контролирующих образова- ние ферментов биосинтеза и его регуляторов; д) получение рекомбинантной ДНК, содержащей комбинацию генов, благоприятную для процесса био- синтеза; е) клонирование новой генетической структуры в культуре реципиента; ж) химическое, микробиологическое и фармако- логическое исследование нового антибиотика. Природные антибиотики получают путем культи- вирования микроорганизма — продуцента с использо- ванием методов биотехнологии. По объему выпускае- мых антибиотиков антибиотическая промышленность является самым крупным биотехнологическим произ- водством. Цель любой биотехнологии — на базе понимания физиологических и генетических свойств продуцента
Рис. 60. Аппаратно-технологическая схема периодического культивирования микроорганизмов в стерильных условиях: 1 — реактор для приготовления питательной среды; 2 — насос; 3 — нагреватель среды — стерилизационная колонка; 4 — выдерживатель; 5 — охладитель среды; 6 — индивидуальный фильтр воздуха; 7 — посевной ферментатор; 8 — рабочий ферментатор; 9 — мерник. вода; --------- пар; воздух
получить максимальный выход конечного продукта. Необходимые для этого биотехнологические мани- пуляции реализуются в соответствующей аппаратуре (рис. 60). Управление процессами метаболизма про- дуцента может осуществляться следующими спосо- бами: 1) изменением состава питательной среды; 2) изменением условий внешней среды (темпера- тура, рН, аэрация); 3) конструкцией биореактора (ферментера); 4) регламентированием введения дополнительно- го субстрата; 5) фиксацией физиологического состояния куль- туры применением метода непрерывного культивиро- вания; 6) использованием генетически модифицирован- ных штаммов продуцента. Реализация этих способов требует специальных инженерно-технологических подходов, обеспечиваю- щих биохимическую регуляцию биосинтеза при со- хранении свойств популяции продуцента (отсутствие повреждений клеток, автолиза, инфекции и др.). Ферментация антибиотиков (рис. 61), как правило, аэробный процесс, требующий подачи воздуха в фер- ментационную среду и перемешивания.
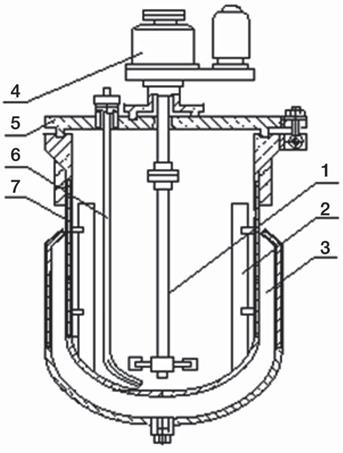
Рис. 61. Ферментатор. 1 — мешалка одноярусная; 2 — отражательная перегородка; 3 — рубашка; 4 — привод мешалки; 5 — крышка; 6 — труба для подачи воздуха (барботер); 7 — корпус. В антибиотической промышленности пре- имущественно применяют биореакторы объемом от 30 до 200 м3 с механической мешалкой, снабжен- ные системой автоматического контроля и управления процессом ферментации. Температуру ферментации (обычно 24-26°C) обеспечивает система охлаждения. После ферментации биомассу отделяют, антибиотик выделяют из фильтрата (для некоторых антибиоти- ков — из клеток продуцента) путем экстракции, ио- нообмена, ультрафильтрации, осаждения и кристал- лизации. Процесс подготовки посевного материала, ферментации и многие из дальнейших операций про- водят в асептических условиях. Культура продуцента. Исходный штамм микро- организма, продуцирующего антибиотик или другие БАВ, выделяют из природных источников (почва, рас- тительные субстраты и др.) специальными методами скрининга; природный (дикий) штамм обладает низ- кой активностью, поэтому требуется длительная ге- нетико-селекционная работа, обычно с применением мутагенов для повышения его активности. Получен- ный производственный штамм хранится в состоянии анабиоза (например, при низкой температуре в лиофи- лизированном состоянии). Такая культура может быть возвращена в активное состояние путем посева на со- ответствующую питательную среду и использована для приготовления посевного материала. Приготовление посевного материала. Культуру с поверхности скошенного агара асептично перено- сят в колбу с посевной средой. При работе с грибами и актиномицетами используют споровый посевной материал (500-5000 спор на 1 л среды). Колбы инку- бируют в термостате на качалке. Материал из колб переносят в инокулятор объемом 0,5-1 м 3 (0,1% по- севного материала от объема среды) и выращивают 1-4 суток. Далее посевной материал асептично пере- носят в посевной ферментатор объемом 5-20 м 3 (10- 12% инокулята от объема питательной среды, время культивирования от 1 суток.). Постоянно отбирают пробы для микробиологического и биохимического ана- лизов. Посевной материал для главной ферментации готовят в количестве 5-10% от объема питательной среды. Ступенчатая подготовка посевного материа- ла позволяет получить его в количестве, необходимом для обеспечения быстрого и продуктивного роста в биореакторе, и поддерживает культуру в фазе лога- рифмического роста.
Питательная среда конструируется, таким обра- зом, чтобы обеспечить быстрый рост микроорганизма в начальной стадии и максимальный выход продукта в конце ферментации. Среду стерилизуют паром под давлением при 120-140°C непосредственно в фермен- таторе или в специальной установке непрерывной сте- рилизации. Ферментация. Схема промышленного периоди- ческого процесса показана на рис. 61. Ферментер и си- стему трубопроводов перед заполнением средой моют, проверяют на герметичность и стерилизуют острым паром. Для обеспечения стерильности часто применя- ют предварительную обработку ферментера химиче- скими дезинфицирующими веществами. Количество стерильной охлажденной питательной среды в ферментере не должно превышать 70% от его объема. Через линию посевного материала с помощью стерильного воздуха в ферментатор вводят посевной материал. Температура и рН питательной среды до по- дачи посевного материала должны быть доведены до оптимальных значений для данной культуры. Ферментацию проводят при аэрации (аэробный процесс) путем подачи стерильного воздуха или без подачи воздуха (анаэробный процесс) и перемеши- вании, которое способствует растворению кислорода в жидкой среде и полному контакту клеток с питатель- ными веществами. Для предотвращения попадания нестерильного атмосферного воздуха в аппарат дав- ление воздуха над поверхностью жидкости повышают до 20-30 кПа (0,2-0,3 кгс/см3). При необходимости вво- дят химические пеногасители. Во время ферментации автоматически регулиру- ются температура и рН среды, по специальной про- грамме вводятся добавочные компоненты питатель- ной среды. Систематически берут контрольные пробы жидкости из ферментатора, в которых определяют необходимые физико-химические показатели, актив- ность и отсутствие посторонних микроорганизмов. Ферментацию прекращают, когда в среде накапли- вается максимальное количество полезного продукта. По окончании ферментации культуральную жидкость охлаждают до 10-25°C и перекачивают в резервуары, из которых она подается на дальнейшую обработку. Способы выделения и очистки антибиотиков ин- дивидуальны и определяются его физико-химическими характеристиками. Например, пенициллин выделяют из культуральной жидкости экстракционным методом (бутилацетатная экстракция), стрептомицин и тетраци- клин — методом ионообменной хроматографии.
Рекомбинантые ДНК
Генетическая инженерия или технология реком- бинантной ДНК основана на конструировании фраг- ментов ДНК in vitro с последующим введением новых (рекомбинантных) генетических структур в живую клетку и их экспрессией. Техника генетической инже- нерии используется при исследовании строения генов организмов, разработке методов генной терапии, мето- дов молекулярной диагностики. Технологию рекомби- нантной ДНК используют для создания новых проду- центов антибиотиков, производящих антимикробные препараты с измененными свойствами. Генетическая инженерия дает возможность получать препараты кро- ви от трансгенных животных, производить белки чело- века путем культивирования рекомбинантных штам- мов микроорганизмов (табл. 20).
|
|||||||||||||||
|
Последнее изменение этой страницы: 2021-04-05; просмотров: 100; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.54.6 (0.027 с.) |