Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Связи, принимающие участие в формировании структуры белкаСодержание книги
Поиск на нашем сайте
Структура большинства белков стабилизируется двумя типами прочных связей (пептидных и дисульфидных) и тремя типами слабых взаимодействий (водородных, гидрофобных и электростатических).
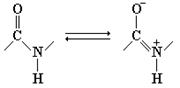
Пептидная связь В структурных формулах пептидов связь между карбонильным углеродом и атомом азота изображается как одинарная, однако на самом деле эта связь носит характер частично двойной связи. Поэтому свободное вращение вокруг нее невозможно, и все четыре атома пептидной связи (рис. 2.1) лежат в одной плоскости.
Рис. 2.1 Резонансная стабилизация пептидной связи придает ей характер частично двойной,чем объясняется заметная жесткость связи между атомами C и N.
Вращение же вокруг остальных связей полипептидного остова, наоборот, достаточно свободное. Эта полужесткость структуры имеет важное значение для формирования более высоких уровней структурной организации белковых молекул.
Межцепочечные и внутрицепочечные поперечные дисульфидные связи Дисульфидные связи образуются между двумя остатками цистеина и «сшивают» два участка одной полипептидной цепи (или соседних цепей). Эта связь остается стабильной даже в тех условиях, при которых белки денатурируют. Обработка белка надмуравьиной кислотой (окисляющей S–S-связи) или b-меркаптоэтанолом (восстанавливающим S–S-связи с регенерацией сульфгидрильных групп) приводит к разделению полипептидных цепей, связанных дисульфидными мостиками.
Стабилизация полипептидов межцепочечными и внутрицепочечными водородными связями Водородные связи образуются: между боковыми цепями аминокислот; между атомами кислорода и водорода (связанного с атомом азотом), принадлежащими пептидным группам остова; между полярными остатками, расположенными на поверхности молекулы белка, и молекулами воды. Все эти взаимодействия играют важную роль в стабилизации вторичной и третичной структур белка. Гидрофобные взаимодействия Неполярные боковые цепи нейтральных аминокислот в белках имеют тенденцию к ассоциации. Стехиометрические соотношения при этом не соблюдаются. Тем не менее эти взаимодействиям играют важную роль в поддержании структуры белка.
Электростатические связи Эти солевые связи возникают между разноименно заряженными группами боковых цепей аминокислот. Например, e-аминогруппа лизина при физиологических рН несет заряд +1, а карбоксильная группа аспартата или глутамата в составе боковой цепи несет заряд -1. Следовательно, эти группы могут электростатически взаимодействовать, стабилизируя структуру белка.
Уровни структурной организации белка
Первичная структура Под первичной структурой понимается последовательность аминокислот в полипептидной цепи (или цепях). Следовательно, первичная структура определяется тем, какие аминокислоты, сколько и в какой последовательности входят в состав полипептидной цепи.
Вторичная структура Этот уровень структурной организации описывет стерические взаимосвязи между расположенными близко друг к другу аминокислотами. Вторичная структура может быть регулярной (a-спираль, складчатый b-слой) или не обнаруживать никаких признаков регулярности (неупорядоченная конформация), но во всех случаях в ее основе лежат водородные связи между карбонильным кислородом одного остатка аминокислоты и водородом, принадлежащим азоту пептидного остова другой аминокислоты.
|
||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 123; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.147.103.33 (0.008 с.) |