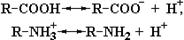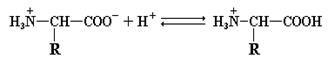Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Общей и экологической биохимииСтр 1 из 13Следующая ⇒
Практикум по Общей и экологической биохимии
Часть I «Аминокислоты. Белки. Выделение и количественное определение белков»
Минск МГЭУ 2002 Авторы:
зав. кафедрой биохимии и биофизики, канд. биол. наук Бокуть С.Б., преподаватель кафедры биохимии и биофизики Ячник Н.Н., доцент кафедры биохимии и биофизики Шейко Л.М. аспирант кафедры биохимии и биофизики Сяхович В.Э.
Рекомендовано Советом Международного государственного экологического университета им. А.Д. Сахарова, № 5 от 21.02.2002г.
Практикум по общей и экологической биохимии. Часть I: «Аминокис-лоты. Белки. Выделение и количественное определение белков» / Бокуть С.Б. и др. – Мн., 2002 – 55 с. Практикум содержит учебно-методические материалы для проведения лабораторных работ по курсу "Общая и экологическая биохимия" со студентами 2-го курса. Для каждой лабораторной работы приводятся основы теории по конкретной теме, вопросы для подготовки к занятию, список рекомендуемой литературы, перечень заданий к занятию, описание используемых в лабораторной работе приборов, материалов и реактивов. Включены материалы, описывающие принципы методов качественного и количественного определения аминокислот, пептидов и белков. Приложение содержит информацию о строении и номенклатуре аминокислот. Все лабораторные занятия написаны авторами настоящего издания совместно. Соответствует учебной программе курса «Общая и экологическая биохимия» для студентов МГЭУ имени А.Д. Сахарова. Практикум рекомендуется для студентов ВУЗов, обучающихся по специальностям медико-биологического профиля.
Ó С.Б. Бокуть, Н.Н. Ячник, Л.М. Шейко, В.Э. Сяхович, 2002 Ó Международный государственный экологический университет им. А.Д. Сахарова, 2002
Содержание
Методические указания к лабораторному практикуму по курсу «Общая и экологическая биохимия» Раздел «Аминокислоты. Пептиды. Белки» Лабораторная работа № 1
Оборудование и материалы: · Термостат · Камера хроматографическая · Бумага хроматографическая · Пипетки стеклянные на 1мл и 5 мл · Микропипетки автоматические · Цилиндры мерные на 250мл и 100мл · Колба емкостью 250мл · Пробирки · Штативы для пробирок · Бумага фильтровальная · Индикаторная бумага универсальная · Сито нейлоновое · Ванночка со льдом
Реактивы: · Яичный белок · Гидроксид натрия (NaOH), 10% раствор, 14.3 М раствор · Сульфат меди (CuSO4), 2% раствор, 0.04М раствор · Ацетат свинца (Pb(CH3COO)2), раствор · Нитрит калия (натрия) (KNO2, NaNO2), 0.5% раствор · Карбонат натрия (Na2CO3), 10% раствор · Нитропруссид натрия (Na2[Fe(CN)5NO]), 10% раствор · Нингидрин, 1% раствор · Реактив Миллона · a-нафтол, 0.2% спиртовой раствор · Сульфониловая кислота, 1% раствор в 5% соляной кислоте
Теоретическая Часть
Аминокислоты
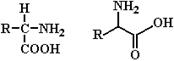
В процессах жизнедеятельности клетки главенствующую роль играют белки – биополимеры, построенные из мономерных единиц – L- a-аминокислот. Биологические свойства белков определяются, в основном, их аминокислотным составом, точнее порядком расположения аминокислот в полипептидной цепи, что в конечном итоге определяет пространственную структуру белка. Основными функциональными группами аминокислот являются их амино- и карбоксильные группы, которые связаны с одним и тем же (a) углеродным атомом (рис. 1.1).
Рис. 1.1 Два варианта изображения структурной формулы аминокислоты.
За исключением глицина, у которого R (см. рис. 1.1) представлен атомом водорода, у всех остальных протеиногенных аминокислот четыре группы, связанные с a-углеродным атомом, различны. Благодаря тетраэдрическому расположению четырех разных заместителей у a-углеродного атома, любая аминокислота (кроме глицина) обладает оптической активностью. При этом одни аминокислоты, входящие в состав белков, являются (при рН 7.0) право-вращающими, а другие – лево-вращающими. Тем не менее, вследствие того, что природные аминокислоты имеют пространственную конфигурацию L-глицеральдегида, все они относятся к L-a-аминокислотам.
Ионные формы аминокислот
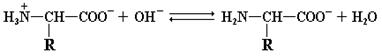
Свободные аминокислоты включают, по крайней мере, две слабоионизованные группы: карбоксильную группу (–СОО¯) и аминогруппу (–NН3+). В растворе эти группы находятся в двух формах, заряженной и незаряженной, между которыми поддерживается протонное равновесие:
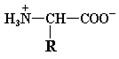
R–COOH и R–NH3+ являются протонированными партнерами, то есть кислотами, а R–COO¯ и R–NH2 – сопряженными основаниями (т.е. акцепторами протонов) соответствующих кислот. Следовательно, структура аминокислоты, изображенная на рис. 1.1, не может существовать в растворе, поскольку одна из указанных групп в той или иной степени ионизирована. Вполне понятно, что суммарный заряд (алгебраическая сумма всех положительных и отрицательных зарядов) аминокислоты зависит от величины рН, то есть от концентрации протонов в растворе. Значение рН, при котором суммарный заряд аминокислоты равен нулю и она не перемещается в постоянном электрическом поле, называется ее изоэлектрической точкой (р I). Такая в целом незаряженная форма аминокислоты носит название цвиттериона. Для алифатических аминокислот цвиттерион имеет следующий вид:
При увеличении или уменьшении рН по отношению к изоэлектрической точке происходит «перезарядка» аминокислоты и она утрачивает форму цвиттериона. В случае подкисления раствора, степень ионизации карбоксильной группы резко падает и аминокислота выступает в роли основания, присоединяя протоны.
При повышении рН происходит обратный процесс: аминокислота, выступая в качестве кислоты, протоны отдает.
Образование пептидных связей
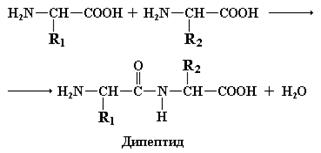
Наиболее важной реакцией, в которой участвуют аминокислоты, является образование пептидных связей. При этом высвобождается одна молекула воды.
Равновесие реакции образования пептидной связи в обычных условиях сильно сдвинуто в сторону ее гидролиза. Поэтому для образования пептидных связей между аминокислотами их карбоксильные группы должны быть предварительно активированы. Химический синтез пептидов основан на предварительном получении хлорангидридов аминокислот. Биологическая активация аминокислот включает их взаимодействие с АТР.
Хроматография на бумаге В настоящее время этот метод в значительной мере вытеснен более совершенными методами, но его продолжают применять для разделения аминокислот. Выделяют восходящую и нисходящую хроматографии на бумаге. При восходящей хроматогафии растворитель заливают на дно хроматографической камеры, а бумагу с нанесенными на нее образцами (см. ход работы) располагают так, чтобы точки старта не были погружены в растворитель. Последний смачивает нижний конец бумаги, и фронт растворителя постепенно поднимается вверх, обеспечивая разделение анализируемых соединений. В нисходящей хроматографии растворитель заливают в специальную лодочку, помещаемую в верхней части камеры. Один из концов бумаги погружают в растворитель и закрепляют придавив, например, стеклянной палочкой, помещенной на дно лодочки. Остальная часть хроматографической бумаги свободно свисает в камере, и растворитель постепенно смачивает ее сверху вниз. Хроматографическая камера плотно закрывается для удержания паров растворителя, которые препятствуют высыханию бумаги. С этой же целью на дно камеры наливают небольшое количество растворителя для усиления испарения. По окончании хроматографии полоску бумаги, смоченную растворителем, извлекают из камеры, высушивают и обрабатывают определенным образом, для проявления разделяемых соединений. При разделении аминокислот бумагу обрабатывают 0.5% раствором нингидрина в ацетоне с последующим прогреванием в течение нескольких минут при 90-110°С. Для разделения аминокислот используют полярные растворители в виде бинарных, тройных и более сложных смесей воды, спиртов, кислот и оснований. Более полярные компоненты растворителя ассоциируют с целлюлозой и образуют стационарную фазу, а менее полярные составляют подвижную фазу. Поэтому разделение аминокислот на бумаге представляет собой вариант распределительной хроматографии. Аминокислоты с объемными неполярными боковыми цепями (Leu, Ile, Phe, Trp, Val, Met) перемещаются быстрее, чем аминокислоты с более короткими неполярными боковыми цепями (Pro, Ala, Gly) или с полярными боковыми цепями (Thr, Glu, Arg, Ser, Asp, His, Lys, Cys). Это обусловлено большей растворимостью полярных молекул в гидрофильной стационарной фазе и неполярных – в органических растворителях. Отметим, что в ряду неполярных аминокислот (Gly, Ala, Val, Leu) при увеличении длины неполярной боковой цепи, увеличивается и подвижность аминокислоты.
Отношение расстояния, на которое перемещается данная аминокислота, к расстоянию, пройденному фронтом растворителя (обе величины определяют от линии старта), называют подвижностью и обозначают символом Rf. Значение Rf для каждой аминокислоты зависит от условий разделения, например, от типа растворителя. Рекомендуется одновременно с неизвестной смесью аминокислот проводить хроматографирование стандартов. В этом случае подвижности компонентов исследуемой смеси можно сравнить с подвижностями стандартов. Для количественного определения каждое пятно вырезают и аминокислоту элюируют (вымывают) подходящим растворителем; затем после добавления нингидрина измеряют оптическую плотность раствора. В другом случае бумагу обрабатывают нингидрином и интенсивность окрашивания пятен измеряют с помощью специального фотометра (денситометра) в проходящем или отраженном свете. При разделении смесей аминокислот часто используют двухмерную хроматографию. В этом случае смесь наносят в один из углов квадратного листа бумаги и проводят разделение в одной системе растворителей. Затем лист извлекают, высушивают, разворачивают его на 90° и хроматографируют в другом растворителе. Данный метод получил наибольшее распространение именно для разделения аминокислот, так как при одномерной хроматографии не всегда удается достичь полного разделения вследствие близких значений Rf у некоторых аминокислот.
Пептиды
Пептиды – это органические молекулы, в состав которых входит несколько аминокислотных остатков, связанных пептидной связью. В зависимости от количества остатков аминокислот и молекулярной массы различают: низкомолекулярные пептиды (состоящие из двух – десяти остатков аминокислот – ди-, три-, тетра-, пентапептиды и т. д.), пептиды со средней молекулярной массой (от 500 до 5000 дальтон, так называемые «средние молекулы») и высокомолекулярные пептиды (с молекулярной массой от 5000 до 16000 дальтон).
Литература 1. Овчинников Ю. А., Биоорганическая химия, «Просвещение», М., 1987 2. Марри Р., Греннер Д., Мейес П., Родуэлл В., Биохимия человека, т. 1, «Мир», М., 1993 3. Степанов В.М., Молекулярная биология: структура и функции белков, под ред. Академика Спирина А.С., «Высшая школа», М., 1996 4. Кнорре Д.Г., Мызина С.Д., Биологическая химия, «Высшая школа», М., 1998 5. Кольман Я., Рем К.-Г., Наглядная биохимия, «Мир», М., 2000
Ход работы Тема I. Тема II. Раздел «Белки» Лабораторная работа № 2
Оборудование и материалы: · Термостат · Пипетки стекляные на 1 мл и 5 мл · Микропипетки автоматические · Цилиндры мерные на 250 мл и 100 мл · Колба емкостью 100 мл и 250 мл · Пробирки стекляные · Штативы для пробирок · Бумага фильтровальная · Индикаторная бумага универсальная · Сито нейлоновое · Воронки стекляные для фильтрации
Реактивы: · Яичный белок · Буферные растворы, рН 1.0, 3.7, 4.7, 5.7, 9.0 · Гидроксид натрия (NaOH), 10% раствор · Хлорид натрия (NaCl), крист. · Хлорид натрия (NaCl), насыщенный раствор · Сульфат аммония ([NH4]2SO4), крист. · Сульфат аммония ([NH4]2SO4), насыщенный раствор · Сульфат магния (MgSO4), крист. · Сульфат меди (CuSO4), 2% раствор · Ацетат свинца (Pb(CH3COO)2), раствор · Желатин, порошок, 0.5% 1% раствор · Казеин, раствор · Уксусная кислота (CH3COOH), 1% раствор · Уксусная кислота (CH3COOH), 10% раствор · Азотная кислота (HNO3), конц., 5% раствор · Серная кислота (H2SO4), конц. · Соляная кислота (HCl), конц. · Трихлоруксусная кислота (ТХУ), 5% раствор · Спирт этиловый (C2H5OH), 96% · Ацетон · Фенол, насыщенный водный раствор · Формалин · Пикриновая кислота, насыщенный раствор · Таннин, 10% раствор · Гексацианоферриат калия (K3[Fe (CN)6]), 5% раствор · Вода дистиллированная
Теоретическая часть
Белки
Все белки являются высокомолекулярными полипептидами. Условную границу между крупными полипептидами и белками провести сложно. Обычно к белкам относят полипептиды с молекулярной массой, превышающей 8000-10000 дальтон. Белки бывают простыми и сложными. К простым белкам относят макромолекулы, состоящие только из аминокислот. Сложные белки включают неаминокислотные компоненты, такие как гем, производные витаминов, липиды, углеводы, атомы металлов и др. Простые белки
Универсальной системы классификации белков не существует. Имеется лишь несколько общеупотребимых систем классификации, частично перекрывающихся между собой. Здесь мы рассмотрим основные принципы классификации белков, основанные на их растворимости, форме молекул, функциях, физических свойствах и особенностях трехмерной структуры.
Растворимость Классификация белков, основанная на их растворимости, была введена в 1907-1908 годах и используется до сих пор (см. табл. 1). Таблица 1 Растворимость наиболее известных типов белков
Строго установленных границ между отдельными классами простых белков не существует. Например, четкое разграничение между альбуминами и глобулинами невозможно, если исходить только из их растворимости в воде и солевых растворах. Поэтому глобулины дополнительно подразделяют на псевдоглобулины, легко растворимые в воде, и эуглобулины, нерастворимые в воде, в отсутствие солей.
Форма молекул Если исходить из оценки соотношения длины осей (продольной и поперечной), можно выделить два больших класса белков. У глобулярных белков это отношение составляет величину, меньшую 10, а в большинстве случаев не превышает 3-4. Такие белки характеризуются компактной укладкой полипептидных цепей. Примером служит инсулин, альбумины и глобулины плазмы крови, многие ферменты. Фибриллярные белки, у которых соотношение длины осей превышает 10, состоят из пучков полипептидных цепей, спирально навитых друг на друга и связанных между собой поперечными ковалентными или водородными связями. Примерами фибриллярных белков служат кератин, миозин, коллаген и фибрин.
Функции Белки также классифицируют в соответствии с их биологическими функциями. В соответствии с этим принципом классификации, белки подраз-деляют на структурные, каталитические и транспортные (см. табл. 2).
Таблица 2 Биологические функции белков
Группу каталитических белков (ферментов), которая включает большинство различных типов белков, подразделяют на классы в соответствии с типом катализируемой ими реакции.
Физические свойства Для ряда белков существуют специальные системы классификации, позволяющие устанавливать различия в пределах семейств сходных белков. Например, широко используются две и обсуждается третья система номенклатуры липопротеинов плазмы. По одной системе липопротеины классифицируют в соответствии с их поведением в электрическом или гравитационном поле. Так на основе электрофоретической подвижности при рН 8.6 различают a1-, a2-, b- и g-липопротеины. Вторая система классификации липопротеинов основана на их плотности в гидратированном состоянии. В этом случае различают хиломикроны, ЛПОНП (липопротеины очень низкой плотности), ЛПНП (липопротеины низкой плотности), ЛПВП (липопротеины высокой плотности), ЛПОВП (липопротеины очень высокой плотности). Возможен и третий тип классификации, основанный на первичной структуре апобелков. В соответствии с этой системой различают шесть классов липопротеинов плазмы крови, характеризующихся присутствием апобелков А, B, C, D, E и F, соответственно. Апобелки можно различать, используя иммунологические критерии.
Трехмерная структура Белки можно разграничивать на основе их трехмерной структуры. Основой для такого принципа классификации белков служит структурное сходство или различие ряда белков, выявляемое, главным образом, с помощью рентгеновской кристаллографии.
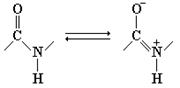
Пептидная связь В структурных формулах пептидов связь между карбонильным углеродом и атомом азота изображается как одинарная, однако на самом деле эта связь носит характер частично двойной связи. Поэтому свободное вращение вокруг нее невозможно, и все четыре атома пептидной связи (рис. 2.1) лежат в одной плоскости.
Рис. 2.1 Резонансная стабилизация пептидной связи придает ей характер частично двойной,чем объясняется заметная жесткость связи между атомами C и N.
Вращение же вокруг остальных связей полипептидного остова, наоборот, достаточно свободное. Эта полужесткость структуры имеет важное значение для формирования более высоких уровней структурной организации белковых молекул.
Гидрофобные взаимодействия Неполярные боковые цепи нейтральных аминокислот в белках имеют тенденцию к ассоциации. Стехиометрические соотношения при этом не соблюдаются. Тем не менее эти взаимодействиям играют важную роль в поддержании структуры белка.
Электростатические связи Эти солевые связи возникают между разноименно заряженными группами боковых цепей аминокислот. Например, e-аминогруппа лизина при физиологических рН несет заряд +1, а карбоксильная группа аспартата или глутамата в составе боковой цепи несет заряд -1. Следовательно, эти группы могут электростатически взаимодействовать, стабилизируя структуру белка.
Первичная структура Под первичной структурой понимается последовательность аминокислот в полипептидной цепи (или цепях). Следовательно, первичная структура определяется тем, какие аминокислоты, сколько и в какой последовательности входят в состав полипептидной цепи.
Вторичная структура Этот уровень структурной организации описывет стерические взаимосвязи между расположенными близко друг к другу аминокислотами. Вторичная структура может быть регулярной (a-спираль, складчатый b-слой) или не обнаруживать никаких признаков регулярности (неупорядоченная конформация), но во всех случаях в ее основе лежат водородные связи между карбонильным кислородом одного остатка аминокислоты и водородом, принадлежащим азоту пептидного остова другой аминокислоты.
A -Спираль
Основными характеристиками a-спирали являются следующие: 1. a-Спираль стабилизируется водородными связями между атомом водорода, у атома азота пептидной группы, и карбонильным кислородом аминокислотного остатка, отстоящего от данной пептидной группы на четыре позиции вдоль цепи. 2. В образовании водородной связи участвуют все пептидные группы. Это обеспечивает максимальную стабильность a-спирали. 3. В образование водородных связей вовлечены все атомы азота и кислорода пептидных групп, что в значительной мере снижает гидрофильность a-спирализованных областей и увеличивает их гидрофобность. 4. a-Спираль образуется самопроизвольно и является наиболее устойчивой конформацией полипептидной цепи, отвечающей минимуму свободной энергии. 5. Правосторонняя a-спираль, обычно обнаруживаемая в белках, намного стабильнее левосторонней. Стабильность a-спирали в значительной степени зависит от аминокислотного состава соответствующего участка полипептидной цепи (табл. 3). Таблица 3 Влияние различных аминокислот на формирование a-спирали
Некоторые аминокислоты препятствуют образованию a-спирали, и в месте их расположения непрерывность a-спирали нарушается. К ним относятся пролин (атом азота пролина является частью жесткой кольцевой структуры, и вращение вокруг связи N - Ca становится невозможным), а также аминокислоты с заряженными или объемными R-группами, которые электростатически или механически препятствуют формированию a-спирали.
Складчатый b -слой Альтернативная упорядоченная вторичная структура белка – складчатый b-слой – была предложена Полингом и Кори. В то время как в a-спирали полипептидная цепь находится в конденсированном состоянии, в складчатом b-слое цепи почти полностью вытянуты. В тех случаях, когда соседние полипептидные цепи складчатого b-слоя идут в противоположных направлениях (за положительное принимается направление от N- к С-концу), структуру называют антипараллельной. Когда соседние цепи идут в одном направлении, структуру b-слоя называют параллельной. Области складчатой b-структуры присутствуют во многих белках, причем встречается как параллельная, так и антипараллельная формы. В формировании таких структур могут участвовать от двух до пяти соседних полипептидных цепей. Во многих белках одновременно присутствуют и a-спирали, и складчатая b-структура. Третичная структура Общее расположение, взаимную укладку различных областей, доменов и отдельных аминокислотных остатков полипептидной цепи называют третичной структурой белка. Четкую границу между вторичной и третичной структурами провести сложно, однако, под третичной структурой понимают стерические взаимосвязи между аминокислотными остатками, далеко отстоящими друг от друга. Важнейшую роль в образовании третичной структуры играют гидрофобные взаимодействия между неполярными радикалами аминокислот, обращенными вглубь молекулы и взаимодействия обращенных наружу полярных групп с молекулами воды, которые окружают полипептид. Таким образом, степень «упакованности» молекулы белка, его конформация зависят от соотношения гидрофобных и гидрофильных аминокислот, а также от степени полярности растворителя. Четвертичная структура
Белки, состоящие из двух и более полипептидных цепей, связанных между собой нековалентными связями обладают четвертичной (олигомерной) структурой. Олигомеры стабилизируются водородными связями и электростатическими взаимодействиями между остатками, находящимися на поверхности полипептидных цепей. Индивидуальные полипептидные цепи, составляющие олигомеры получили название протомеров, мономеров или субъединиц. Многие олигомерные белки состоят из двух или четырех протомеров и называются, соответственно, димерами или тетрамерами. Однако довольно часто встречаются олигомеры, содержащие более четырех протомеров. Это особенно характерно для регуляторных белков. Олигомерные белки играют особую роль во внутриклеточной регуляции: их протомеры способны изменять взаимную ориентацию, что приводит к изменению свойств всего олигомера. Наиболее изученным примером олигомерного белка является гемоглобин. Роль первичной структуры в формировании более высоких уровней структурной организации белков трудно переоценить. Действительно, вторичная и третичная структуры белков, формирующиеся самопроизвольно, определяются последовательностью аминокислот в полипептидных цепях. Эти процессы детерминируются химическими группами, соединенными с a-углеродными атомами аминокислотных остатков. Таким образом, можно сказать, что не существует независимого генетического контроля за формированием уровней структурной организации белков выше первичного, поскольку первичная структура специфически определяет и вторичную, и третичную, и четвертичную структуры. Нативной конформацией белка, по-видимому, следует считать термодинамически наиболее устойчивую структуру в конкретных условиях.
Денатурация Денатурацией называют существенное изменение вторичной и третичной структуры белка, связанное с нарушением, разупорядочиванием нековалентных взаимодействий без разрушения ковалентных связей. Данный процесс наблюдается при воздействии различных физических (нагревание) и химических (кислоты, ионы тяжелых металлов, спирты и т.д.) факторов на растворы белков. При этом белки часто переходят в нерастворимое состояние вследствие аггрегации молекул. В ряде случаев такие изменения являются обратимыми, и при прекращении воздействия молекулы белка возвращаются в свое исходное состояние. При этом растворимость белков восстанавливается. Такой процесс носит название ренатурации белка.
Тепловая денатурация Почти все белки денатурируют при нагревании (исключением является, например, желатин). Этот процесс носит необратимый характер. Температура денатурации для разных белков различна. Присутствие солей и концентрация водородных ионов играют важную роль в тепловой денатурации белков. Наиболее быстрая коагуляция наблюдается в изоэлектрической точке (для большинства белков это слабокислый раствор). В нейтральных и сильнокислых растворах осаждение таких белков происходит значительно хуже, а при высоком рН вовсе не наблюдается (исключение – оснóвные белки). Добавление к раствору белка нейтральных солей облегчает и ускоряет коагуляцию белков при нагревании вследствие дегидратирования белковых молекул. Осаждение белков В растворе молекулы белка вступают во взаимодействие со многими соединениями (кислотами, ионами металлов, спиртами и т.д.), а также конкурируют с ними и друг с другом за молекулы растворителя (воды). Во многих случаях результатом этих процессов является выпадение белков в осадок. Осадки белков можно получить путем обратимого или необратимого осаждения, изменяя параметры факторов, стабилизирующих молекулы белка (температуру, заряд молекулы, величину гидратной оболочки и др.). Концентрированные минеральные кислоты (кроме H3PO4) вызывают необратимое осаждение белков из растворов, что связано как с дегидратацией белковых молекул, так и с денатурацией белка. Избыток минеральной кислоты, за исключением азотной, растворяет выпавший осадок белка, полностью разрушая, «сжигая» белок. Поэтому за осаждением белка при использовании HCl и H2SO4 наблюдают на границе раздела фаз между белковым раствором и кислотой, где химическое воздействие последней минимально. Азотная кислота не разрушает белки, а модифицирует их, поэтому при ее избытке осадок сохраняется и приобретает характерный для нитросоединений желтый цвет. Белки из растворов могут осаждаться органическими кислотами, однако разные органические кислоты неодинаково действуют на белок. Трихлоруксусная (ТХУ) и сульфосалициловая кислоты являются очень чувствительными и специфическими реагентами на белок и, поэтому, находят широкое применение в биохимических лабораториях. ТХУ часто применяется для полного удаления белков из биологических жидкостей (например, из сыворотки крови). При этом продукты их распада остаются в растворе. Это особенно важно в тех случаях, когда нужно отдельно определить азот белка и азот низкомолекулярных соединений: аминокислот, мочевины и др. (так называемый «небелковый азот»). После осаждения белка ТХУ легко удаляется из фильтрата при кипячении, поскольку она разлагается с образованием летучих соединений – хлороформа и угольного ангидрида. Многие органические растворители осаждают белки из нейтрального или слабокислого раствора. При добавлении к водному раствору белка определенной концентрации спирта или ацетона (осаждающие концентрации растворителей различны для разных белков) происходит выпадение белка в осадок. Осаждающее действие этих растворителей определяется дегидратацией молекул белка, что ведет к снижению их устойчивости в растворе. Если процесс осаждения проводить на холоду и полученный осадок быстро отделить от растворителя, то белок может быть снова переведен в раствор в водной фазе. Осаждение белков происходит при использовании некоторых других органических растворителей, например, фенола или формалина. Действие последних вызывает денатурацию белка вследствие дестабилизации водородных связей в молекуле полипептида. Соли тяжелых металлов (Hg+2, Ag+, Cu+2, Pb+2 и др.) вызывают необратимое осаждение белков за счет образования с ними нерастворимых в воде комплексов. В этом случае восстановление исходных свойств белков невозможно даже после удаления солей диализом или в результате сильного разбавления системы водой. Поэтому белки часто применяют в качестве противоядия при отравлении, например, солями ртути (сулема). Тем не менее, некоторые из таких осадков (при действии солей меди, свинца, цинка) растворяются в избытке осадителя вследствие адсорбции ионов металлов на поверхности белковых частиц: в результате этого белковые молекулы приобретают заряд и вновь переходят в раствор. Растворение осадков денатурированных белков при избытке солей тяжелых металлов называется адсорбционной пептизацией.
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 123; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.175.58 (0.154 с.) |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||