Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Добування та властивості фенілдиазоній хлориду ⇐ ПредыдущаяСтр 9 из 9
1. Диазотування аніліну. В невелику конічну колбу помістити ≈1-2 мл аніліну і додавати 10%-ної хлоридної кислоти до повного розчинення аніліну (10-15 мл). Помістити колбу в кристалізатор з снігом (товченим льодом), охолодити розчин до +50С, і краплями, при постійному перемішуванні, додавати із крапельної лійки або бюретки ≈2 мл 10%-ного розчину натрій нітриту. Краплю реакційної суміші нанести на йодокрахмальний індикаторний папір, його посиніння свідчитиме про кінець диазотування. При надлишку натрій нітриту на поверхні йодокрахмального паперу відбуваються реакції:
2NaNO2 + 4HCl + 2KI → I2 + 2NO + 2NaCl + 2KCl + 2H2O; І2 + крохмаль → синя комплексна сполука.
При відсутності забарвлення продовжувати додавати розчин NaNO2, періодично (після кожних 2-3 доданих крапель) наносячи проби суміші на йодокрахмальний папір. Одержаний розчин зберегти (при t ≤ +50C) для наступних дослідів. 2. Гідроліз фенілдиазоній хлориду. Набрати в пробірку 3-4 мл розчину, одержаного в попередньому досліді, і обережно нагріти до початку виділення газу.Записати спостереження та рівняння реакцій. 3. Реакція азосполучення. В окремі пробірки помістити по 0,2 г фенолу і β-нафтолу, додати в кожну по 2-3 мл 10%-ного розчину NaОН, після розчинення обох речовин додати в пробірки по 1-2 мл розчину фенілдиазоній хлориду, одержаного в досліді 4.1. Записати спостереження та рівняння реакцій, користуючись структурними формулами, назвати продукти.
5. Якісна реакція на дифеніламін В пробірку помістити кілька кристалів дифеніламіну, додати ≈1мл концентрованої сульфатної кислоти і краплю дуже розведеної нітратної кислоти. За цих умов дифеніламін окиснюється в інтенсивно синій тетрафенілгідразин:
Реакція використовується в аналітичній хімії для виявлення нітрат-аніонів.
Лабораторна робота № 11. ВЛАСТИВОСТІ КАРБАМІДУ, АМІНОКИСЛОТ ТА БІЛКІВ ЕКСПЕРИМЕНТАЛЬНА ЧАСТИНА Властивості карбаміду 1. Гідроліз карбаміду. Помістити в пробірку 0,5-1 г карбаміду, розчинити його в 4-5 мл води, додати 1-2 мл вапняної води і кип”ятити. Піднести до отвору пробірки червоний лакмусовий папірець Записати і пояснити спостереження (утворення осаду, зміна кольору лакмусу, характерний запах). Написати рівняння реакцій.
2. Реакція карбаміду з нітритною кислотою. В пробірку налити 2-3 мл розведеного (3%-ного) розчину карбаміду, додати рівний об’єм 3%-ного розчину NaNO2 і кілька крапель розведеної сульфатної кислоти. При цьому карбамід повністю розкладається за рівнянням: NaNO2 + H2SO4 → HNO2 + NaHSO4;
NH2 │ 2 HNO2 + C═O →2N2↑ + CO2↑ + 3H2O. │ NH2 Реакція служить для кількісного визначення карбаміду за об’ємом азоту, що виділяється. 3. Оснόвні властивості карбаміду. Впробірку налити 2-3 мл концентрованого розчину карбаміду і додати кілька крапель концентрованої нітратної кислоти. При охолодженні суміші випадає в осад малорозчинна сіль – карбамідамоній нітрат:
O═C + HNO3 → О═С : NH2 NH2. 4. Утворення б і урету. В пробірку помістити ≈0,5 гсухого карбаміду і нагрівати на газовому пальнику. Спочатку кристали плавляться, потім починається інтенсивне виділення газу (запах!). Нагрівання продовжувати до затвердіння розплаву. Охолодити пробірку, додати 3-4мл води і обережно нагрівати до розчинення твердої маси – біурету, що утворюється за схемою: H / H2N–CO–N + H2N–CO–NH2 → H2N–CO–NH–CO–NH2 + NH3↑ \ біурет H До одержаного розчину біурету додати 1-2 мл 10%-ного розчину NaOН і 2-3 краплі 2%-ного розчину CuSO4 та струснути пробірку. При цьому відбуваються реакції: (NH2CONHHCONH2)2 . 2KOH . Cu(OH)2 NH2─CO─NH2 + NH2─CO─NH2 → NH2─CO─NH─CO─NH2 + NH3 біурет
Утворена внутрішньокомплексна сполука надає розчину яскраво-фіолетового кольору.
Властивості амінокислот 1. Кислотно-основні властивості. В окремі пробірки помістити по 0,1-0,2 г аміноацетатної та 2,6-диаміногексанової кислот і краплями додавати води до їх розчинення. Визначити рН одержаних розчинів за універсальним індикатором. Записати і пояснити результати.
2. Утворення внутрішньокомплексних сполук. Помістити в пробірку 0,2-0,3 г аміноацетатної кислоти, додати ≈5 мл води та ≈1 г порошку купрум(ІІ) оксиду і кип’ятити протягом кількох хвилин до забарвлення розчину в яскраво-синій колір в результаті перебігу реакції:
Для виділення комплексної солі в чистому стані треба відфільтрувати суміш від надлишку CuO, фільтрат вилити в фарфорову чашку і нагрівати на водяній бані до початку кристалізації солі. Після охолодження сіль кристалізується у вигляді дрібних голубих голок.
Властивості білків 1. Необоротна денатурація білків при нагріванні. Пробірку з ≈2 мл свіжо-приготованого водного розчину яєчного білка повільно нагрівати над полум’ям пальника до утворення осаду. Додати 3-4 мл води, старанно перемішати. Записати і пояснити спостереження. 2. Дія на білки концентрованих мінеральних кислот. В окремі пробірки налити по ≈1 мл концентрованих сульфатної та нітратної кислот, після чого в кожну пробірку обережно, по стінках, додати рівний об’єм розчину білка. Що спостерігається на поверхні розділу кислота–білок? Струснути пробірки. Записати спостереження. 3. Осадження білків катіонами важких металів. В дві пробірки налити по1-2 мл розчину білка і додавати краплями до утворення осаду: в одну пробірку – 5%-ного розчину купрум(ІІ) сульфату, а в другу – 5%-ного розчину плюмбум(ІІ) ацетату. Що відбувається при додаванні надлишку розчинів солей? Записати спостереження. 4. Висолювання білків. До 1-2 мл розчину білка додавати краплями насичений розчин амоній сульфату до помутніння і наступного випадання білка в осад. Що відбувається при додаванні води? Записати спостереження.
Якісні реакції на білки 1. Біуретова реакція. До ≈3 мл розчину білка додати 1-2 мл 10%-ного розчину NaOН і 2-3 краплі 2%-ного розчину CuSO4. При нагріванні розчину він поступово набуває червоно-фіолетового кольору в результаті утворення комплексних сполук катіонів Cu2+ з пептидними групами білків. 2. Виявлення Сульфуру в білках. До 0,5 мл 1%-ного розчину плюмбум(ІІ) ацетату краплями додавати 10%-ний розчин NaOН до розчинення осаду, який утворюється спочатку. До одержаного розчину додати кілька крапель білка (або 2-3 мл розчину білка), перемішати і обережно кип’ятити протягом 2-3 хвилин. При цьому суміш чорніє, що свідчить про утворення плюмбум(ІІ) сульфіду за рахунок Сульфуру, що входив до складу білка, в результаті перебігу реакцій: Pb(CH3COO)2 + 2 NaOН→ Pb(OН)2↓ + 2 CH3COONa; Pb(OН)2 + 2 NaOН → 2 Na+ + [ Pb(OН)4]2–; [Pb(OН)4]2– + S(білковий) → PbS↓ + 4 ОН– + продукти розкладу білка. 3. Виявлення залишків аренів в складі білків (ксантопротеїнова реакція). До 4-5 мл розчину білка в широкій пробірці (або маленькій конічній колбочці) додавати краплями концентрованої HNO3 до припинення утворення осаду. При подальшому нагріванні осад жовтіє в результаті нітрування ароматичних циклів, що входять до складу білка. Після охолодження розчину до кімнатної температури додавати краплями 10%-ного розчину NaOН до зміни кольору суміші на оранжевий. Записати спостереження.
Лабораторна робота № 12.
|
|||||||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 107; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.133.126.39 (0.013 с.) |


 2 N–H + [O] N–N + H2O.
2 N–H + [O] N–N + H2O.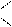
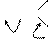 : NH2 +NH3∙NO3–
: NH2 +NH3∙NO3–