Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Очищення та якісний (елементний) аналіз органічних сполукСодержание книги
Поиск на нашем сайте
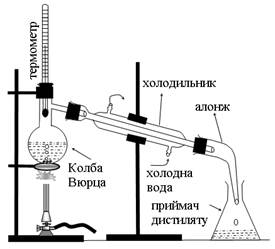
Дослідження будь-якої речовини починається з її виділення із реакційної суміші та очищення. Серед численних методіввиділення та очищення органічних речовин найважливіші: перекристалізація, сублімація (возгонка), перегонка, екстракція та хроматографія. Перекристалізація застосовується для очищення твердих як органічних, так і неорганічних речовин. Для очищення речовини цим методом необхідно підібрати розчинник, який: а) не реагує з очищуваною речовиною; б) значно краще (не менше, ніж в 5 разів) розчиняє очищувану речовину при підвищеній температурі (температурі кипіння), ніж при охолодженні; в) практично не розчиняє домішок навіть в гарячому стані (або, навпаки, легко розчиняє домішки навіть на холоді). Суть методу полягає в тому, що забруднену речовину розчиняють при нагріванні в мінімальній кількості розчинника і гарячий розчин фільтрують від нерозчинних домішок. При охолодженні фільтрату з нього кристалізується вже очищена речовина. Утворені кристали відфільтровують (при цьому легко розчинні домішки залишаються в фільтраті), промивають на фільтрі чистим холодним розчинником і висушують. Сублімацією або возгонкою називають явище безпосереднього переходу речовин із кристалічного стану в газ і навпаки (минаючи рідкий стан).Сублімація є ефективним методом очищення речовин, здатних до такого переходу за певних умов. Перегонка або дистиляція – це метод розділення та очищення рідин, які істотно відрізняються між собою та від домішок за температурою кипіння (Ткип). Суть методу: суміш рідин (або забруднену рідину) нагрівають до кипіння в колбі для перегонки (рис.1.1), скеровуючи пару через холодильник, де вона конденсується, в приймач очищеної рідини (дистиляту). При цьому в першу чергу випаровується і відганяється компонент з найнижчою Ткип, після чого рідина в колбі нагрівається до вищої температури, при якій кипить і переганяється наступний за значенням Ткип компонент. Таким способом достатньо ефективно можна розділити багатокомпонентну суміш рідин, які значно (не менше, ніж на 200С) відрізняються за значенням Ткип. Для ефективного розділення рідин, у яких ∆Ткип < 20 0С, застосовується технічно складніший варіант перегонки – ректифікація. З метою зниження температури перегонки термічно нестійких або висококиплячих рідин перегонку проводять при зниженому тиску (в вакуумі) або з водяною парою. Кожній чистій речовині властиві певні значення її фізичних констант – Тпл, Ткип, густини, показника заломлення світла тощо. Збіг експериментально встановлених значень цих констант з літературними даними для цієї речовини свідчать про її високу чистоту. Свідченням високої чистоти невідомої речовини є дуже вузький (0,5÷1 0С) інтервал її плавлення або кипіння. Склад та будову такої речовини можна встановити шляхом її якісного, кількісного та функціонального аналізу. Мета якісного аналізу речовини – встановити, які елементи входять до її складу. В органічних сполуках всі атоми міцно зв’язані ковалентними зв’язками, тому зразок досліджуваної органічної сполуки спочатку нагрівають з сильними окисниками або відновниками; при цьому утворюються прості неорганічні молекули або йони, які виявляють відомими методами неорганічної хімії. Для встановлення присутності в органічній сполуці Карбону та Гідрогену („відкриття Карбону та Гідрогену”) суміш цієї речовини прожарюють з купрум(ІІ) оксидом в приладі, показаному на рис. 1.2. Помутніння вапняної або баритової води при пропусканні через неї газів, утворених при цьому, свідчить про наявність в них co2, а конденсація водяної пари на стінках пробірки та перетворення безбарвного CuSO4 в забарвлений кристалогідрат – про наявність води. Обидві речовини (co2 та H2O) могли утворитися тільки в реакції (1.1) C x H 2 y + (2 x + y)CuO → x co2 ↑ + y H2O + (2 x + y)Cu, (1.1) що свідчить про наявність в досліджуваній речовині Карбону та Гідрогену. Для виявлення в органічних сполуках Сульфуру або Нітрогену зразок досліджуваної речовини сплавляють з металічним натрієм. При цьому Сульфур органічної сполуки відновлюється до сульфід-аніонів, а Нітроген – перетворюється в ціанід-аніони: 2Na + S орг → 2Na+ + S2– , (1.2) Na + Cорг + Nорг → Na+ + CN–. (1.3) Про утворення сульфід-аніонів свідчить чорний осад, що випадає при додаванні плюмбум(ІІ) ацетату до розчину продуктів реакції (1.2) за рівнянням (1.4) Pb(CH3COO)2 + Na2S → PbS ↓ + 2CH3COONa; Pb2+ + S2– → PbS↓ (1.4) та неприємний запах гідроген сульфіду (сірководню) при його підкисленні: Na2S + 2HCl → H2S↑ + 2NaCl; S2– + 2H+ → H2S↑. (1.5) Якщо ж в речовині був присутній Нітроген, то при додаванні до розчину продуктів реакції (1.3) солі двовалентного заліза утворюється комплексна сіль FeSO4 + 6NaCN → Na4[Fe(CN)6] + Na2SO4, яка з катіонами Fе3+ дає малорозчинну комплексну сіль інтенсивно синього кольору: Na4[Fe(CN)6] + FeCl3 → NaFe[Fe(CN)6]↓ + 3NaCl; Na+ + Fe3+ + [Fe(CN)6]4– → NaFe[Fe(CN)6]↓. Хлор, Бром та Йод в органічних сполуках можна виявити за реакцією Бейльштейна. Для цього мідний дріт прожарюють до зникнення зеленого забарвлення полум’я, після охолодження на нього наносять досліджувану речовину і знову прожарюють в незабарвленому полум’ї газового пальника. Якщо в складі органічної сполуки є перелічені вище галогени, полум’я забарвлюється в інтенсивно зелений колір. При попередньому прожарюванні на поверхні міді утворюється плівка CuO, який реагує з галогеновмісними сполуками за рівнянням: R–Hal + CuO → CuHal2 + CO2 + H2O, де R– вуглеводневий радикал; Hal – Cl, Br, I. Купрум(ІІ)-галогеніди CuHal2 по мірі утворення відновлюються при нагріванні з органічними сполуками до CuHal, які, випаровуючись, і забарвлюють полум’я. ПробаБейльштейна дуже чутлива, але неселективна, її дають і деякі сполуки, які не містять галогенів (нітрили, карбамід тощо). Однозначно присутність будь-якого галогена можна встановити сплавленням речовини з металічним натрієм і наступним визначенням в розчині продуктів цієї реакції йонів F–,Cl–, Br– та I– звичайними методами.
ЕКСПЕРИМЕНТАЛЬНА ЧАСТИНА 1. Перекристалізація бензойної кислоти В пробірку помістити ≈0,5 г забрудненої бензойної кислоти, додати 5-6 мл води і обережно нагріти суміш до кипіння. Гарячий розчин негайно відфільтрувати через попередньо приготований складчастий фільтр, залишок на фільтрі промити 2-3 мл гарячої води. Фільтрат розділити в дві пробірки. Одну пробірку залишити в штативі, другу охолодити під струменем холодної води з-під крана. Чи однакові кристали утворюються в обох пробірках? Кристали відфільтрувати і залишити сохнути на фільтрі, записати спостереження. Возгонка нафталіну Хімічну склянку (або фарфорову чашку) з невеликою кількістю (≈0,5÷1,0 г) нафталіну помістити на кільце, закріплене в штативі у витяжній шафі, накрити колбою з холодною водою і обережно нагрівати чашку (не допускаючи плавлення нафталіну) на газовому пальнику. Через кілька хвилин (після початку кристалізації нафталіну на холодній поверхні колби) припинити нагрівання, записати спостереження (колір, форму кристалів тощо).
3. Перегонка та визначення температури кипіння рідин Колбу для перегонки (рис. 1) на ≈2/3 її об’єму наповнити 40-50%-ним водним розчином органічної рідини з ТКИП від 500С до 800С, найкраще ацетону (ТКИП = 560С) або метанолу (ТКИП = 64,70С), помістити в колбу 1-2 кусочки пемзи або битого фарфору (для чого?), закрити колбу пробкою з термометром так, щоб ртутна кулька термометра була на 0,5 см нижче від отвору відвідної трубки. Приєднати до колби холодильник з алонжем і підкласти під алонж колбу – приймач дистиляту. Включити подачу води для охолодження холодильника, і нагрівати колбу з рідиною на газовому пальнику через асбестовану залізну сітку. Нагрівання перегонної колби повинно бути таким, щоб швидкість перегонки не перевищувала 1-2 краплі дистиляту за 5 секунд. Слідкувати за змінами температури пари в процесі перегонки і пояснити їх, встановити Ткип рідин, що переганялись.
Рис.1. Прилад для перегонки
|
||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 196; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.220 (0.007 с.) |