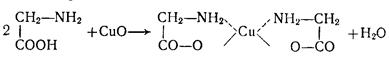Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Міністерство освіти і науки України. Міністерство освіти і науки УкраїниСодержание книги
Поиск на нашем сайте
Міністерство освіти і науки України Національний університет водного господарства та природокористування Кафедра хімії та фізики
05-06-2 9
МЕТОДИЧНІ ВКАЗІВКИ до виконання лабораторних робіт з навчальної дисципліни „ ОРГАНІЧНА ХІМІЯ ” для студентів за напрямами підготовки 6.090101 «Агрономія», 6.090201 «Водні біоресурси та аквакультура», 6.060101 «Будівництво» (професійне спрямування «Технологія будівельних конструкцій, виробів та матеріалів») денної та заочної форм навчання
Рекомендовано науково- методичною радою НУВГП, протокол №__ від __.__.2013 р.
Рівне - 2013 Методичні вказівки до виконання лабораторних робіт з навчальної дисципліни „Органічна хімія” для студентів за напрямами підготовки 6.090101 «Агрономія», 6.090201 «Водні біоресурси та аквакультура», 6.060101 «Будівництво» (професійне спрямування «Технологія будівельних конструкцій, виробів та матеріалів») денної та заочної форм навчання/ Ф.М.Боднарюк, Г.І.Назарук - Рівне: НУВГП, 2013, - 40 с.
Упорядники: Ф.М.Боднарюк, доцент кафедри хімії та фізики; Г.І. Назарук, ст. викладач кафедри хімії та фізики
Відповідальний за випуск: М.В.Яцков, канд.техн.наук, завідувач кафедри хімії та фізики
© Ф.М.Боднарюк, Г.І. Назарук, 2013 © НУВГП, 2013
ЗМІСТ Стор. Передмова ....................................................................................4 Лабораторна робота № 1. Очищення та якісний (елементний) аналіз органічних сполук……………………….5 Лабораторна робота № 2. Добування та властивості аліфатичних вуглеводнів………………………………………11 Лабораторна робота № 3. Добування та властивості ароматичних вуглеводнів……………………………………...15 Лабораторна робота № 4. Добування та властивості галогено-, гідрокси- та епоксипохідних…………………….17 Лабораторна робота № 5. Властивості фенолів……………20 Лабораторна робота № 6. Добування та властивості аліфатичних альдегідів та кетонів……………………………22 Лабораторна робота № 7. Добування та властивості аліфатичних карбонових кислот та їх похідних……………..25 Лабораторна робота № 8. Добування та властивості ароматичних альдегідів, кетонів та карбонових кислот…….27 Лабораторна робота № 9. Властивості вуглеводів……….29 Лабораторна робота № 10. Добування та властивості амінів…………………………………………………………...32 Лабораторна робота № 11. Властивості карбаміду, амінокислот та білків………………………………………….35 Лабораторна робота № 12. Добування та властивості полімеризаційних та поліконденсаційних високомолекулярних сполук (ВМС)…………………………38 Література ………………………………………………………40
ПЕРЕДМОВА Метою виконання лабораторного практикуму з органічної хімії є: · повніше засвоєння студентами теоретичних знань з найважливіших розділів програми, · набуття студентами навичок роботи з простими лабораторними приладами та хімічним посудом; · виконання дослідів з добування, очищення та дослідження елементного складу та властивостей представників найважливіших класів органічних сполук та полімерів. До виконання дослідів допускаються студенти, які пройшли інструктаж з техніки безпеки та правил роботи в лабораторії органічної хімії та підготувались до виконання даної роботи. Підготовка до кожної роботи включає: § вивчення теоретичного матеріалу за літературою, вказаною після назви кожної роботи; § виконання письмового домашнього завдання; § конспектування експериментальної частини роботи, тобто опису порядку виконання дослідів. Непідготовлені студенти до виконання роботи не допускаються і виконують її після належної підготовки поза основним розкладом за спеціальним графіком під керівництвом чергового викладача. Б езпосередньо після кожного досліду студент повинен в заданій послідовності: § записати в зошит (ніяких чернеток!) спостереження, наприклад, зміну кольору розчину чи осаду, утворення чи розчинення осаду, виділення газу, зміна запаху реакційної суміші тощо; § написати рівняння всіх реакцій, наслідком перебігу яких можуть бути явища, що спостерігаються, з застосуванням структурних формул їх учасників; § в рівняннях під формулами органічних продуктів реакції записати їх назви; § записати обгрунтовані короткі висновки про склад та властивості досліджуваних речовин відповідно до мети досліду, коротко сформульованої в його назві; § в необхідних випадках за вказівкою викладача нарисувати принципову схему використаного в роботі лабораторного приладу. Лабораторна робота вважається виконаною лише за умови, якщо в кінці заняття в зошиті студента записані всі спостереження! Рівняння реакцій та висновки можна записати дома і представити при захисті звіту про виконання лабораторної роботи на наступному занятті. Зошити з належним чином оформленими і захищеними звітами про виконання всіх лабораторних робіт та правильно виконаними всіма домашніми завданнями свідчать про виконання студентами навчального плану і є підставою для їх допуску до складання екзамену.
Лабораторна робота № 1. ЕКСПЕРИМЕНТАЛЬНА ЧАСТИНА 1. Перекристалізація бензойної кислоти В пробірку помістити ≈0,5 г забрудненої бензойної кислоти, додати 5-6 мл води і обережно нагріти суміш до кипіння. Гарячий розчин негайно відфільтрувати через попередньо приготований складчастий фільтр, залишок на фільтрі промити 2-3 мл гарячої води. Фільтрат розділити в дві пробірки. Одну пробірку залишити в штативі, другу охолодити під струменем холодної води з-під крана. Чи однакові кристали утворюються в обох пробірках? Кристали відфільтрувати і залишити сохнути на фільтрі, записати спостереження. Возгонка нафталіну Хімічну склянку (або фарфорову чашку) з невеликою кількістю (≈0,5÷1,0 г) нафталіну помістити на кільце, закріплене в штативі у витяжній шафі, накрити колбою з холодною водою і обережно нагрівати чашку (не допускаючи плавлення нафталіну) на газовому пальнику. Через кілька хвилин (після початку кристалізації нафталіну на холодній поверхні колби) припинити нагрівання, записати спостереження (колір, форму кристалів тощо).
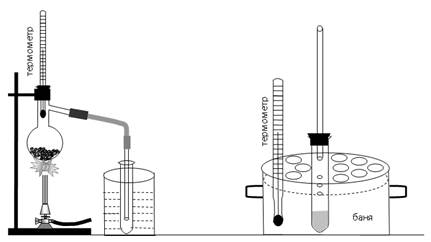
3. Перегонка та визначення температури кипіння рідин Колбу для перегонки (рис. 1) на ≈2/3 її об’єму наповнити 40-50%-ним водним розчином органічної рідини з ТКИП від 500С до 800С, найкраще ацетону (ТКИП = 560С) або метанолу (ТКИП = 64,70С), помістити в колбу 1-2 кусочки пемзи або битого фарфору (для чого?), закрити колбу пробкою з термометром так, щоб ртутна кулька термометра була на 0,5 см нижче від отвору відвідної трубки. Приєднати до колби холодильник з алонжем і підкласти під алонж колбу – приймач дистиляту. Включити подачу води для охолодження холодильника, і нагрівати колбу з рідиною на газовому пальнику через асбестовану залізну сітку. Нагрівання перегонної колби повинно бути таким, щоб швидкість перегонки не перевищувала 1-2 краплі дистиляту за 5 секунд. Слідкувати за змінами температури пари в процесі перегонки і пояснити їх, встановити Ткип рідин, що переганялись.
Рис.1. Прилад для перегонки
ЕКСПЕРИМЕНТАЛЬНА ЧАСТИНА 1. Добування та дослідження властивостей метану
Занурити газовідвідну трубку в заздалегідь приготовану пробірку з 0,5%-ним розчином KMnO4, і нагрівати пробірку з сумішшю на газовому пальнику до інтенсивного виділення газу. Переконавшись, що метан, який утворюється при цьому за рівнянням: Na–O–H + CH3 – COONa → CH4↑+ Na2CO3, не знебарвлює цей розчин, занурити газовідвідну трубку в „бромну воду”.
Рис. 2. Прилад для одержання метану
Заповнену водою пробірку занурити в широку склянку з водою, перевернути догори дном і ввести в неї газовідвідну трубку від приладу для одержання метану, як показано на рис. 2.1б. Після витіснення води з пробірки метаном, не виймаючи пробірку з води, закрити її пробкою. Відкрити пробірку з метаном і піднести до неї запалений сірник. Записати та пояснити спостереження, зробити висновки про хімічні властивості метану.
ЕКСПЕРИМЕНТАЛЬНА ЧАСТИНА 1. Добування бензену В фарфоровій ступці старанно розтерти суміш безводних, попередньо прожарених натрій бензоату та натронного вапна в співвідношенні 1:2. 10-15г одержаної суміші помістити в суху колбу Вюрца, щільно закрити колбу пробкою (можна зі вставленим в неї термометром). До бокового відводу колби приєднати трубку і опустити її в заздалегідь приготовану чисту пробірку-приймач, занурену в склянку з холодною водою, як показано на рис. 3.1. При нагріванні колби з сумішшю на газовому пальнику за рівнянням Na–O–H + C6H5 –COONa → C6H6 + Na2CO3, утворюється бензен, про що свідчить поява характерного запаху та конденсація рідини в пробірці-приймачі.
ЕКСПЕРИМЕНТАЛЬНА ЧАСТИНА Добування бромалканів Зібрати прилад, наведений на рис. 3.1. В колбу Вюрца налити 3 мл етанолу (або пропанолу) і краплями додати 3 мл концентрованої сульфатної кислоти. Занурити колбу в холодну воду, додати в колбу 3мл води, після чого насипати 3г дрібно розтертого калій броміду. Закрити колбу пробкою з термометром, а газовідвідну трубку занурити в пробірку-приймач, в яку заздалегідь налити ≈5мл холодної води. Обережно нагрівати колбу з сумішшю на газовому пальнику до припинення конденсації бромалкана на дні пробірки-приймача. Записати спостереження та рівняння реакцій: утворення алкілсульфату; утворення HBr; утворення бромалкана.
3. Гідроліз галогеналканів В пробірку до 0,5 мл хлороформу додати 2-3 мл 10%-ного розчину NaOH і при неперервному струшуванні нагріти суміш до кипіння. Після охолодження і розшарування суміші піпеткою відібрати частину водного шару в іншу пробірку, підкислити її нітратною кислотою до рН < 7, і додати кілька крапель 1%-ного розчину аргентум нітрату. Записати спостереження та рівняння реакцій.
Розчинність спиртів у воді У встановлені в штативі пробірки налити по 2-3 мл етанолу, пропанолу, н-бутанолу, трет.-бутанолу, пентанолу, етиленгліколю та гліцерину, додати в кожну рівний об’єм води. Записати, які з цих спиртів розчиняються в момент змішування, які – при струшуванні, а які – практично нерозчинні в воді. Пояснити спостереження на підставі складу та будови спиртів.
ЕКСПЕРИМЕНТАЛЬНА ЧАСТИНА Розчинність фенолу в воді Помістити в пробірку 0,5-1 г кристалічного фенолу і додати 3-4 мл води, струснути пробірку кілька разів і поставити в штатив на 2-3 хвилини. При цьому суміш розшаровується на фенол (нижній шар) і розчин фенолу в воді. Обережно нагріти суміш і знову охолодити. Записати і пояснити спостереження.
Кислотні властивості фенолу а)Пробірку з сумішшю із досліду 1 струснути до утворення емульсії і додавати краплями 10%-ний розчин NaОН до повного розчинення фенолу. Записати спостереження, молекулярне та йонно-молекулярне рівняння реакції, назвати продукти. Одночасно в іншу пробірку налити кілька крапель (0,5-0,6 мл) н-бутанолу або пентанолу і також додавати 10%-ний розчин NaОН. Чому в цій пробірці розчин не стає прозорим? б)Через розчин натрій феноляту, одержаний в досліді 3а, пропускати вуглекислий газ з апарату Кіппа до припинення змін. Записати спостереження, молекулярне та йонно-молекулярне рівняння реакції, назвати продукти. Порівняти кислотність спиртів, фенолу та карбонатної кислоти.
Бромування фенолу Набрати в пробірку ≈2 мл розведеного розчину фенолу і краплями при струшуванні додавати бромної води доти, доки рідина в пробірці не набуде жовтуватого відтінку. Записати спостереження та рівняння реакції.
6. Нітрування фенолу В плоскодонну конічну колбочку на 50-100 мл налити 10 мл концентрованої HNO3, додати 4мл води і обережно, краплями при струшуванні колби, додати ≈2 мл рідкого (розплавленого) фенолу. Колбу струшувати ще 2-3 хвилини, після чого продукти реакції вилити в склянку з холодною водою. Записати спостереження та рівняння реакції, назвати продукти.
Лабораторна робота № 6. ЕКСПЕРИМЕНТАЛЬНА ЧАСТИНА 1. Добування альдегідів окисненням первинних спиртів Зібрати прилад, наведений на рис. 3.1. В колбу Вюрца налити ≈10 мл хромової суміші, помістити кілька крупинок пемзи або битого фарфору і додати 3-4 мл етанолу. В пробірку-приймач, поміщену в склянку з холодною водою, налити 2-3 мл води, занурити в неї газовідвідну трубку і обережно нагрівати колбу. Оцтовий альдегід, про утворення якого свідчить характерний запах, збирається в пробірці з водою. Записати спостереження, рівняння реакції, назвати продукти. Розчин альдегіду зберегти для наступних дослідів. Добування ацетону Зібрати прилад, показаний на рис. 3.1. В висушену колбу Вюрца помістити 5-10 г безводного кальцій ацетату, закрити її пробкою з термометром, а газовідвідну трубку занурити в пробірку-приймач, в яку заздалегідь налити 3-4 мл холодної води. Нагрівати колбу на газовому пальнику, спочатку обережно, а потім сильно, до обвуглення солі і виділення летких продуктів. Через кілька хвилин, коли об’єм розчину в пробірці-приймачі збільшиться приблизно вдвічі, припинити нагрівання. Якщо одержаний розчин каламутний, його треба відфільтрувати. Записати спостереження, рівняння реакції. Розчин ацетону зберегти для наступних дослідів.
Якісні реакції на альдегіди 1. Відновлення альдегідами купрум(ІІ) гідроксиду. Налити в пробірку 1-2 мл 10%-ного розчину NaOH і додавати краплями при струшуванні 2%-ного розчину CuSO4 до утворення осаду (помутніння розчину). Додати до суміші 1-2 мл розчину, одержаного формаліну, струснути пробірку, нахилити її і обережно нагрівати на газовому пальнику тільки верхню половину суміші. Нижня половина по можливості повинна залишатись холодною для порівняння. Записати спостереження (зміну кольорів), рівняння реакцій, назвати продукти. 2. Відновлення альдегідами диаммінаргентум(ІІ) гідроксиду (реакція срібного дзеркала). В пробірку, вимиту хромовою сумішшю, лугом і дистильованою водою, налити 3-4 мл 1-ного розчину аргентум нітрату і додавати краплями при струшуванні 5%-ний розчин аміаку до розчинення осаду, який утворюється спочатку. До одержаного розчину додати 1-2 мл формаліну і помістити пробірку в водяну баню, нагріту до 65±50С. Через кілька хвилин записати спостереження та рівняння реакцій.
Реакція з реактивом Фелінга а) Приготування реактиву Фелінга. Змішати в пробірці рівні об’єми (по ≈1-2 мл) приготованих заздалегідь 0,25-молярного розчину CuSO4 та розчину, в 100 мл якого міститься 21 г сегнетової солі і 15 г NaOH. При цьому утворюється комплексна сіль (I) за рівнянням: CuSo4 + 2NaOH → Cu(OH)2 + Na2SO4
Аліфатичні альдегіди при нагріванні руйнують комплекс (І), відновлюючи Сu2+ до Cu2O (червоний або жовтий осад). б) До одержаного в п.а) реактиву Фелінга додати ≈1 мл формаліну і нагрівати пробірку до припинення змін, що спостерігаються. Записати спостереження та рівняння реакції.
Дія лугів на альдегіди В окремі пробірки налити по ≈2 мл оцтового альдегіду або формаліну, додати по 3-4 мл 20%-ного розчину NaOH і обережно нагрівати пробірки на газовому пальнику. Записати спостереження, пояснити, чому в одній з пробірок ніяких змін не спостерігається.
ЕКСПЕРИМЕНТАЛЬНА ЧАСТИНА Карбонових кислот 1. Естерифікація (ацилування) спирту кислотою. В суху пробірку набрати ≈2 мл концентрованої (льодяної) ацетатної кислоти та стільки ж ізоамілового спирту, перемішати їх і додати ≈0,5 мл концентрованої H2SO4. Знову струснути пробірку і обережно нагрівати на газовому пальнику протягом 3-5 хвилин. Після охолодження вилити суміш в склянку з холодною водою. Звернути увагу на зміну запаху, записати спостереження та рівняння реакції, назвати продукти. 2. Естерифікація (ацилування) спирту ацетангідридом. В сухій пробірці змішати 2 мл ацетатного ангідриду з 1 мл етанолу і занурити її на кілька (3-5) хвилин у водяну баню з температурою ≈700С (в склянку з гарячою водою). Додати до суміші рівний об’єм води, визначити рН одержаного розчину за універсальним індикатором, після чого додавати краплями концентрованого розчину соди до відділення шару (крапель) оліїстої рідини. Записати спостереження та рівняння реакції, назвати продукти. 3. Ацилування аніліну ацетангідридом. В конічну колбу об’ємом 25-50 мл налити 10-12 мл води, додати 3-4 мл аніліну і перемішати (струшуванням колби). До утвореної емульсії додати 3-4 мл ацетатного ангідриду і знову енергійно струснути колбу. Записати спостереження та рівняння реакції, назвати продукти.
Їх естерів 1. Взаємодія з бромною водою. В окремі пробірки помістити по ≈1 мл олеїнової кислоти та рослинної олії, додати по 3-4 мл бромної води і сильно струснути. Записати спостереження та рівняння реакцій. 2. Цис-транс-ізомеризація олеїнової кислоти. До 2 мл олеїнової кислоти додати рівний об’єм насиченого розчинунатрій нітрату та 1 мл 20%-ного розчину H2SO4, струснути суміш. Під дією оксидів нітрогену, які утворюються в умовах досліду за схемою: а) NaNO3+H2SO4 → Na2SO4 + HNO3, б) 4 HNO3 → 2NO + 2NO2 + O2 + 2H2O рідка олеїнова кислота (цис-ізомер) ізомеризується в кристалічну елаїдинову кислоту (транс-ізомер). Записати спостереження та рівняння ізомеризації з використанням структурних формул.
Лабораторна робота № 8. ЕКСПЕРИМЕНТАЛЬНА ЧАСТИНА ВЛАСТИВОСТІ ВУГЛЕВОДІВ
ЕКСПЕРИМЕНТАЛЬНА ЧАСТИНА Властивості крохмалю 1. Якісна реакція на крохмаль (йодокрохмальна реакція). Крохмаль утворює з йодом інтенсивно забарвлені комплексні сполуки включення (клатрати): з амілозою – синього, з амілопектином – червоного кольору. В комплексі з амілозою молекули І2 оточені спіраллю, один виток якої включає 6 залишків глюкози. До 2-3 мл 2%-ного розчину крохмалю (крохмального клейстеру) додати 1-2 краплі розчину йоду в водному розчині калій йодиду. Записати спостереження. Нагріти розчин до знебарвлення і знову охолодити. Пояснити зміни забарвлення, які спостерігаються при цьому. 2. Виявлення крохмалю в злаках та коренеплодах. На поверхню свіжорозрізаних картоплини, зерна пшениці чи кукурудзи нанести краплю розчину йоду в водному розчині калій йодиду. Записати та пояснити спостереження. 3. Ферментативний гідроліз крохмалю. На скляній пластинці змішати кілька крапель крохмального клейстеру зі слиною і додати до суміші 1-2 краплі розчину йоду в водному розчині калій йодиду. Спостерігати за зміною забарвлення суміші протягом кількох хвилин, записати та пояснити спостереження. 4. Гідроліз крохмалю в присутності мінеральних кислот. В конічну колбу на 50-100 мл налити 20-25 мл 2%-ного розчину крохмалю, додати 1-2 мл 20%-ної H2SO4 і нагрівати на електроплитці. Через кожні 2 хвилини відбирати піпеткою по 3-4 краплі суміші в окремі пробірки з краплею розчину йоду в водному розчині калій йодиду, занурені в холодну воду. Спостерігати, записати і пояснити поступову зміну забарвлення проб при їх взаємодії з розчином йоду. Після того, як чергова проба залишиться безбарвною, реакційну суміш покип’ятити ще кілька хвилин, відібрати в чисту пробірку 2-3 мл суміші, додати 5 мл 10%-ного розчину NaOH, і 5-6 крапель 1%-ного розчину CuSO4. Струснути пробірку і обережно нагріти до кипіння. Записати і пояснити спостереження, написати схему поступового гідролізу крохмалю. 5. Розчинення целюлози в гексаммінкупрум(ІІ) гідроксиді (реактиві Швейцера) Приготування реактиву Швейцера. До 10 мл насиченого розчину CuSO4 додати рівний об’єм 20%-ного розчину NaOH, утворений осад кілька разів промити водою. Злити по можливості воду з осаду і поступово, невеликими порціями, додавати 25%-ного розчину аміаку до розчинення осаду. Дослід. Налити в пробірку 4-5 мл прозорого розчину [Cu(NH3)6](OH)2, занурити в нього смужку фільтрувального паперу або трошки вати і перемішати суміш скляною паличкою. Записати спостереження. Через кілька хвилин частину розчину вилити в склянку з 10 мл 20%-ної хлоридної кислоти і добре перемішати. Записати і пояснити спостереження. Для чого використовуються мідно-аміачні комплекси у виробництві?
ЕКСПЕРИМЕНТАЛЬНА ЧАСТИНА Властивості аніліну 1. Утворення солей аніліну з мінеральними кислотами. В дві окремі пробірки набрати по 3-4 краплі аніліну. В одну пробірку додавати краплями розчин 10%-ної HCl до розчинення аніліну, а в другу – вдвічі більше крапель 10%-ної H2SO4. Записати спостереження та рівняння реакцій, назвати продукти. 2. Бромування аніліну. До 2-3 мл бромної води додавати краплями анілін до знебарвлення. Записати спостереження та рівняння реакції, назвати продукти. 3. Дія хромової суміші на анілін (утворення барвника”аніліновий чорний”). До ≈3 мл водного розчину аніліну додати кілька крапель хромової суміші, записати послідовні зміни забарвлення реакційної суміші. 4. Реакція аніліну з формаліном. В хімічну склянку на 50 мл помістити 3-4мл аніліну, додати 3-4 мл 40%-ного формаліну і 4-5 крапель концентрованої (с% ≥80%) ацетатної кислоти. Через 2-3 хвилини утворюється біла тверда речовина внаслідок перебігу наступної реакції: С6H5NH2 + H─CO─H → C6H5N = CH2 + H2O Записати спостереження та рівняння реакцій.
ЕКСПЕРИМЕНТАЛЬНА ЧАСТИНА Властивості карбаміду 1. Гідроліз карбаміду. Помістити в пробірку 0,5-1 г карбаміду, розчинити його в 4-5 мл води, додати 1-2 мл вапняної води і кип”ятити. Піднести до отвору пробірки червоний лакмусовий папірець Записати і пояснити спостереження (утворення осаду, зміна кольору лакмусу, характерний запах). Написати рівняння реакцій. 2. Реакція карбаміду з нітритною кислотою. В пробірку налити 2-3 мл розведеного (3%-ного) розчину карбаміду, додати рівний об’єм 3%-ного розчину NaNO2 і кілька крапель розведеної сульфатної кислоти. При цьому карбамід повністю розкладається за рівнянням: NaNO2 + H2SO4 → HNO2 + NaHSO4;
NH2 │ 2 HNO2 + C═O →2N2↑ + CO2↑ + 3H2O. │ NH2 Реакція служить для кількісного визначення карбаміду за об’ємом азоту, що виділяється. 3. Оснόвні властивості карбаміду. Впробірку налити 2-3 мл концентрованого розчину карбаміду і додати кілька крапель концентрованої нітратної кислоти. При охолодженні суміші випадає в осад малорозчинна сіль – карбамідамоній нітрат:
O═C + HNO3 → О═С : NH2 NH2. 4. Утворення б і урету. В пробірку помістити ≈0,5 гсухого карбаміду і нагрівати на газовому пальнику. Спочатку кристали плавляться, потім починається інтенсивне виділення газу (запах!). Нагрівання продовжувати до затвердіння розплаву. Охолодити пробірку, додати 3-4мл води і обережно нагрівати до розчинення твердої маси – біурету, що утворюється за схемою: H / H2N–CO–N + H2N–CO–NH2 → H2N–CO–NH–CO–NH2 + NH3↑ \ біурет H До одержаного розчину біурету додати 1-2 мл 10%-ного розчину NaOН і 2-3 краплі 2%-ного розчину CuSO4 та струснути пробірку. При цьому відбуваються реакції: (NH2CONHHCONH2)2 . 2KOH . Cu(OH)2 NH2─CO─NH2 + NH2─CO─NH2 → NH2─CO─NH─CO─NH2 + NH3 біурет
Утворена внутрішньокомплексна сполука надає розчину яскраво-фіолетового кольору.
Властивості амінокислот 1. Кислотно-основні властивості. В окремі пробірки помістити по 0,1-0,2 г аміноацетатної та 2,6-диаміногексанової кислот і краплями додавати води до їх розчинення. Визначити рН одержаних розчинів за універсальним індикатором. Записати і пояснити результати. 2. Утворення внутрішньокомплексних сполук. Помістити в пробірку 0,2-0,3 г аміноацетатної кислоти, додати ≈5 мл води та ≈1 г порошку купрум(ІІ) оксиду і кип’ятити протягом кількох хвилин до забарвлення розчину в яскраво-синій колір в результаті перебігу реакції:
Для виділення комплексної солі в чистому стані треба відфільтрувати суміш від надлишку CuO, фільтрат вилити в фарфорову чашку і нагрівати на водяній бані до початку кристалізації солі. Після охолодження сіль кристалізується у вигляді дрібних голубих голок.
Властивості білків 1. Необоротна денатурація білків при нагріванні. Пробірку з ≈2 мл свіжо-приготованого водного розчину яєчного білка повільно нагрівати над полум’ям пальника до утворення осаду. Додати 3-4 мл води, старанно перемішати. Записати і пояснити спостереження. 2. Дія на білки концентрованих мінеральних кислот. В окремі пробірки налити по ≈1 мл концентрованих сульфатної та нітратної кислот, після чого в кожну пробірку обережно, по стінках, додати рівний об’єм розчину білка. Що спостерігається на поверхні розділу кислота–білок? Струснути пробірки. Записати спостереження. 3. Осадження білків катіонами важких металів. В дві пробірки налити по1-2 мл розчину білка і додавати краплями до утворення осаду: в одну пробірку – 5%-ного розчину купрум(ІІ) сульфату, а в другу – 5%-ного розчину плюмбум(ІІ) ацетату. Що відбувається при додаванні надлишку розчинів солей? Записати спостереження. 4. Висолювання білків. До 1-2 мл розчину білка додавати краплями насичений розчин амоній сульфату до помутніння і наступного випадання білка в осад. Що відбувається при додаванні води? Записати спостереження.
Якісні реакції на білки 1. Біуретова реакція. До ≈3 мл розчину білка додати 1-2 мл 10%-ного розчину NaOН і 2-3 краплі 2%-ного розчину CuSO4. При нагріванні розчину він поступово набуває червоно-фіолетового кольору в результаті утворення комплексних сполук катіонів Cu2+ з пептидними групами білків. 2. Виявлення Сульфуру в білках. До 0,5 мл 1%-ного розчину плюмбум(ІІ) ацетату краплями додавати 10%-ний розчин NaOН до розчинення осаду, який утворюється спочатку. До одержаного розчину додати кілька крапель білка (або 2-3 мл розчину білка), перемішати і обережно кип’ятити протягом 2-3 хвилин. При цьому суміш чорніє, що свідчить про утворення плюмбум(ІІ) сульфіду за рахунок Сульфуру, що входив до складу білка, в результаті перебігу реакцій: Pb(CH3COO)2 + 2 NaOН→ Pb(OН)2↓ + 2 CH3COONa; Pb(OН)2 + 2 NaOН → 2 Na+ + [ Pb(OН)4]2–; [Pb(OН)4]2– + S(білковий) → PbS↓ + 4 ОН– + продукти розкладу білка. 3. Виявлення залишків аренів в складі білків (ксантопротеїнова реакція). До 4-5 мл розчину білка в широкій пробірці (або маленькій конічній колбочці) додавати краплями концентрованої HNO3 до припинення утворення осаду. При подальшому нагріванні осад жовтіє в результаті нітрування ароматичних циклів, що входять до складу білка. Після охолодження розчину до кімнатної температури додавати краплями 10%-ного розчину NaOН до зміни кольору суміші на оранжевий. Записати спостереження.
Лабораторна робота № 12. ЕКСПЕРИМЕНТАЛЬНА ЧАСТИНА
В окремі пробірки помістити по ≈0,05-0,1 г дрібпо розтертого порошку бензоїл пероксиду, після чого в одну пробірку налити 1 мл стирену (стиролу), а в другу – метилметакрилату. Закрити кожну пробірку пробкою з вставленою в неї скляною трубкою (зворотним холодильником) і тримати пробірки в водяній бані при 95-1000С до затвердіння (або різкого зростання в’язкості) рідин в пробірках. Охолодити пробірки, записати спостереження та рівняння реакцій, назвати продукти.
ЛІТЕРАТУРА 1. Боднарюк Ф.М., Органічна хімія: Навч. посібник. – Рівне: УДУВГП, 2003, – 138с. 2. Петров А.А., Бальян Х.В., Трощенко А.Т., Органическая химия: Учебник для вузов. – М., Высш. шк., 1981. – 592с.: ил. 3. Потапов В.М., Татаринчик С.Н., Органическая химия: Учебник для техникумов. –М.: Химия, 1980. – 464с., ил.
Міністерство освіти і науки України Національний університет водного господарства та природокористування Кафедра хімії та фізики
05-06-2 9
МЕТОДИЧНІ ВКАЗІВКИ до виконання лабораторних робіт з навчальної дисципліни „ ОРГАНІЧНА ХІМІЯ ” для студентів за напрямами підготовки 6.090101 «Агрономія», 6.090201 «Водні біоресурси та аквакультура», 6.060101 «Будівництво» (професійне спрямування «Технологія будівельних конструкцій, виробів та матеріалів») денної та заочної форм навчання
Рекомендовано науково- методичною радою НУВГП, протокол №__ від __.__.2013 р.
Рівне - 2013 Методичні вказівки до виконання лабораторних робіт з навчальної дисципліни „Органічна хімія” для студентів за напрямами підготовки 6.090101 «Агрономія», 6.090201 «Водні біоресурси та аквакультура», 6.060101 «Будівництво» (професійне спрямування «Технологія будівельних конструкцій, виробів та матеріалів») денної та заочної форм навчання/ Ф.М.Боднарюк, Г.І.Назарук - Рівне: НУВГП, 2013, - 40 с.
Упорядники: Ф.М.Боднарюк, доцент кафедри хімії та фізики; Г.І. Назарук, ст. викладач кафедри хімії та фізики
Відповідальний за випуск: М.В.Яцков, канд.техн.наук, завідувач кафедри хімії та фізики
© Ф.М.Боднарюк, Г.І. Назарук, 2013 © НУВГП, 2013
ЗМІСТ Стор. Передмова ....................................................................................4 Лабораторна робота № 1. Очищення та якісний (елементний) аналіз органічних сполук……………………….5 Лабораторна робота № 2. Добування та властивості аліфатичних вуглеводнів………………………………………11 Лабораторна робота № 3. Добування та властивості ароматичних вуглеводнів……………………………………...15 Лабораторна робота № 4. Добування та властивості галогено-, гідрокси- та епоксипохідних…………………….17 Лабораторна робота № 5. Властивості фенолів……………20 Лабораторна робота № 6. Добування та властивості аліфатичних альдегідів та кетонів……………………………22 Лабораторна робота № 7. Добування та властивості аліфатичних карбонових кислот та їх похідних……………..25 Лабораторна робота № 8. Добування та властивості ароматичних альдегідів, кетонів та карбонових кислот…….27 Лабораторна робота № 9. Властивості вуглеводів……….29 Лабораторна робота № 10. Добува
|
|||||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 95; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.22.130.228 (0.031 с.) |
||||||||||

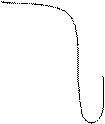


 В фарфоровій ступці старанно розтерти суміш безводних, попередньо прожарених натрій ацетату та натронного вапна в співвідношенні 1:2. Натронним вапном називають суміш натрій гідроксиду з кальцій гідроксидом. Одержаною сумішшю наповнити суху пробірку на чверть її об’єму, щільно закрити пробкою з газовідвідною трубкою і закріпити її в штативі з невеликим нахилом в бік пробки (рис. 2).
В фарфоровій ступці старанно розтерти суміш безводних, попередньо прожарених натрій ацетату та натронного вапна в співвідношенні 1:2. Натронним вапном називають суміш натрій гідроксиду з кальцій гідроксидом. Одержаною сумішшю наповнити суху пробірку на чверть її об’єму, щільно закрити пробкою з газовідвідною трубкою і закріпити її в штативі з невеликим нахилом в бік пробки (рис. 2).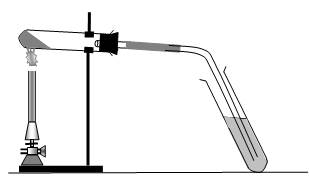
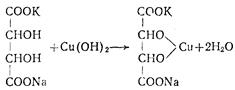
 : NH2 +NH3∙NO3–
: NH2 +NH3∙NO3–