
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ионное произведение воды. Водородный показательСодержание книги
Поиск на нашем сайте
Вода слабый электролит, но некоторая часть молекул ионизируется
Для обратимого процесса запишем константу диссоциации:
где [H+] и [OН–] – концентрации ионов водорода и гидроксид-ионов; Вода диссоциирует очень мало, то концентрацию можно считать величиной постоянной (численное значение равно 55,56 моль/л), тогда
где КW – ионное произведение воды. Произведение концентраций ионов водорода и гироксид-ионов называется ионным произведением воды и численно равно 1 · 10–14 при 22 ° С. Ионное произведение воды – величина постоянная не только для воды, но и для водных растворов. С изменением температуры КW меняется. При комнатной температуре в чистой воде В кислых растворах ● нейтрального ● кислого ● щелочного На практике вместо концентрации ионов водорода используют функцию от этой величины, называемой водородным показателем, или рН. рН – это десятичный логарифм концентрации ионов водорода, взятый с обратным знаком:
Аналогично концентрацию ОН–-ионов можно выразить через показатель рОН.
В нейтральных растворах рН = 7, в кислых рН < 7, в щелочных рН > 7.
14 = рН + роН. (6.8)
Примеры решения задач
Пример 1. Реакция протекает по уравнению: ЗВа2+ + 2РО43– = Ва3(РO4)2↓. Напишите два разных уравнения в молекулярной форме, соответствующих этой реакции. Решение. К ионам в левой части исходного уравнения допишем ионы с противоположным значением заряда с таким коэффициентом, чтобы можно было составить формулы веществ. При этом учитываем, что исходные вещества должны быть достаточно хорошо растворимы в воде. Затем те же ионы с теми же коэффициентами пишем в правой части уравнения:
3Ва2+ + 2РО43– = Ва3(РО4)2↓; 6Cl– + 6Н+ = 6Сl– + 6Н+. Объединяя ионы обоих равенств в молекулы, получим уравнение реакции в молекулярной форме: 3ВаСl2 + 2Н3РО4 = Ва3(РО4)↓ + 6НСl. Аналогично подбираем и другие ионы: 3Ва2+ + 2РО43– = Ва3(РО4)2↓; 6NO3– + 6Na+ = 6NО3– + 6Na+. Получаем второе уравнение в молекулярной форме: 3Ba(NO3)2 + 2Nа3РО4 = Ва3(РО4)2↓+ 6NaNO3. Пример 2. Вычислить ионную силу электролита и активность ионов в растворе, содержащем 0,01 моль/л MgSO4 и 0,01 моль/л MgCl2. Решение. Запишем уравнение диссоциации солей:
Из уравнений в растворе находятся ионы Определим ионную силу электролита по уравнению (9.2), учитывая все ионы, находящиеся в растворе:
Коэффициент активности определяем по формуле –lgf = 0,502 z2(I)1/2 Для ионов для ионов для ионов Находим активность (моль/дм3) по формуле (9.1):
Пример 3. Вычислить концентрацию ионов в растворе: Решение. Запишем уравнения электролитической диссоциации с учетом того, что раствор серной кислоты является сильным электролитом, а угольной слабым. а) б)
Пример 4. Вычислить концентрацию ионов водорода моль/дм3 в растворе с рН = 3. Решение. По формуле (9.6):
Пример 5. Вычислите молярную концентрацию раствора КОН, если рН = 12. Решение. Запишем уравнение диссоциации с учетом того, что это сильный электролит: Определяет концентрацию ионов
9.3. Индивидуальные задания
241. составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия между водными растворами следующих веществ: K2SiO3 и HCl; CdSO4 и Na2S; NH4Cl и Ca(OH)2. Как подразделяются электролиты в зависимости от значения степени диссоциации? 242. Составьте по два молекулярных уравнений реакций, которые выражаются ионно-молекулярными уравнениями:
243. Рассчитайте, при какой концентрации циановодородной кислоты степень диссоциации равна 0,001, если 244. составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия между водными растворами следующих веществ: BaSO4 и HNO3; FeCl3 и KOH. Что такое рН раствора? Определите рН раствора 0,1 М NaОН. 245. Составьте по два молекулярных уравнений реакций, которые выражаются ионно-молекулярными уравнением 246. Водородный показатель одного раствора равен 3, а другого – 6. В литре какого раствора концентрация ионов водорода больше и во сколько раз? Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия между растворами CuSO4 и H2S. 247. Рассчитайте рН 0,05 М раствора NH4OH, если 248. Рассчитайте ионную силу и активность иона 249. Определите массу едкого натрия, растворенного в 200 250. Составьте по два молекулярных уравнений реакций, которые выражаются ионно-молекулярными уравнениями 251. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия между водными растворами следующих веществ: Ca2CO3 и HCl. Чему равны 252. Какое из веществ – 253. Напишите уравнения ступенчатой диссоциации Рb(OH)2 и выражения для констант диссоциации по каждой ступени. Рассчитайте, чему равна степень диссоциации азотистой кислотыв 0,05 М растворе ( 254. Рассчитайте ионную силу и активность иона 255. Вычислите степень диссоциации гидроксида аммония в 0,05 М и 0,5 М растворах при 298 К. Сформулируйтеопределение степени диссоциации и ее зависимость от концентрации электролита. 256. Составьте по два молекулярных уравнений реакций, которые выражаются ионно-молекулярными уравнением: 257. Определите молярную концентрацию раствора муравьиной кислоты (HCOOH), если α = 6 %, 258. Рассчитайте ионную силу и активность всех ионов в растворе слудующего состава: 0,002 М 259. Вычислите рН 0,05 М раствора
260. Определите чему равна константа диссоциации бромноватистой кислоты НBrО, если в растворе с молярной концентрацией эквивалента, равной 0,03
|
|||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 659; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.135.201.101 (0.01 с.) |

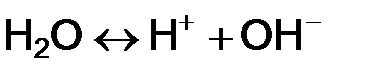 .
.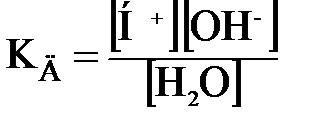 ,
,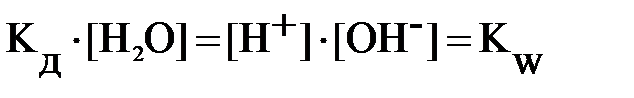 ;
;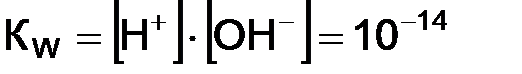 ,
,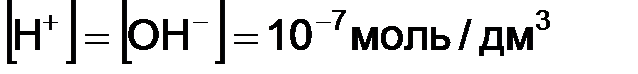 , тогда растворы, в которых
, тогда растворы, в которых 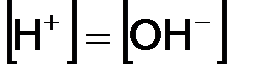 , называются нейтральными.
, называются нейтральными. , в щелочных наоборот. Зная концентрацию одного из ионов воды, можно рассчитать концентрацию второго иона
, в щелочных наоборот. Зная концентрацию одного из ионов воды, можно рассчитать концентрацию второго иона 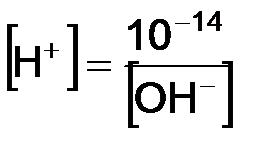 ;
; 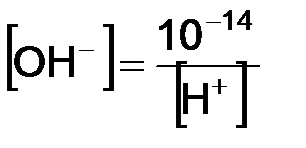 . Таким образом, реакция среды любого водного раствора может быть количественно охарактеризована концентрацией одного из ионов. Так, для растворов:
. Таким образом, реакция среды любого водного раствора может быть количественно охарактеризована концентрацией одного из ионов. Так, для растворов: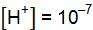 ;
;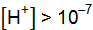 ;
;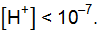
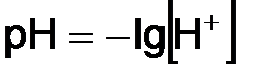 . (9.6)
. (9.6)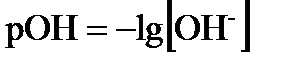 . (9.7)
. (9.7)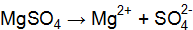 ;
; 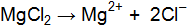 ;
;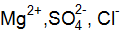 .
.
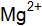 :
: 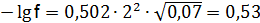 ; f = 0,3;
; f = 0,3;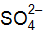 :
: 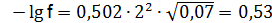 ; f = 0,3;
; f = 0,3;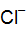 :
:  ; f = 0,74.
; f = 0,74. ,
, 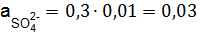 ,
, 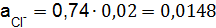 .
.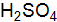 a = 1; б) 0,1 моль/дм3
a = 1; б) 0,1 моль/дм3 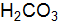 ,
, 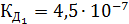 .
.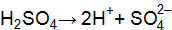 , концентрацию моль/дм3 ионов в сильном электролите можно рассчитать по формуле (9.3):
, концентрацию моль/дм3 ионов в сильном электролите можно рассчитать по формуле (9.3): 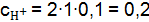 ;
; 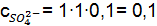 ;
;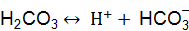 , концентрацию моль/дм3 ионов в слабом электролите можно рассчитать по формуле (9.5):
, концентрацию моль/дм3 ионов в слабом электролите можно рассчитать по формуле (9.5): 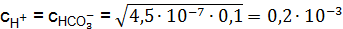 .
.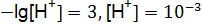 моль/дм3.
моль/дм3.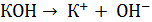 . Концентрация ионов
. Концентрация ионов 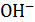 численно равна концентрации электролита, из уравнения из 1 моль КОН образуется 1 моль
численно равна концентрации электролита, из уравнения из 1 моль КОН образуется 1 моль 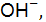 формула (9.8): рОН = 14 – 12 = = 2, откуда
формула (9.8): рОН = 14 – 12 = = 2, откуда 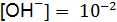 , следовательно
, следовательно 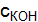 = 0,01 моль/дм3, т.е. раствор является сантимолярным (0,01М).
= 0,01 моль/дм3, т.е. раствор является сантимолярным (0,01М).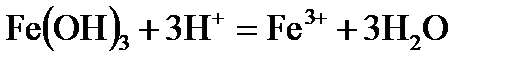 ,
, 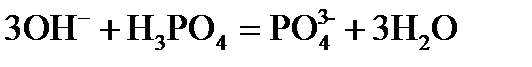 . Какие растворы относятся к сильным, слабым электролитам? Приведите примеры.
. Какие растворы относятся к сильным, слабым электролитам? Приведите примеры.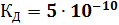 . Что такое степень диссоциации?
. Что такое степень диссоциации?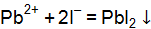 .
. 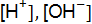 в растворах рН которых равен 2 и 8.
в растворах рН которых равен 2 и 8.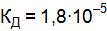 .
. 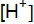 в растворе следующего состава: 0,05 М HCl 0,01 M CaCl2. Напишите уравнения ступенчатой диссоциации Н3ВО3 и выражения для константы диссоциации по второй ступени.
в растворе следующего состава: 0,05 М HCl 0,01 M CaCl2. Напишите уравнения ступенчатой диссоциации Н3ВО3 и выражения для константы диссоциации по второй ступени.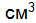 раствора, если рН раствора равен 12. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия между водными растворами следующих веществ Na3PO4 и CaCl2.
раствора, если рН раствора равен 12. Составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия между водными растворами следующих веществ Na3PO4 и CaCl2.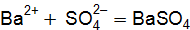 . Найдите массу Ва(ОН)2, содержащегося в 500
. Найдите массу Ва(ОН)2, содержащегося в 500 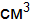 водного раствора, раствора равен 13.
водного раствора, раствора равен 13.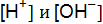 в 0,01 М растворах уксусной кислоты и гидроксида аммония?
в 0,01 М растворах уксусной кислоты и гидроксида аммония?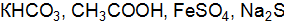 – взаимодействует с раствором серной кислоты? Запишите молекулярные и ионно-молекулярные уравнения этих реакций. Укажите реакцию среды и найдите концентрацию ионов
– взаимодействует с раствором серной кислоты? Запишите молекулярные и ионно-молекулярные уравнения этих реакций. Укажите реакцию среды и найдите концентрацию ионов 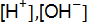 , в растворах рН которых равен 10 и 5.
, в растворах рН которых равен 10 и 5.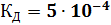 ).
).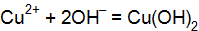 . Чему равна степень диссоциации
. Чему равна степень диссоциации 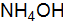 в его 2М растворе, если концентрация ионов
в его 2М растворе, если концентрация ионов 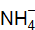 в растворе
в растворе 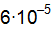
 .
.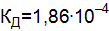 . Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями:
. Составьте молекулярные уравнения реакций, которые выражаются ионно-молекулярными уравнениями: 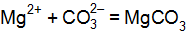 ,
, 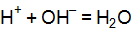 .
.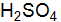 и 0,01 M
и 0,01 M 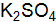 . составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия между водными растворами следующих веществ:
. составьте молекулярные и ионно-молекулярные уравнения реакций взаимодействия между водными растворами следующих веществ: 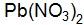
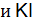 .
.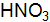 и 0,05 М раствора
и 0,05 М раствора 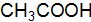 . Объясните различия в значениях. Напишите уравнения ступенчатой диссоциации Н3РО4 и выражения для константы диссоциациипо второй ступени.
. Объясните различия в значениях. Напишите уравнения ступенчатой диссоциации Н3РО4 и выражения для константы диссоциациипо второй ступени.


