
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Способы защиты металлов от коррози
Среди разнообразных методов защиты металлов от коррозии можно выделить следующее: ● легирование металлов, т.е. введение в состав сплава компонентов, снижающих скорость коррозии металла, из-за образования на поверхности прочных защитных пленок, устойчивых к влажной среде и растворам кислот. Для стали такими компонентами являются ● нанесение защитных покрытий –неметаллических (к ним относятся лакокрасочные и полимерные покрытия, масла, смазки, оксидирование, фосфатирование и др.) и металлических. Металлические покрытия по характеру поведения в коррозионной среде делятся на катодные и анодные. Катодное покрытие – это защита металла (изделия) менее активным металлом (например, лужение, никелирования для железа). Такие покрытия защищают только механически, пока не нарушена целостность покрытия. При повреждении образуется гальванический элемент, в котором защищаемый элемент является анодом и разрушается. Анодное покрытие – это защита металла (изделия) более активным металлом (например, цинкование для железа); ● электрохимическая защита – катодная и протекторная защита. При катодной защите отрицательный полюс источника тока подключается к защищаемому изделию, которое становиться катодом и не разрушается, анодом служит вспомогательный электрод (обычно чугунный или стальной лом) подключаемый к положительному источнику тока. Протекторная защита состоит в том, что конструкцию соединяют с протектором – более активным металлом, чем металл защищаемой конструкции (для железа и его сплавов это обычно ● изменение свойств коррозионной среды для снижения агрессивности среды уменьшают концентрацию компонентов опасных в коррозионном отношении. Для защиты от коррозии широко применяют ингибиторы. Это вещества, которые пассивируют поверхность металлов и препятствуют развитию коррозионных процессов. Ингибиторами могут быть как неорганические, так и органические вещества. Например, при добавлении соединений свинца – (CH3COO)2Pb – свинец осаждается на металлической поверхности, обнаженной от оксидной пленки, и прекращает ее растворение: Me0 + Pb2+ = Pb0 + Me2+.
Для длительного хранения изделий применяют ингибиторы органического типа. Обычно это соединения, содержащие азот, серу и кислород. Например, диэтиламин, уротропин, формальдегид. Их применение быстро расширяется. Эти ингибиторы адсорбируются на активных участках металлов и пассивируют их; ● рациональное конструирование – выбор материала иих сочетание должны обеспечить высокую коррозионную устойчивость,а форма узлов и деталей- доступность для быстрой очистки и смазки. Примеры решения типовых задач Пример 1. Железо покрыто хромом, какое это покрытие – катодное или анодное? Расписать коррозионной процесс в кислой среде при нарушении целостности покрытия. Решение. Железо менее активный металл (
на аноде – окисление хрома на катоде – восстановление ионов из среды суммарная реакция:
Пример 2. Как протекает атмосферная коррозия луженого железа? Составьте электронные уравнения анодного и катодного процессов. Решение. Лужение – это нанесение тонкого слоя олова на металлическую поверхность для защиты от коррозии или подготовки металла к пайке. Железо более активный металл (
на аноде – окисление железа на катоде – восстановление суммарная реакция продукты коррозии
Пример 3. Медь не вытесняет водород из разбавленных кислот. Почему? Однако если к медной пластинке, опущенной в кислоту, прикоснуться цинковой, то на меди начинается бурное выделение водорода. Дайте этому объяснение, составив уравнения анодного и катодного процессов. Решение. Медь не взаимодействует с растворами кислот, так как ее стандартный электродный потенциал (
При контакте меди с цинком создается коррозионная гальваническая пара (контактная коррозия), что приводит к увеличению скорости коррозии и к бурному выделению водорода:
на аноде на катоде суммарная реакция: Пример 4. Может ли протекать электрохимическая коррозия свинца в водном растворе при рН 5 и при контакте с воздухом. Дайте этому объяснение, составив уравнения анодного и катодного процессов. Решение. Из прил. 5
Рассчитываем ЭДС предполагаемых элементов:
Составим уравнения катодного и анодного процессов: на аноде – окисление свинца на катоде – восстановление
13.3. Индивидуальные задания
351. Как происходит атмосферная коррозия луженого железа и луженой меди при нарушении покрытия? Составьте электронные уравнения анодного и катодного процессов. 352. В чем заключается сущность протекторной защиты металлов от коррозии? Приведите пример протекторной защиты никеля в электролите, содержащий растворенный кислород. Составьте электронные уравнения анодного и катодного процессов. 353. Почему химически чистое железо является более стойким против коррозии, чем техническое? Рассмотрите коррозию технического железа во влажном воздухе и в кислой среде. Составьте уравнения анодного и катодного процессов. 354. Какое покрытие, на металле называется анодным и какое катодным? Перечислите несколько металлов, которые могут служить анодным и катодным покрытием железа. Распишите коррозионные процессы для анодного и катодного покрытия. 355. В обычных условиях во влажном воздухе оцинкованное железо при нарушении покрытия не ржавеет, тогда как при температуре 70 °С оно покрывается ржавчиной. Чем это можно объяснить? Как протекает коррозия оцинкованного железа в первом и во втором случаях. 356. К какому типу покрытий относится олово на стали и на меди? Какие процессы будут протекать, при атмосферной коррозии луженой стали и луженой меди? 357. Как влияет рН среды на скорость коррозии железа и цинка? 358. Железное изделие покрыли цинком. Какое это покрытие – анодное или катодное? Почему? Какие продукты коррозии образуются при нарушении покрытия во влажном воздухе и соляной кислоте? 359. Чем процесс коррозии хромированной стальной детали будет отличаться от процесса коррозии никелированной? Почему? Составьте электронные уравнения всех процессов. 360. Составьте электронные уравнения анодного и катодного процессов с кислородной и водородной деполяризацией при коррозии пары алюминий – железо. Какие продукты коррозии образуются в первом и во втором случаях?
361. В чем заключается сущность протекторной защиты металлов от коррозии? Приведите пример протекторной защиты железа в электролите, содержащем растворенный кислород. 362. В чем суть катодной защиты стальных труб от коррозии? 363. Какие факторы влияют на скорость химической коррозии? 364. Как теоретически доказать невозможность коррозии металлов? Приведите пример для расчета возможности или невозможности химической коррозии. 365. Почему коррозия в морской воде протекает интенсивнее, чем в речной воде? Приведите схему протекторной защиты стальной детали в морской воде и запишите возможные уравнения процессов. 366. Железное изделие покрыли оловом. Какое это покрытие – анодное или катодное? Почему? Какие продукты коррозии образуются при нарушении покрытия во влажном воздухе и в соляной кислоте. 367. Объясните, почему в атмосферных условиях цинк корродирует, а золото нет. Объяснение подтвердите расчетами. Запишите возможные уравнения процессов. 368. Что такое электрохимичесая защита металлов? Напишите уравнения реакций процессов, протекающих при электрохимической защите стальных труб. 369. Олово спаяно серебром. Какой из металлов будет окисляться при электрохимической коррозии, если процесс протекает в кислой среде? Ответ обоснуйте. Составьте уравнения катодного и анодного процессов. 370. Будет ли корродировать серебро в в деаэрированном (без содержания кислорода) растворе при рН 1? 371. Магний корродирует в морской воде (рН 8) при контакте с воздухом. Составьте уравнения катодного и анодного процессов. 372. Какой металл целесообразней выбрать для протекторной защиты от коррозии свинцовой оболочки кабеля: цинк, магний или хром? 373. Если на стальной предмет нанести каплю воды, то коррозии подвергается средняя часть смоченного металла, а не внешняя. 374. В состав сплава входит магний и марганец. Какой из компонентов сплава будет разрушаться при электрохимической коррозии? Ответ подтвердите уравнениями анодного и катодного процесса коррозии:
375. Приведите примеры двух металлов, пригодных для протекторной защиты железа. Для обоих случаев напишите уравнение электрохимической коррозии в кислой среде. 376. Может ли протекать коррозия стальной детали, покрытой кобальтом в растворе: а) при рН 4; б) при рН 9 в стандартных условиях? Составьте уравнения соответствующих процессов. Что измениться в процессе коррозии, если сплошность покрытия нарушена? 377. Составьте уравнения катодного и анодного процессов электрохимической коррозии с кислородной и водородной деполяризации при коррозии пары магний-железо. 378. Стальное изделие покрыто цинком. Какой из металлов будет окисляться при коррозии, если эта пара находится в нейтральной среде с рН 7? Определите ЭДС гальванического элемента для стандартного состояния. 379. Две железные пластинки, частично покрытые одна оловом, другая медью, находятся во влажном воздухе. На какой из этих пластинок быстрее образуется ржавчина? Почему? Каков состав продуктов коррозии? 380. Приведите примеры катодных и анодных покрытий для кобальта. Как будет протекать атмосферная коррозия при нарушении целостности этих покрытий?
заключение Цель и задачи учебного пособия выполнены. Дан весь необходимый материал в соответствии с программой курса «Химия». Рассмотрены основные положения строения атома, вещества. Сделан акцент на кинетические признаки реакций и их возможности протекания в стандартных условиях. Изучение тем связанных с окислительно-восстановительными процессами позволит студентам понять механизм с коррозионных процессов и возможности воздействия на него. Из всего сказанного можно сделать вывод, что данное пособие поможет студентам заочного обучения при самостоятельном изучении одной из базовых дисциплин.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК Основной 1. Коровин, Н.В. Общая химия [Текст]: учебник для техн. направлений и спецвузов / Н.В. Коровин. – М.: Высш. шк., 2009. – 558 с. 2. Глинка, Н.Л. Общая химия [Текст]: учебник для вузов / Н.Л. Глинка. – Л.: Химия, 2007. – 650 с. 3. Глинка, Н.Л. Задачи и упражнения по общей химии [Текст]: учеб. пособие для вузов / Н.Л. Глинка; под ред. В.А. Рабиновича, Х.М. Рубинной. – М.: Интеграл-Пресс, 2007. – 240 с. 4. Дробашева, Т.И. Общая химия [Электронный ресурс]: учебник / Т.И. Дробашева. – Электрон. дан. и прогр. (диск). – М.: ИД «Равновесие», 2007.
Дополнительный
5. Задачи и упражнения по общей химии [Текст]: учеб. пособие / под ред. Н.В. Коровина. – М.: Высш. шк., 2003. – 255 с. 6. Ахметов, Н.С. Общая и неорганическая химия [Текст] / Н.С. Ахметов. – М.: Высш. шк., 2002. – 743 с. 7. Термодинамические свойства индивидуальных веществ [Текст]: в 4 т. Т. 3: справ. изд. / отв. ред. В.П. Глушко. – М.: Наука, 1981. – 540 с.
ПРИЛОЖЕНИЕ 1 Образцы титульных листов
Министерство транспорта Российской Федерации Федеральное агентство железнодорожного транспорта Федеральное государственное бюджетное образовательное
учреждение высшего образования «Дальневосточный государственный университет путей сообщения» Кафедра «Нефтегазовое дело, химия и экология» КОНТРОЛЬНАЯ РАБОТА по химии
Вариант_________
Выполнил студент ИИФО: Ф.И.О. Шифр:
Проверил: преподаватель: Ф.И.О.
Хабаровск 20___г.
Окончание прил. 1
Министерство транспорта Российской Федерации Федеральное агентство железнодорожного транспорта Федеральное государственное бюджетное образовательное учреждение высшего образования «Дальневосточный государственный университет путей сообщения» Кафедра «Нефтегазовое дело, химия и экология»
Отчет к практической работе по химии Тема «_________________________________»
Выполнил студент ИИФО: Ф.И.О. Шифр: Дата:
Проверил: преподаватель: Ф.И.О.
Хабаровск 20___г.
|
|||||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 590; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.14.150.55 (0.054 с.) |
 и др.;
и др.; и т.д.). В процессе коррозии протектор разрушается, предохраняя от разрушения конструкцию;
и т.д.). В процессе коррозии протектор разрушается, предохраняя от разрушения конструкцию; ), чем хром (
), чем хром ( ), поэтому данное покрытие будет анодным.
), поэтому данное покрытие будет анодным.  ;
;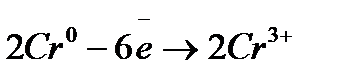 ;
;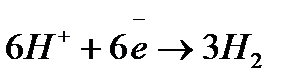 ;
;
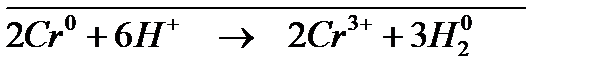 .
. ), поэтому данное покрытие будет катодным. При нарушении целостности покрытия в атмосфере будут происходить следующие процессы:
), поэтому данное покрытие будет катодным. При нарушении целостности покрытия в атмосфере будут происходить следующие процессы: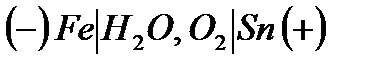
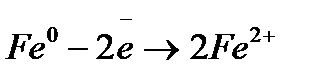 ;
;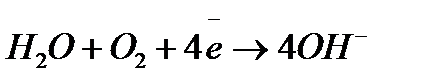 ;
;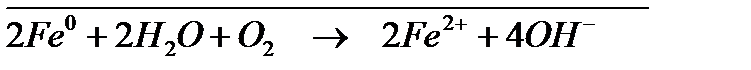 ;
; .
. ), больше чем стандартный потенциал водородного электрода (
), больше чем стандартный потенциал водородного электрода (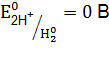 ), поэтому медь по отношению к водороду является менее активным металлом и не может вытеснить водород из раствора кислот.
), поэтому медь по отношению к водороду является менее активным металлом и не может вытеснить водород из раствора кислот. ;
;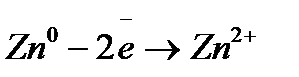 ;
;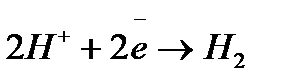 ;
;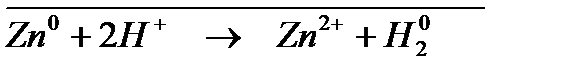 .
.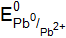 = –0,126 В. По формуле определяем потенциалы окислителей при стандартных условиях.
= –0,126 В. По формуле определяем потенциалы окислителей при стандартных условиях.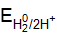 = –0,059×5 = –0,295 В;
= –0,059×5 = –0,295 В; = 1,227 – 0,059 × 5 = 0,923 В.
= 1,227 – 0,059 × 5 = 0,923 В.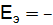 0,295 – (–0,126) = –0,169 В, коррозия с выделением водорода не возможна, так как
0,295 – (–0,126) = –0,169 В, коррозия с выделением водорода не возможна, так как 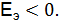
 = 0,923 – (–0,126) = 1,049 В, коррозия с поглощением кислорода возможна, так как
= 0,923 – (–0,126) = 1,049 В, коррозия с поглощением кислорода возможна, так как  .
.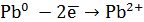 ;
;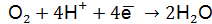 при
при 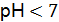 .
. ПРИЛОЖЕНИЕ 2
ПРИЛОЖЕНИЕ 2


