
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Стандартное значение энтропии
Изменение стандартной энтропии химической реакции рассчитываем по формуле (6.8):
Наибольшее значение энтропии соответствует газообразным веществам, поэтому знак Для первой реакции из 4 моль газообразных веществ получили
6.3. Индивидуальные задания
151. Вычислите, какое количество теплоты выделится при восстановлении Fe2O3 металлическим алюминием, если было получено 335,1 г железа. (Ответ 2543 кДж.) 152. Уменьшается или увеличивается энтропия при переходах: 153. Газообразный этиловый спирт можно получить при взаимодействии этилена С2Н4(г) и водяных паров. Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект. (Ответ: –45,76 кДж.) 154. Прямая или обратная реакция будет протекать при стандартных условиях в системе 155. Реакция горения этана выражается термохимическим уравнением 156. При какой температуре наступит равновесие системы 157. На основании стандартных теплот образования и абсолютных стандартных энтропий веществ вычислите энергию реакции гиббса, протекающей по уравнению 158. При получении молярной массы эквивалента гидроксида кальция из СаО(к) и Н2О(ж) выделяется 32,53 кДж теплоты. Напишите термохимическое уравнение этой реакции и вычислите теплоту образования оксида кальция. (Ответ: –635,6 кДж.) 159. Реакция восстановления Fe2O3 водородом протекает по уравнению
160. Кристаллический хлорид аммония образуется при взаимодействии газообразных аммиака и хлорида водорода. Напишите термохимическое уравнение этой реакции, вычислив ее тепловой эффект. Сколько теплоты выделится, если в реакции было израсходовано 10 л аммиака в пересчете на н.у.? (Ответ: 78,97 кДж.) 161. Вычислите 162. При сгорании 11,5 г жидкого этилового спирта выделилось 308,71 кДж теплоты. Напишите термохимическое уравнение реакции, в результате которой образуются пары воды и диоксид углерода. Вычислите теплоту образования С2Н5ОН. (Ответ: –726,62 кДж.) 163. При сгорании газообразного аммиака образуются пары воды и оксид азота. Сколько теплоты выделится при этой реакции, если было получено 44,8 дм3 NO в пересчете на н.у.? (Ответ: 452,37 кДж.) 164. Какая из приведенных реакций: а) 165. Определить знак изменения энтропии 166. Вычислите, при какой температуре начнется диссоциация пентахлорида фосфора, протекающая по уравнению 167. Какие из карбонатов – ВеСО3 или ВаСО3 – можно получить по реакции взаимодействия соответствующих оксидов с СО2? Какая реакция идет наиболее энергично? Вывод сделайте, вычислив 168. Сожжены с образованием Н2О(г) равные объёмы водорода и ацетилена, взятых при одинаковых условиях. В каком случае выделится больше теплоты? Во сколько раз? 169. Пользуясь значением термодинамических констант, показать, что в стандартных условиях реакция 170. Водяной газ представляет собой смесь равных обьемов водорода и оксида углерода(II). Найти количество теплоты, выделившейся при сжигании 112 л водяного газа, взятого при н.у. 171. При соединении 2,1 г железа с серой выделилось 3,77 кДж теплоты. Рассчитайте теплоту образования сульфида железа. 172. Найти количество теплоты, выделяющейся при взрыве 8,4 л гремучего газа, взятого при н.у.
173. При взаимодействии 1 моль металлического калия с водой выделяется 188,4 кДж теплоты. Запишите уравнение реакции. Определите, какая масса калия прореагировала, если выделилось 28,65 кДж теплоты. Возможна ли эта реакция при стандартных условиях. (Ответ: 5,85 г.) 174. Вычислите стандартную энтальпию образования уксусной кислоты, используя следующие данные: а) СН3СООН (ж) + 2 О2 = 2 СО2 (г) + 2 Н2О (ж) б) С (графит) + О2 = СО2 (г) в) Н2 + 1/2 О2 = Н2О (ж) (Ответ: –487,06 кДж.) 175. Чем можно объяснить, что при стандартных условиях невозможна реакция, протекающая по уравнению Н2 (г) + СО2 (г) = СО (г) + Н2О (ж) Вывод сделайте на основании качественного изменения энтропии. Зная тепловой эффект реакции и абсолютные стандартные энтропии соответствующих веществ, определите 176. На основании стандартных теплот образования и абсолютных стандартных энтропий соответствующих веществ, вычислите 177. При какой температуре наступит равновесие системы 4 НСl (г) + О2(г) = 2 Н2О (г) + 2 Сl2(г) Что в этой системе является более сильным окислителем – хлор или кислород – и при каких температурах? (Ответ: 891 K.) 178. Вычислите DН0298, DS0298, DG0298 для реакции 179. Определите DG0298 реакции, протекающей по схеме 180. С помощью термохимического уравнения Н2S(г) + 3/2 О2 =
|
||||||||||||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 197; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 52.15.112.69 (0.008 с.) |
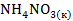
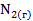
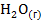
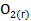
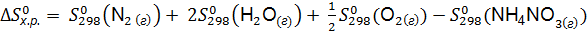 =
= 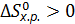 .
.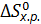 определяется количеством моль исходных газообразных веществ и количеством моль газообразных продуктов реакции.
определяется количеством моль исходных газообразных веществ и количеством моль газообразных продуктов реакции.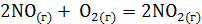 . Ответ мотивируйте, вычислив DG0298 прямой реакции. (Ответ: –69,7 кДж/моль.)
. Ответ мотивируйте, вычислив DG0298 прямой реакции. (Ответ: –69,7 кДж/моль.)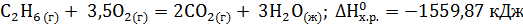 . Вычислите теплоту образования этана, если известны теплоты образования СО2(г) и Н2О(ж).
. Вычислите теплоту образования этана, если известны теплоты образования СО2(г) и Н2О(ж).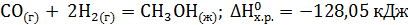 ?
?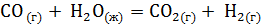 . Сделайте вывод о возможности протекания реакции. (Ответ: –19,91 кДж/моль.)
. Сделайте вывод о возможности протекания реакции. (Ответ: –19,91 кДж/моль.)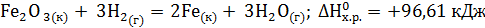 . Возможна ли эта реакция при стандартных условиях? При какой температуре начнется восстановление Fe2O3?
. Возможна ли эта реакция при стандартных условиях? При какой температуре начнется восстановление Fe2O3?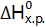 ,
, 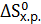 и
и 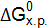 реакции, протекающей по схеме
реакции, протекающей по схеме 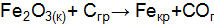 . Возможна ли эта реакция при температурах 500 и 1000 К?
. Возможна ли эта реакция при температурах 500 и 1000 К?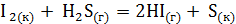 ;
; 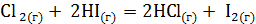 может протекать самопроизвольно при стандартных условиях? Ответ обоснуйте, вычислив
может протекать самопроизвольно при стандартных условиях? Ответ обоснуйте, вычислив 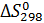 первой реакции?
первой реакции?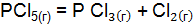 ;
; 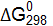 реакций.
реакций.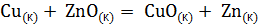 невозможна.
невозможна.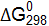 этой реакции. (Ответ: 19,91 кДж.)
этой реакции. (Ответ: 19,91 кДж.)


