
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Периодичность атомных характеристикСодержание книги
Поиск на нашем сайте
Периодический характер изменения химических свойств атомов элементов зависит от изменения радиуса атома и иона. За радиус свободного атома принимают положение главного максимума плотности внешних электронных оболочек. Это так называемый орбитальный радиус. В периодах орбитальные атомные радиусы по мере увеличения заряда ядра Z в общем монотонно уменьшаются из-за роста степени взаимодействия внешних электронов с ядром. В подгруппах радиусы в У s- и p-элементов изменение радиусов как в периодах, так и в подгруппах более ярко, чем у d- и f-элементов, поскольку d- и f-электроны внутренние. Уменьшение радиусов у d- и f-элементов в периодах называется d- и f-сжатием. Следствием f-сжатия является то, что атомные радиусы электронных аналогов d-элементов пятого и шестого периодов практически одинаковы:
Эти элементы из-за близости их свойств называются элементами-близнецами. Образование ионов приводит к изменению ионных радиусов по сравнению с атомными радиусами. При этом радиусы катионов всегда меньше, а радиусы анионов всегда больше соответствующих атомных радиусов. Свойства атомов рассматриваются как способность отдавать, или принимать электроны из-за стремления атомов приобрести устойчивую электронную конфигурацию, аналогичную инертным газам. Металлические свойства рассматриваются как способность атомов элементов отдавать электроны и проявлять восстановительные свойства, а неметаллические свойства – присоединять электроны и проявлять окислительные свойства. Энергией ионизацииI атома называется энергия, необходимая для перевода нейтрального атома в положительно заряженный ион. Ее величина зависит от величины заряда ядра, от радиуса атома и от взаимодействия между электронами. Энергия ионизации выражается в кДж∙моль–1 или эВ. Для химических исследований наибольшее значение имеет потенциал ионизации первого порядка – энергия, затрачиваемая на полное удаление слабосвязанного электрона из атома в невозбужденном, состоянии Энергия ионизации определяет характер и прочность химической связи, и восстановительные свойства элементов (табл. 3.1).
Таблица 3.1 Потенциалы (энергии) ионизации I1
I1 максимален у элементов с полностью заполненными валентными оболочками (у благородных газов), при переходе к следующему периоду I1 резко понижается – он минимален у щелочных металлов. Энергия связи электрона с ядром пропорциональна Z и обратно пропорциональна среднему (орбитальному) радиусу оболочки. Атомные радиусы d- и f-элементов с ростом Z в периоде уменьшается незначительно по сравнению с s- и p-элементами, поэтому их потенциалы ионизации растут также незначительно. В главных подгруппах потенциалы ионизации с ростом Z уменьшаются вследствие увеличения числа электронных подоболочек и экранирования заряда ядра электронами внутренних подоболочек. В побочных подгруппах d-электроны экранируются не только электронами заполненных оболочек, но и внешними s-электронами. Поэтому потенциал ионизации d-элементов с ростом Z в подгруппе увеличивается, хотя и незначительно. Чем меньше потенциал ионизации, тем легче атом отдает электрон. Поэтому восстановительная способность нейтральных атомов с ростом Z в периоде уменьшается, в главных подгруппах растет, а в побочных – падает. Другой важной в химии характеристикой атома является энергия сродства к электрону Еср – энергия, выделяющаяся при присоединении электрона к нейтральному атому: Чем больше электронное сродство, тем более сильным окислителем является данный элемент. Экспериментальное определение энергии сродства к электрону значительно сложнее, чем определение энергии ионизации. Величины Eср (в эВ) для некоторых атомов приведены в табл. 3.2. Таблица 3.2 Значение энергии Eср сродства к электрону для некоторых атомов
Немонотонность изменения сродства к электрону в периоде также обусловлена сравнительной устойчивостью полностью и наполовину заполненных подоболочек. Самый сильный из всех элементарных окислителей – фтор (он обладает и самым малым атомным радиусом из всех элементов VII группы). Окислительной способностью не обладают нейтральные атомы с устойчивыми конфигурациями s2 и s2p6 и переходные элементы. Для характеристики способности атома в составе молекулы притягивать электроны введено понятие электроотрицательность (ЭО). Электроотрицательность оценивает металлические и неметаллические свойства элементов. ЭО – полусумма энергии ионизации и сродства к электрону. Определение абсолютного значения электроотрицательности затруднительно, поэтому пользуются ее относительными значениями (ОЭО). При этом электроотрицательность лития принята за 1. По отношению к электроотрицательности лития определены электроотрицательности всех других элементов (табл. 3.3).
Таблица 3.3
|
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 174; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 216.73.216.119 (0.006 с.) |

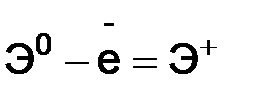 , где I1 – первый потенциал ионизации;
, где I1 – первый потенциал ионизации; 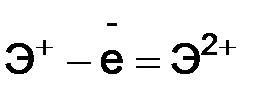 , I2 – второй потенциал ионизации и т.д. I1 < I2 < I3 < I4...
, I2 – второй потенциал ионизации и т.д. I1 < I2 < I3 < I4...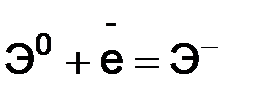 .
.


