
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Химический элемент. Атомная и молекулярная масса. МольСодержание книги
Поиск на нашем сайте
Атом – наименьшая частица химического элемента, сохраняющая все его химические свойства. Элемент – это вид атомов с одинаковым зарядом ядра. Молекула – нейтральная наименьшая совокупность атомов, обладающая определенным составом и структурой и, как следствие, определенными физическими и химическими свойствами. Это наименьшая частица вещества. Важной характеристикой атома является его атомная масса, абсолютная величина очень мала, поэтому для практических целей пользуются относительной атомной массой. Относительная атомная масса 1 а.е.м. = 1/12 Относительная молекулярная масса В химии с единицами массы и объема применяется единица количества вещества – моль. Моль – это количество вещества, содержащее столько формульных единиц, сколько атомов содержится 12 г изотопа углерода 12С.При использовании термина «моль» следует указывать частицы (моль молекул, атомов и т.д.). Количество частиц в 1 моле любого вещества одно и то же и равно 6,02 × 1023. Это число называется числом Авогадро и обозначается NA. Количество молей вещества nx, моль, – это физическая величина, пропорциональная числу структурных единиц этого вещества:
где Молярная масса
где Необходимо различать молярную массу Пример. Молекулярная масса соляной кислоты Закон Авогадро В равных объемах различных газов при одинаковых условиях (температура и давление) содержится одинаковое число молекул.
Следствия из закона Авогадро: 1 моль любого вещества содержит 6,0221 · 1023 число молекул. 1 моль любого газа при одинаковых условиях занимает постоянный объем. Это объем при нормальных условиях (н. у.), т.е. Т = 273 К и Молярный объем
где
|
|||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 82; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.224.54.118 (0.009 с.) |

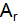 – это масса атома, выраженная в атомных единицах массы (а.е.м), она показывает во сколько раз масса атома данного элемента тяжелее 1/12 атома углерода 12С:
– это масса атома, выраженная в атомных единицах массы (а.е.м), она показывает во сколько раз масса атома данного элемента тяжелее 1/12 атома углерода 12С: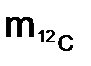 = 1/12 × 1,9927 × 10–23 = 1,66057 × 10–24 г.
= 1/12 × 1,9927 × 10–23 = 1,66057 × 10–24 г.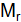 вещества – масса молекулы, выраженная в атомных единицах массы.
вещества – масса молекулы, выраженная в атомных единицах массы.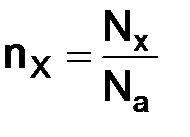 , (1.1)
, (1.1)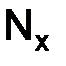 – число частиц вещества;
– число частиц вещества; 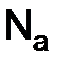 – число Авогадро.
– число Авогадро.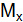 , г/моль, –масса одного моль-вещества, численно она равна отношению массы вещества к количеству:
, г/моль, –масса одного моль-вещества, численно она равна отношению массы вещества к количеству: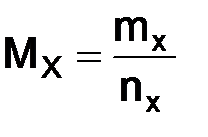 , (1.2)
, (1.2)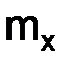 –масса вещества, г;
–масса вещества, г; 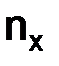 –количество вещества, моль.
–количество вещества, моль. составляет
составляет 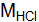 – 36,5 г/моль, или 36,5×10–3 кг/моль.
– 36,5 г/моль, или 36,5×10–3 кг/моль.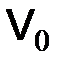 .
.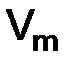 вещества – это отношение объема вещества к количеству моль этого вещества:
вещества – это отношение объема вещества к количеству моль этого вещества: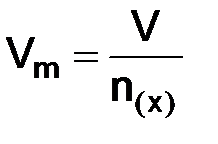 = 22,4 дм3/моль, (1.3)
= 22,4 дм3/моль, (1.3) –объем вещества, дм3;
–объем вещества, дм3; 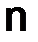 –количество вещества, моль.
–количество вещества, моль.


