
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Аморфных и кристаллических веществ
В зависимости от вида частиц, находящихся в узлах кристаллической решетки и типа связей между ними, кристаллы бывают четырех типов: ионные, атомные, молекулярные и металлические (рис. 5.1).
Рис. 5.1. Виды кристаллов Кристаллические решетки, состоящие из ионов, называются ионными. Их образуют вещества с ионной связью. Примером образования ионной кристаллической решетки может служить кристалл хлорида натрия (NaCl) (рис. 5.7). Вещества с ионной кристаллической решеткой обладают высокой твердостью, хрупкостью, являются тугоплавкими и малолетучими. Плавление ионных кристаллов приводит к нарушению геометрически правильной ориентации ионов относительно друг друга и ослаблению прочности связи между ними. Поэтому расплавы, растворы таких кристаллов проводят электрический ток. Вещества с ионными кристаллическими решетками легко растворяются в полярных жидкостях, являются диэлектриками. Ионные кристаллические решетки образуют многие соли, оксиды, основания. Кристаллические решетки, в узлах которых находятся отдельные атомы, называют атомными (ковалентными). Атомы в таких решетках соединены между собой прочными ковалентными связями. Примером кристалла с атомной кристаллической решеткой может служить алмаз (рис. 5.1) – одна из модификаций углерода. Данный кристалл состоит из атомов углерода, каждый из которых связан с четырьмя соседними атомами (к.ч. = 4). Число веществ с атомной кристаллической решеткой велико. Все они имеют высокую температуру плавления, не растворимы в жидкостях, обладают высокой прочностью, твердостью, имеют широкий диапазон электропроводимости (от изоляторов и полупроводников до электронных проводников). Атомная кристаллическая решетка характерна для элементов III и IV групп главных подгрупп (Si, Ge, B, C).
Кристаллические решетки, состоящие из молекул (полярные и неполярные) называются молекулярными. Молекулы в таких кристаллических решетках соединены между собой сравнительно слабыми водородными, межмолекулярными и электростатическими силами. Поэтому вещества с молекулярной решеткой имеют малую твердость и низкие температуры плавления. Они малорастворимы в воде, не проводят электрический ток и обладают высокой летучестью. Примерами веществ с молекулярными решетками являются лед, твердый углекислый газ («сухой лед»), твердые галогенводороды, твердые простые вещества, образованные одно- (благородные газы), двух- (F2, Cl2, Br2, J2, H2, N2, O2), трех- (O3), четырех- (P4), восьми- (S8) атомными молекулами. Большинство кристаллических органических соединений также имеют молекулярную решетку. Кристаллическая решетка, состоящая из атомов или ионов металлов, соединенных металлической связью (рис. 5.1), называется металлической. Согласно современным представлениям узлы металлических решеток заняты положительными ионами, между которыми перемещаются электроны, находящиеся в свободном состоянии. Такими электронами являются наименее прочно связанные с ядром валентные электроны. Перемещающиеся между положительными ионами электроны не имеют связи с отдельными ионами; они являются общими, принадлежащими всем ионам металла в данном кристалле. Следовательно, атомы металлов при потере электронов превращаются в ионы, а электроны образуют своего рода электронный газ, обтекающий ионы. Металлическая решетка является, как правило, весьма прочной. Этим объясняются свойственные большинству металлов твердость, малая летучесть, высокая температура плавления и кипения. Она же обусловливает такие характерные свойства металлов как электро- и теплопроводность, блеск, ковкость, пластичность, непрозрачность, фотоэффект. Металлической кристаллической решеткой обладают чистые металлы и сплавы.
5.2. Индивидуальные задания
121. Чем характеризуется внутреннее строение кристаллов? Какой тип кристаллической решетки характерен для твердых простых веществ, образованных элементами с порядковым номером 10, 37? Какие связи имеются в этих кристаллах, и какие свойства характерны для них? 122. В чем заключается явление анизотропии, характерное для кристаллов? Чем отличается структура кристалла СН4 от структуры кристаллов Н2 и САЛМАЗ? Какие виды связей существуют в кристаллах этих веществ? Как это влияет на их свойства? 123. Укажите химические связи в каждом из следующих кристаллов: аргон, кремний. 124. Чем отличается структура кристалла MgCl2 от структуры кристаллов Mg и Cl2? Какие виды связей существуют в кристаллах этих веществ? Как это влияет на их свойства? 125. Какой тип кристаллической решетки характерен для твердых простых веществ, образованных элементами с порядковым номером 14, 19? Какие связи имеются в этих кристаллах, и какие свойства характерны для них? 126. Какие физические свойства характерны для веществ с ионной кристаллической решеткой? Приведите примеры веществ с данным видом решетки. 127. Чем отличается структура кристалла 128. Какие физические свойства характерны для веществ с молекулярной кристаллической решеткой? Приведите примеры веществ и их свойства. 129. Какой тип кристаллической решетки характерен для твердых простых веществ, образованных элементами с порядковым номером 32, 36? Какие связи имеются в этих кристаллах и какие свойства характерны для них? 130. Чем отличается структура кристалла 131. Какой тип кристаллической решетки характерен для твердых простых веществ, образованных элементами с порядковым номером 11, 33? Какие связи имеются в этих кристаллах и какие свойства характерны для них? 132. Какой тип кристаллической решетки характерен для твердых простых веществ, образованных элементами с порядковым номером 18, 30? Какие связи имеются в этих кристаллах и какие свойства характерны для них? 133. Какой тип кристаллической решетки характерен для твердых простых веществ, образованных элементами с порядковым номером 1, 3? Какие связи имеются в этих кристаллах и какие свойства характерны для них? 134. Дайте характеристику аморфным и кристаллическим веществам. В чем их сходство и отличие? Приведите примеры аморфных и кристаллических веществ. какими свойствами они обладают и где применяются? 135. Чем отличается структура кристалла NaCl от структуры кристаллов Naи 136. Какой тип кристаллической решетки характерен для твердых простых веществ, образованных элементами с порядковым номером 7, 53? Какие связи имеются в этих кристаллах, и какие свойства характерны для них? 137. Чем отличается структура кристалла H2S от структуры 138. Какой тип кристаллической решетки характерен для твердых простых веществ, образованных элементами с порядковым номером 40, 2? Какие связи имеются в этих кристаллах и какие свойства характерны для них?
139. Какой тип кристаллической решетки характерен для твердых простых веществ, образованных элементами с порядковым номером 6, 82? Какие связи имеются в этих кристаллах и какие свойства характерны для них? 140. Чем отличается структура кристалла 141. Чем отличается структура кристалла 142. Какие физические свойства характерны для веществ с атомной кристаллической решеткой? 143. Чем отличается структура кристалла 144. Какой тип кристаллической решетки характерен для твердых простых веществ, образованных элементами с порядковым номером 21, 28? Какие связи имеются в этих кристаллах, и какие свойства характерны для них? 145. Чем отличается структура кристалла SiF от структуры кристаллов Si и 146. Назовите типы кристаллических решеток. Чем характеризуется каждый тип? Приведите примеры веществ, особенности их свойств и области применения. 147. Укажите химические связи в каждом из следующих веществ: вода, хлорид кальция, железо, лед. Каково строение кристаллов? 148. Охарактеризуйте свойства твердого тела. Чем твердые тела отличаются от жидкостей и газов? Какой тип кристаллической решетки имеет самое твердое природное вещество? 149. Какие физические свойства характерны для веществ с металлической кристаллической решеткой? Охарактеризуйте основные параметры кристаллической решетки. 150. Охарактеризуйте понятие «дефект кристалла».
|
|||||||||||||
|
Последнее изменение этой страницы: 2021-03-09; просмотров: 525; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.141.30.162 (0.012 с.) |
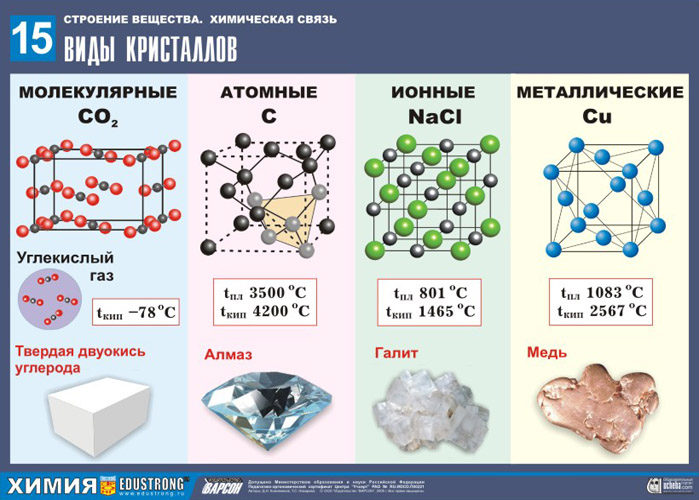
 от структуры кристаллов Cu и
от структуры кристаллов Cu и 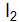 ? Какие виды связей существуют в кристаллах этих веществ? Как это влияет на их свойства?
? Какие виды связей существуют в кристаллах этих веществ? Как это влияет на их свойства?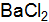 от структуры кристаллов Ba и
от структуры кристаллов Ba и  ? Какие виды связей существуют в кристаллах этих веществ? Как это влияет на их свойства?
? Какие виды связей существуют в кристаллах этих веществ? Как это влияет на их свойства?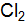 ? Какие виды связей существуют в кристаллах этих веществ? Как это влияет на их свойства?
? Какие виды связей существуют в кристаллах этих веществ? Как это влияет на их свойства?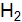 и S? Какие виды связей существуют в кристаллах этих веществ? Как это влияет на их свойства?
и S? Какие виды связей существуют в кристаллах этих веществ? Как это влияет на их свойства? от структуры кристаллов Si и
от структуры кристаллов Si и 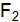 ? Какие виды связей существуют в кристаллах этих веществ? Как это влияет на их свойства?
? Какие виды связей существуют в кристаллах этих веществ? Как это влияет на их свойства?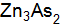 от структуры кристаллов Asи Zn? Какие виды связей существуют в кристаллах этих веществ? Как это влияет на их свойства?
от структуры кристаллов Asи Zn? Какие виды связей существуют в кристаллах этих веществ? Как это влияет на их свойства?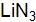 от структуры кристаллов Liи
от структуры кристаллов Liи 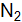 ? Какие виды связей существуют в кристаллах этих веществ? Как это влияет на их свойства?
? Какие виды связей существуют в кристаллах этих веществ? Как это влияет на их свойства?


