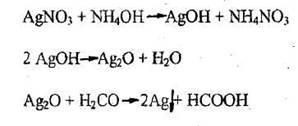Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь FAQ Написать работу КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Карбонильная (альдегидная и кетонная) группа (формальдегид, метенамин (гексаметилентетрамин))Содержание книги
Поиск на нашем сайте
Альдегиды и кетоны – это органические соединения, имеющие в своей структуре карбонильные группы:
Карбонильная группа в кетонах и альдегидах плоская, сильно поляризованная (на кислороде “-“), обладающая высокой реакционной способностью. Карбонильная группа имеет способность сообщать веществам снотворное действие. Формальдегид НСНО (муравьиный альдегид, метаналь) представляет собой бесцветный газ с резким раздражающим запахом. Хорошо растворим в воде, спиртах и других полярных растворителях. Чистый газообразный формальдегид относительно стабилен при 80-100 °С, при температурах ниже 80 °С полимеризуется; процесс ускоряется в присутствии полярных растворителей, в том числе воды. Качественное обнаружение 1. Реакция с резорцином в щелочной среде
Появляется розовая или малиновая окраска. Реакция не специфична (дают алкилгалогениды и др.). Чувствительность 0,03 мкг. 2. Реакция с реактивом Фелинга
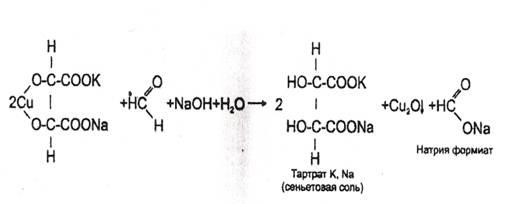
В пробирку вносят 1 мл исследуемого раствора, прибавляют 1–2 кап. 10% раствора гидроксида натрия до щелочной реакции (по лакмусу), а затем добавляют 2-3 кап. реактива Фелинга (готовится перед употреблением путем смешивания равных количеств растворов Фелинга №1 и №2). Жидкость сильно взбалтывают и нагревают. При охлаждении на дне пробирки виден желтый или красный осадок оксида меди (I). Реакция не специфична (дают алкилгалогениды и другие). Имеет отрицательное судебно-химическое значение. 3. Реакция с фуксинсернистой кислотой (реактив Шиффа) Появляется сине- или красно-фиолетовая окраска, иногда не сразу, а через 10-15 мин. Чувствительность реакции 0,03 мкг.
4. Реакция с кодеином и концентрированной серной кислотой
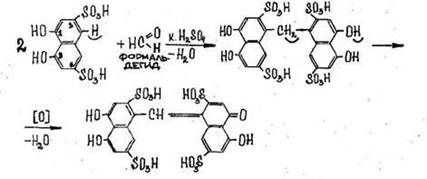
Через 5-10 мин. появляется сине – или красно-фиолетовое окрашивание. Реакция специфична, имеет положительное судебнохимическое значение. Чувствительность реакции 0,02 мкг. 1. Реакция с хромотроповой кислотой (1,8-диоксинафталтн-3,6-дисульфокислота) в присутствии концентрированной серной кислоты
В фарфоровую чашку вносят 1 мл исследуемого раствора, а затем прибавляют 5 мл концентрированной кислоты серной и несколько кристаллов кислоты хромотроповой. Наблюдается фиолетовая или красно-фиолетовая окраска. Реакция специфична, имеет положительное судебно-химическое значение. Чувствительность 1 мкг.
2. Реакция восстановления ионов серебра (реакция «серебряного зеркала»)
Реакция не специфична, имеет отрицательное судебно-химическое значение. Чувствительность реакции – сотые доли микрограмма. Водным раствором формальдегида (альдегид муравьиной кислоты) является формалин. Альдегиды определяются качественной реакцией "серебряного зеркала" СH2O + 2 Ag2O ---> CO2 + H2O + 4 Ag (осадок) Реакция "медного зеркала" также является качественной HCHO + 2Cu(OH)2 ---> 2H2O + Cu2O + HCOOH (образуется красный осадок). Реакции подлинности формальдегида 1. Реакции окисления 1.1.Реакция серебряного зеркала(с реактивом Толленса- аммиачный раствор серебра нитрата) 2AgNO3 +2 NH4OH→Ag2O +2 NH4NO3 + H2O HCOH + Ag2O →2Ag + HCOOH 1.2 Реакция с реактивом Нейслера – черный осадок HCOH +K2[ HgJ4] + 3KOH→ Hg +4 KJ +3 H2O + HCOOK 2. Реакция конденсации и окисления - образования ауринового красителя. Реакцию проводят с салициловой кислотой в присутствии концентрированной. серной при слабом нагревании, появляется красное окрашивание. Количественное определение. Метод йодометрии обратное титрование. Метод основан на реакции окислении формальдегида стандартным раствором йода в щелочной среде. Избыток йода оттитровывают стандартным раствором натрия тиосульфата. Индикатор раствор крахмала. HCOH + J2 +3 NaOH→ HCOONa +2NaJ+ 2H2O J2 +2Na2S2O3 → 2NaJ + Na2S4O6 F= ½ Реакции подлинности метилентетрамина 1.Водные растворы особенно при нагревании легко гидролизуются с образованием формальдегида и аммиака. (CH2)6N4 +6 H2O → 4NH3 + 6HCOH 2. Реакция кислотного гидролиза. При нагревании с раствором серной кислоты появляется запах формальдегида. (CH2)6N4+2H2SO4 + 6H2O →6 HCOH +2(NH4)2SO4 При добавлении к полученной смеси раствора гидроксида натрия 30% и при дальнейшем нагревании выделяется аммиак. (NH4)2SO4+ 2NaOH→2NH3↑+ Na2SO4 + 2H2O 3.На наличия третичного азота. А) С раствором йода в кислой среде формальдегид образует тетрайод- бурого цвета. (CH2)6N4 + 2I2→ (CH2)6N4∙I4↓ Б) С раствором серебра нитрата образует комплексную соль в виде белого осадка. 2(CH2)6N4 + 3AgNO3→2(CH2)6N4∙ 3AgNO3↓ В) С раствором кальция хлорида образует комплексную соль в виде белого осадка. (CH2)6N4 +CaCI2→(CH2)6N4 ∙CaCI2↓ Количественное определение.
1.Метод нейтрализации обратное титрование. Навеску препарата нагревают с определенным объемом стандартного раствора серной кислоты. Избыток кислоты оттитровывают стандартным раствором NaOH с индикатором метиловым красным. (CH2)6N4+2H2SO4 + 6H2O →6 HCOH +2(NH4)2SO4 H2SO4 +2NaOH→Na2SO4+2H2O F= 1/4 2. Метод ацидиметрии. Гексаметилентетрамин(метенамин) ввиду наличия в его молекуле третичного атома азота имеет щелочную реакцию, поэтому его можно титровать как одноосновное основание стандартным раствором кислоты хлористоводородной. В качестве индикатора применяют смесь метилового оранжевого и метиленовую синь. Титрование ведут от зеленого окрашивания до фиолетового. (CH2)6N4 + HCI → (CH2)6N4 ∙ HCI F=1
|
||||||
|
Последнее изменение этой страницы: 2021-01-14; просмотров: 384; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.191.203.35 (0.01 с.) |