
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Ковалентно связанный галоген (галотан (фторотан), хлорэтил).
Ковалентно связанный галоген – это галоген, входящий в структуру молекулы органического вещества и связанный ковалентной связью с атомом углерода. По природе галогена различают фтор – (галотан (фторотан), фторурацил и др.); хлор – (хлорэтил, хлоралгидрат), бром – (бромизовал, бромкамфора и др.) и йодсодержащие ЛВ (йодоформ, тиреоидин, лиотиронин (трийодтиронин). Поскольку атомы галогенов с органической частью молекулы связаны не ионогенно, для их обнаружения вещество необходимо минерализировать, то есть разрушить связь галогена с углеродом и перевести ковалентно связанный галоген в ионогенное состояние. Выбор метода минерализации определяется прочностью связи углерод - галоген (она падает от фтора к йоду), строением галогенсодержащего ЛВ (алифатического, ароматического, гетероциклического ряда) и может осуществляться несколькими способами: 1. непосредственное взаимодействие с реагентом (йодоформ с раствором серебра нитрата в азотнокислой среде); 2. гидролитическое расщепление водным (бромизовал) или спиртовым (хлорэтил) раствором щелочи (галогенсодержащие ЛВ алифатического ряда); 3. восстановительная минерализация водородом в момент выделения (Zn + NaOH, Zn + CH3COOH) или металлическим натрием (для фторпроизводных): · сжигание в колбе с кислородом (для всех галогенсодержащих веществ); · прокаливание со смесью для спекания (для всех, кроме фторсодержащих); · проба Бейльштейна; · 4) окислительная минерализация (только для йодсодержащих веществ); · “сухая” (нагревание без реактивов); · ”мокрая” (нагревание с концентрированной серной кислотой); · Подлинность Состоит из двух стадий: 1. минерализация ковалентно связанного галогена; 2. доказательство галогенид-иона или галогена обычными аналитическими реакциями. 1. П Проба Бейльштейна очень чувствительна, но является косвенным методом доказательства галогена, т.к. не позволяет определить природу галогена и анализировать фторсодержащие ЛВ, поскольку фторид меди не летуч. 2. Ковалентно связанный йод доказывают методом окислительной минерализации (“сухой” или “мокрой”); выделяются фиолетовые пары йода.
Методика. 1.Нагревают 0,1 г йодоформа в сухой пробирке. 2.Нагревают 0,1г лиотиронина (трийодтиронина) или тиреоиодина в пробирке с 1 мл концентрированной серной кислоты. 3. Методы восстановительной минерализации: 3.1. Металлическим натрием для фторсодержащих ЛВ. Вследствие высокой прочности связи фтор-углерод минерализацию проводят действием сильного восстановителя – металлического натрия при нагревании. Образующийся фторид-ион доказывают косвенно по разрушению цирконий - ализаринового красителя вследствие связывания Zr+4 в более прочный комплекс с фторидом, при этом окраска раствора изменяется от красно-фиолетовой до желтой. Способ используется для обнаружения фтора в галотане (фторотане), фторурациле, тегафуре (фторафуре), фторхинолонах и др.
3.3. Водородом в момент выделения (Zn + NaOH, Zn + CH3COOH) Варианты 3.2. и 3.3. используются для алифатических, алициклических, ароматических и гетероциклических ЛВ, содержащих йод, бром и хлор. Образующиеся галогенид - ионы доказывают реакциями: а) реакцией осаждения серебра нитратом в азотнокислой среде; б) окислением бромидов (хлорамином Б в кислой среде) и йодидов (натрия нитритом или железа (Ш) хлоридом в кислой среде соответственно до брома и йода, которые извлекают в хлороформный слой. Бром окрашивает хлороформ в желто-бурый цвет, йод в розовый или фиолетовый.
4. Гидролитическое разложение для ЛВ, содержащих галоген в алифатической цепи (кроме фтора) проводят при нагревании с водным (бромизовал) или спиртовым (хлорэтил) раствором щелочи, образующийся галогенид-ион доказывают обычными аналитическими реакциями. Методика. 0,1 г бромизовала кипятят с 3 мл раствора натрия гидроксида в течение 3 мин., охлаждают, прибавляют разведенной хлороводородной кислоты до кислой реакции среды, 0,5 мл раствора хлорамина, 1 мл хлороформа и взбалтывают.
1. Аргентометрия в анализе ЛC органической и неорганической природы. Варианты Мора, Фольгарда, Фаянса. Титранты, индикаторы, способы фиксации точки эквивалентности. Возможности и ограничения методов. Показать на примере калия хлорида, натрия йодида, хлоралгидрата. Аргентометрия, или аргентометрическое титрование, — метод осадительного титрования, основанный на использовании стандартного раствора нитрата серебра AgNO3 в качестве реагента-осадителя. В основе метода лежат осадительные реакции X- + Ag+ = AgX↓ где X- = I-,CN-, Br-,Сl-,NCS- и др. Титрование проводят обычно в присутствии индикаторов. В качестве основного титранта метода используют стандартный раствор AgNO3 чаше всего с концентрацией 0,1 и 0,05 моль/л. Нитрат серебра в водном растворе неустойчив вследствие протекания окислительно-восстановительных процессов с участием катионов серебра(I), которые окисляют возможные органические примеси в воде, фотохимического разложения на свету. Поэтому вначале раствор нитрата серебра готовят с приблизительной концентрацией, а затем стандартизуют по стандартному раствору хлорида натрия в присутствии хромата калия в качестве индикатора. Расчет концентрации и титра стандартизованного описанным методом раствора нитрата серебра проводят обычным способом, учитывая, что факторы эквивалентности нитрата серебра и хлорида натрия в данном случае равны единице: n(AgNO3) = n(NaCl), c(AgNO3)V(AgNO3) = c(NaCl)V(NaCl), c(AgNO3) = c(NaCl)V(NaCI)/V(AgNO3), T(AgNO3) = c(AgNO3)M(AgNO3)/1000, где все обозначения — традиционные. Разновидности аргентометрии. В зависимости от способа проведения титрования и применяемого индикатора различают 4 метода аргентометрического титрования; метод Гей-Люссака, метод Мора, метод Фаянса—Фишера—Ходакова и метод Фольгарда. В методе аргентометрии обычно применяют индикаторные способы определения конечной точки титрования. В зависимости от этого различают метод Мора, метод Фаянса, метод Фольгарда (или тиоцианатометрия - титрование по остатку с использованием в качестве второго титранта раствора тиоцианата калия или аммония). 2) Метод Мора Этот метод заключается в прямом титровании хлоридов и бромидов раствором нитрата серебра в присутствии индикатора хромата калия, с образованием нерастворимых осадков. Cl - +Ag+ =AgClЇбелый Br - +Ag+ =AgBrЇжелтовато белый K2CrO4 +Ag+ =Ag2CrO4Їкрасный Растворимость хромата серебра Ag2CrO4 значительно больше растворимости хлорида серебра AgCl или бромида серебра AgBr. Поэтому в данных реакциях сначала образуется осадок AgCl или AgBr. После того, как все галогенид - ионы будут практически осаждены, начнется взаимодействие между ионами и ионами Ag+. Как только станет ясно заметна перемена лимонно - желтой окраски в слабо розовую, титрование прекращают. Это говорит о достижении точки эквивалентности. Титрование по методу Мора проводят в нейтральных или слабощелочных растворах при ph от 6,5 до 10. Метод Мора имеет ряд недостатков:
3) Метод Фаянса (1923 г.)— Метод Фаянса - это метод прямого титрования галогенидов раствором AgNO3 (0,1М) в слабо кислой среде с применением адсорбционных индикаторов, которые показывают изменение цвета не в растворах, а на поверхности выпавшего осадка.
Использование адсорбционных индикаторов основано на следующем. При титровании галогенидов образуется серебряная соль галогена, которая адсорбирует вначале на своей поверхности ионы галогена, находящиеся в избытке и заряжается отрицательно. В конце титрования все галогены уже связаны, частицы теряют свой заряд и наблюдается процесс коагуляции. При добавлении даже незначительного избытка раствора AgNO3 частицы адсорбируют ионы серебра, заряжаются положительно и притягивают к себе окрашенный анион адсорбированного индикатора. Осадок окрашивается, что и указывает на конец реакции. В качестве адсорбционных индикаторов применяют:
Хлориды и бромиды можно титровать с бромфеноловым синим. Точную навеску хлорида или бромида растворяют в воде, прибавляют 2-3 капли индикатора бромфенолового синего, по каплям разведенную уксусную кислоту до зелено-желтого окрашивания и раствор AgNO3 0,1М до синего окрашивания. Можно с этим индикатором оттитровать и йодиды, только вместо синего окрашивания в точке эквивалентности будет зеленое окрашивание. В качестве индикатора для определения йодидов применяют эозинат натрия. К точной навеске препарата прибавляют разведенную уксусную кислоту, 3-5 капель раствора эозината натрия и титруют раствором AgNO3 0,1М до розового окрашивания осадка. Определению йодидов методом Фаянса не мешают хлориды, но мешают бромиды.
Примечание. Методом Фаянса определяют соли алкалоидов, соли азотосодержащих оснований (димедрол, новокаин, папаверин, дикаин, пилокарпил, эфедрин). 4) Метод Фольгарда (около 1870 г.) Метод Фольгарда Метод Фольгарда основан на реакции образования роданида серебра: Ag+ + SCNЇ = AgSCN Рабочим раствором является раствор роданида калия KSCN или аммония NH4SCN. Метод Фольгарда является примером обратного титрования. Следовательно, в этом методе имеется второй рабочий раствор - титрованный раствор нитрата серебра AgN03. Поэтому метод Фольгарда можно в равной степени назвать и аргентометрией и роданометрией. Определение хлоридов бромидов и йодидов по методу Фольгарда сводится к следующему. К определяемому раствору прибавляют из бюретки точно отмеренный объем титрованного раствора нитрата серебра; этот объем должен быть значительно больше, чем нужно для полного осаждения всего количества ионов С1~ (Вг_или Избыток раствора серебра оттитровывают раствором роданида калия или аммония. Индикатором в этом случае служит раствор железо-аммонийных квасцов (NH4) Fe (S04) 2-12Н20. Пока в растворе присутствуют ионы серебра, прибавляемый роданид будет реагировать с ними, образуя белый осадок AgSCN. Как только реакция между ионами Ag+ и SCN~ закончится, следующая капля рабочего раствора вступит в реакцию с индикатором FeS+ + 3SCN - = Fe (SCN) 3. Образующаяся соль Fe (SCN) 3окрашивает раствор в красный цвет. В отличие от метода Мора при методе Фольгарда присутствие кислоты не только не вредит титрованию, но, наоборот, способствует получению более точных ре зультатов. Кислота подавляет гидролиз соли железа и уничтожает желтую окраску раствора железо-аммонийных квасцов, связанную с гидролизом. Не мешает и присутствие в растворе солей Ва2+, РЬ2+и Bi3+. При титровании по методу Фольгарда должны соблюдаться следующие условия:
В методах клинических исследований метод Фольгарда применяется для определения хлоридов в крови. (6) Применение аргентометрии. Из всех методов осадительного титрования аргентометрия — наиболее распространенный в аналитической практике метод. Его используют в анализе как органических, так и неорганических веществ. Аргентометрия применяется для: 1) анализа таких фармацефтических препаратов, как NaCl, NaBr, KBr, NaI, KI; 2) спиртовых растворов йода; 3) эфедрина гидрохлорида; 4) галогенопроизводных органических веществ (после перевода галогена в ионогенное состояние, например, нагреванием со щелочью) – бромизовала, карбромала, бромкамфоры. Аргентометрически анализируют 5) барбитураты — производные диоксопиримидина. Анализ основан на том, что однозамещенные соли серебра растворимы, а двузамещенные — нерастворимы в воде.
Конечную точку титрования (точку эквивалентности) определяют индикаторами или физико-химическими методами (по электропроводности, светопропусканию, потенциалу индикаторного электрода и т.д.). По количеству пошедшего на титрование рабочего раствора рассчитывают результаты анализа. Вариант Мора (прямое титрование); индикатор - калия хромат. Среда – нейтральная или слабо-щелочная рН=7,0 – 10,0. Натрия хлорид, калия хлорид, натрия бромид, калия бромид. NaCI + AgNO3 → AgCI↓ + NaNO3 NaBr + AgNO3 → AgBr↓+ NaNO3 Реакция индикации: 2AgNO3 + K2CrO4 → Ag2CrO4↓ + 2KNO3 коричневато- красный, оранжево-красный (оранжево-желтый ГФ Х) Осадок Ag2CrO4↓образуется только при полном осаждении хлорид и бромид-ионов, т.к. растворимость его больше растворимости AgCI↓ и AgBr↓. Роль рН среды: А) В кислой среде рН<7 не работает индикатор, т.к. в кислой среде хромат-ион CrO42-переходит в дихроматCr2O72 и индикаторными свойствами не обладает вследствие высокой растворимостиAg2Cr2O7-(равновесие реакции диссоциации CrO42- смещено вправо) 2CrO4 + 2H+ ↔ 2HCrO4 - ↔ Cr2O72- + Н2O Б) В щелочной среде рН>10 не работает титрант, т.к. образуется осадок AgOH, который распадается на оксид Ag2O и воду AgNO3 +OH-→ AgOH↓ + NO3- 2 AgOH→ Ag2O + H2O
|
|||||||||
|
Последнее изменение этой страницы: 2021-01-14; просмотров: 951; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.116.62.45 (0.027 с.) |
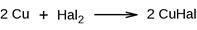
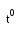 роба Бейльштейна. Основана на образовании летучих галогенидов меди, окрашивающих пламя горелки в зеленый (йод) или голубовато-зеленый (хлор, бром) цвет.
роба Бейльштейна. Основана на образовании летучих галогенидов меди, окрашивающих пламя горелки в зеленый (йод) или голубовато-зеленый (хлор, бром) цвет.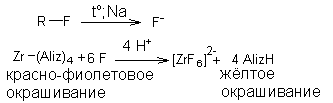 3.2. Прокаливание со смесью для спекания (KNO3, Na2CO3)
3.2. Прокаливание со смесью для спекания (KNO3, Na2CO3)
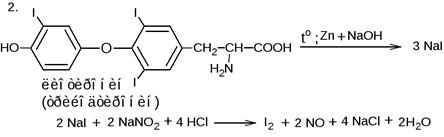 Методика. 0,1 г хлорхинальдола кипятят с 2 мл раствора натрия гидроксида и 0,2 г цинковой пыли в течение 3 мин., охлаждают, фильтруют. К фильтрату прибавляют разв. азотную кислоту до кислой реакции среды, 0,5 мл раствора серебра нитрата; образующийся белый творожистый осадок растворим в растворе аммония гидроксида.
Методика. 0,1 г хлорхинальдола кипятят с 2 мл раствора натрия гидроксида и 0,2 г цинковой пыли в течение 3 мин., охлаждают, фильтруют. К фильтрату прибавляют разв. азотную кислоту до кислой реакции среды, 0,5 мл раствора серебра нитрата; образующийся белый творожистый осадок растворим в растворе аммония гидроксида.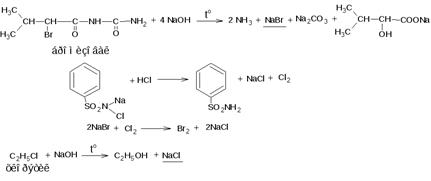 Хлороформный слой окрашивается в желто-бурый цвет.
Хлороформный слой окрашивается в желто-бурый цвет.


