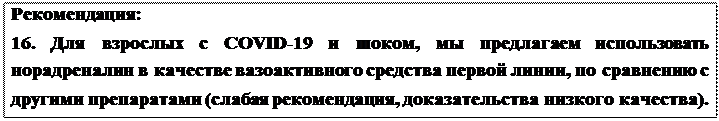Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Шок и повреждение миокарда у пациентов с COVID-19.
Сообщаемая частота шока у взрослых пациентов с COVID-19 очень вариабельна и колеблется от 1 до 35%, в зависимости от состава пациентов в исследовании, тяжести заболевания и проявлений шока. В исследовании, суммировавшем эпидемиологические характеристики 44415 пациентов с COVID-19 в Китае, у 2087 (5%) были диагностированы критические состояния, проявляющиеся тяжелой гипоксемией и/или наличием иной органной недостаточности, включая шок [12]. В другом китайском исследовании из 1099 пациентов с COVID-19 со схожей тяжестью заболевания, только у 12 (1,1%) имелись признаки шока [1]. У госпитализированных пациентов частота шока более высокая [42] (таблица 3), и может достигать 25-30% у пациентов в РАО [42, 43]. Повреждения сердца (повышение биомаркеров повреждения миокарда выше 99 перцентиля референтных значений) обнаруживалось у пациентов с COVID-19 в китайском Ухане в интервале от 7 до 23% [42-45]. Хотя распространенность кардиального повреждения может коррелировать с распространенностью проявлений шока, отсутствие систематического скрининга признаков повреждения миокарда у гемодинамически стабильных пациентов не позволяет с определенностью утверждать о наличии этой зависимости. (таблица 3). Прогноз у пациентов с шоком на фоне COVID-19 систематически не изучался. В исследовании у 150 пациентов из 2 госпиталей в Ухане, Китай, шок был основной причиной смерти у 40% умерших, и мог быть, по крайней мере у части пациентов, быть обусловлен фульминантным миокардитом [46]. Исследования факторов риска, ассоциирующихся с развитием шока у пациентов с COVID-19 в настоящее время отсутствуют. Большинство из них присутствуют в доступных сообщениях без оценочных характеристик [12, 42, 46]. Несмотря не методологические ограничения, эти исследования позволяют предположить, что пожилой возраст, сопутствующая патология (особенно диабет и сердечно-сосудистые заболевания, включая гипертензию), низкий уровень лимфоцитов, повышенный уровень D- димера и возможное кардиальное повреждение являются факторами риска развития шока.
Обоснование: В настоящее время нет прямых доказательств, обосновывающих оптимальную реанимационную стратегию у пациентов с COVID-19 и шоком, поэтому обоснование этой рекомендации базируется на непрямых доказательствах, полученных у критических пациентов в целом.
В систематическом обзоре и мета-анализе 13 РКИ (1652 пациента), исследовавших влияние динамической оценки инфузионной терапии на важные показатели исхода у взрослых реанимационных пациентов, нуждавшихся в проведении инфузионной реанимации [47], использование динамической оценки для определения режима инфузионной терапии продемонстрировало снижение летальности (ОР 0,59, 95% ДИ 0,42 - 0,83), снижение времени пребывания в ОРИТ (среднее значение -1,16 дня, 95% ДИ -1,97 - -0,36), и длительности механической вентиляции (-2,98 часа, 95% ДИ -5,08 - -0,89). Следует отметит, что только одно исследование было сфокусировано на пациентах с септическим шоком. Динамические параметры, использовавшиеся в этих исследованиях, включали в себя вариабельность ударного объема (SVV), вариабельность пульсового давления (PPV), и изменение ударного объема при пассивном поднятии ноги или при инфузионной нагрузке. Среди исследуемых гемодинамических параметров, пассивное поднятие ноги, вслед за PPV и SVV, определяло чувствительность к инфузии с максимальной точностью [48]. Статические показатели включали компоненты ранней целеориентированной терапии, в том числе центральное венозное давление (ЦВД) и среднее артериальное давление (САД). Использование лактата сыворотки для определения реанимационной стратегии у пациентов с шоком было суммировано в систематическом обзоре и мета-анализе 7 РКИ (1301 пациент). По сравнению с терапией, руководствуемой сатурацией центральной венозной крови (ScVO2), ранняя терапия, основанная на снижении лактата, ассоциировалась со снижением летальности (ОР 0,68, 95% ДИ 0,56 - 0,82), снижением
времени пребывания в ОРИТ (среднее значение -1,64 дня, 95% ДИ -3,23 - -0,05, и длительности механической вентиляции (-10,22 часа, 95% ДИ -15,94 - -4,50). Однако, высокий уровень лактата не всегда отражает гипоксемию, он может быть обусловлен митохондриальной дисфункцией, печеночной недостаточностью, бета-агонистами, мезентериальной ишемией или адреналином. В исследовании ANDROMEDA-SHOCK [Early Goal Directed Therapy Using a Physiological Holistic View. The ANDROMEDA-SHOCK Study – Цель-ориентированная терапия с использованием физиологического целостного взгляда. АНДРОМЕДА- ШОК], исследование наполнения капилляров каждые 30 минут ассоциировалось с недостоверным снижением летальности (ОР 0,75, 95% ДИ 0,55 - 1,02) по сравнению с измерением лактата каждые 2 часа [50]. Исследование капиллярного наполнения - простой и легкий тест, который может выполняться в большинстве ситуаций. Учитывая возможные снижения летальности, длительности пребывания в ОРИТ и длительности механической вентиляции, к которым может привести их использование, мы полагаем, что использование динамических параметров кожной температуры, времени наполнения капилляров и/или уровня лактата преимущественнее использования статических параметров при определении потребности и чувствительности к инфузионной терапии у пациентов с COVID-19 и шоком.
Обоснование: Отсутствуют прямые доказательства, полученные у пациентов с COVID-19, поэтому обоснование этой рекомендации базируется на непрямых доказательствах, полученных у критических пациентов с сепсисом и ОРДС. Систематический обзор 9 РКИ (637 пациентов), сравнивавших рестриктивную и либеральную инфузионные стратегии в начальной реанимации у пациентов с сепсисом, продемонстрировал отсутствие статистических различий в летальности (ОР 0,87, 95% ДИ 0,69 - 1,10) и частоте серьезных осложнений (ОР 0,91, 95% ДИ 0,78 - 1,05) [51].
Однако, все оценивавшиеся результаты показали преимущество консервативной инфузионной терапии (меньших объемов). Важно, что количество и качество доказательств оценивались как очень низкие, и существует потребность в продолжении исследований. Соответственно, опубликованный в 2017 году мета-анализ 11 РКИ (2051 пациент), продемонстрировал, что взрослые и дети с ОРДС или сепсисом, которые в пост- реанимационной фазе критического заболевания велись в соответствии с консервативной инфузионной стратегией, имели большее число дней без ИВЛ и меньшую длительность пребывания в ОРИТ по сравнению с пациентами, которые велись в соответствии с либеральной инфузионной стратегией [52] (смотрите раздел «Респираторная поддержка» для получения более подробной информации). В 2011, большое РКИ, включившее 3411 африканского ребенка с лихорадкой (FEAST) показало, что дети, получавшие инфузионные болюсы как изотонического раствора хлорида натрия, так и альбумина, продемонстрировали более высокую летальность по сравнению с детьми, не получавшими инфузионных болюсов [53]. В отсутствии данных, демонстрирующих преимущества использования либеральной инфузионной стратегии у критических пациентов с сепсисом или ОРДС, и предположения, что у большинства пациентов с COVID-19 в ОРИТ обнаруживается ОРДС, мы полагаем первоначально консервативный подход к жидкостной реанимации у пациентов с COVID-19 и шоком.
Обоснование: Поскольку отсутствуют прямые доказательства у пациентов с шоком на фоне COVID- 19, обоснование базируется на непрямых доказательствах у критических пациентов в целом. В систематическом обзоре 69 РКИ (30020 пациентов) по сравнительному применению кристаллоидов и коллоидов у критических пациентов [54], не продемонстрировано ни одного преимущества при использовании коллоидов. Принимая во внимание, что ряд
коллоидов вреден (смотрите ниже), все коллоиды дороже кристаллоидов, а также доступность коллоидов может быть ограничена в некоторых ситуациях (например, в ряде стран с низким или средним уровнем дохода), мы рекомендуем использовать кристаллоиды для жидкостной реанимации у пациентов с COVID-19 и шоком.
Обоснование: Поскольку отсутствуют прямые доказательства у пациентов с шоком на фоне COVID- 19, обоснование базируется на непрямых доказательствах у критических пациентов в целом. Систематический обзор и мета-анализ 21 РКИ (20213 пациентов), сравнивавших применение сбалансированных кристаллоидных растворов с 0,9% раствором хлорида натрия для жидкостной реанимации у взрослых пациентов и детей в критическом состоянии [55], продемонстрировал отсутствие достоверных различий в госпитальной летальности (ОР 0,91, 95% ДИ 0,83 - 1,01), или острого почечного повреждения (ОР 0,92, 95% ДИ 0,84 - 1,00) между ними. Однако, полученные результаты позволяют предположить о наличии преимуществ применения сбалансированных кристаллоидов. С учетом отсутствия описанного вреда применения, и сопоставимой стоимости применения, мы полагаем, что использование сбалансированных коллоидных растворов преимущественнее использования несбалансированных кристаллоидов при жидкостной реанимации у пациентов с COVID-19 и шоком. В условиях ограниченной доступности сбалансированных кристаллоидов 0,9% раствор хлорида натрия представляется оправданной альтернативой.
Обоснование: Поскольку отсутствуют прямые доказательства у пациентов с шоком на фоне COVID- 19, обоснование базируется на непрямых доказательствах у критических пациентов в целом. Систематический обзор 69 РКИ (30020 пациентов), сравнивавших применение кристаллоидов и коллоидов у критических пациентов, включал в себя 24 РКИ (11177 пациентов) сравнивавших применение кристаллоидов с применением ГЭК [54]. Когда данные были выделены, не было выявлено достоверных различий летальности ни в конце исследования (ОР 0,97; 95% ДИ от 0,86 до 1,09), ни в течение 90 дней (ОР 1,01; 95% ДИ от 0,90 до 1,14) или в течение 30 дней (ОР 0,99; 95% ДИ от 0,90 до 1,09). Авторы, однако, сообщили о повышенном риске переливания крови (ОР 1,19, 95% ДИ от 1,02 до 1,39) и заместительной почечной терапии (ЗПТ) использовании крахмалов (ОР 1,30, 95% ДИ от 1,14 до 1,48). Учитывая риск клинически значимого вреда и очевидного отсутствия преимуществ от использования ГЭК, мы не рекомендуем их использовать для реанимации пациентов с COVID-19 и шоком.
Обоснование: так как ни одно исследование не исследовало этот аспект у пациентов с COVID-19 и шоком, группа экспертов основывала эту рекомендацию на косвенных данных от критически больных целом. В систематическом обзоре 69 РКИ (n = 30 020 пациентов), сравнивающих использование кристаллоидов и коллоидов у пациентов в критическом состоянии, кристаллоиды сравнивались с желатинами в 6 РКИ (n = 1 698) [54]. В конце периода наблюдения не наблюдалось статистически значимой разницы в смертности от всех причин (ОР 0,89, 95% ДИ от 0,74 до 1,08), в течение 90 дней (ОР 0,89, 95% ДИ от 0,73 до 1,09) или в течение 30 дней. (ОР 0,92, 95% ДИ от 0,74 до 1,16), хотя точечные оценки благоприятствовали использованию кристаллоидов. Учитывая отсутствие какой-либо пользы от желатинов и их более высокую стоимость, мы предлагаем не использовать желатины для реанимации пациентов с COVID-19 и шоком.
Рекомендация: 14. Для острой реанимации взрослых с COVID-19 и шоком, мы предлагаем не использовать декстран (слабая рекомендация, доказательства низкого качества)
Обоснование: Учитывая отсутствие прямых данных о пациентах с COVID-19 и шоком, комиссия основывала эту рекомендацию на косвенных данных от пациентов в критическом состоянии в целом. Систематический обзор и мета-анализ использования кристаллоидов и коллоидов у критически больных пациентов выявил 19 исследований, в которых сравнивали кристаллоиды с декстранами (n = 4736) [54]. Он показал сходные показатели смертности в конце периода наблюдения (0,99 руб., 95% ДИ от 0,88 до 1,11) и в течение 90 дней (0,99 руб., 95% ДИ от 0,87 до 1,12), но, возможно, увеличился риск переливания крови в группе декстранов (ОР 0,92, 95% ДИ от 0,77 до 1,10). Ввиду возможного повышенного риска переливания крови (кровотечения) и более высоких затрат, связанных с декстранами, мы предлагаем не использовать их для реанимации пациентов с COVID-19 и шоком. Рекомендация: 15. Для острой реанимации взрослых с COVID-19 и шоком, мы предлагаем рутинно не использовать альбумин для начальной реанимации (слабая рекомендация, доказательства среднего качества). Систематический обзор и метаанализ позволил выявить 20 РКИ (n = 13,047), сравнивающих использование альбумина с кристаллоидами [54]. Не было выявлено существенных различий в смертности от всех причин в конце периода наблюдения (ОР 0,98, 95% ДИ от 0,92 до 1,06), в течение 90 дней (ОР 0,98, 95% ДИ от 0,92 до 1,04) или в течение 30 дней. (ОР 0,99, 95% ДИ от 0,93 до 1,06). Риск переливания крови (ОР 1,31, 95% ДИ от 0,95 до 1,80) и проведения ЗПТ (ОР 1,11, 95% ДИ от 0,96 до 1,27) также были аналогичными. В отсутствие пользы от альбумина и учитывая его стоимость и ограниченную доступность, мы не рекомендуем использовать его для начальной реанимации пациентов с COVID-19 и шоком.
Обоснование: Прямых данных о пациентах с COVID-19 и шоком нет, поэтому комиссия основывала эту рекомендацию на косвенных данных от пациентов в критическом состоянии в целом.
Систематический обзор 28 РКИ (n = 3497 пациентов) и руководство по клинической практике от 2016 года суммировали имеющиеся данные о лучшем вазопрессоре первой линии для пациентов с шоком [56, 57]. Поскольку норадреналин является наиболее широко изученным вазоактивным препаратом с заведомо низким риском нежелательных эффектов, мы предлагаем использовать норэпинефрин в качестве вазоактивного агента первого ряда у пациентов с COVID-19 и шоком. Рекомендация: 17. Если норэпинефрина нет в наличии, мы предлагаем использовать вазопрессин или адреналин в качестве вазоактивного средства первой линии по сравнению с другими вазоактивными препаратами для взрослых с COVID-19 и шоком (слабая рекомендация, доказательства низкого качества). Обоснование: В отсутствие прямых данных о пациентах с COVID-19 и шоком, комиссия основывала эту рекомендацию на косвенных данных от больных в критическом состоянии в целом. В систематическом обзоре 28 РКИ (n = 3497 пациентов) норэпинефрин сравнивался как с вазопрессином, так и с адреналином, но ни одно из исследований не сравнивало напрямую 2 варианта [57]. Если норадреналин недоступен, мы предлагаем использовать либо вазопрессин, либо адреналин, так как оба препарата были оценены в РКИ без явных доказательств вреда. Факторы, определяющие выбор между вазопрессином и адреналином, могут включать доступность и противопоказания к двум препаратам. При использовании вазопрессина надо про ишемию пальцев; при использовании адреналина принимать во внимание тахикардию и избыточную выработку лактата.
Обоснование: Поскольку ни одно прямое доказательство не решает этот вопрос у пациентов с COVID- 19 и шоком, комиссия основывала эту рекомендацию на косвенных данных от больных в критическом состоянии В Кокрановском систематическом обзоре 2016 года было найдено 6 РКИ (n = 1400), сравнивающих норадреналин и дофамин у пациентов с шоком [57]. При объединении результаты не показали существенных различий в смертности от всех причин, но точечная оценка благоприятствовала норэпинефрину (ОР 1,07, 95% ДИ от 0,99 до 1,16) и повышенному риску аритмий (ОР 2,34, 95% ДИ от 1,46 до 3,78), который был отмечен в группе допамина. На основании повышенного риска причинения вреда, включая возможный повышенный риск смертности у пациентов, получающих дофамин, мы рекомендуем не использовать дофамин у пациентов с COVID-19 и шоком при наличии норэпинефрина или альтернатив (см. Рекомендацию 17). Рекомендация: 19. Для взрослых с COVID-19 и шоком, мы предлагаем добавить вазопрессин в качестве агента второго ряда, сверх оттитрованной дозы норэпинефрина, если целевое среднее артериальное давление (САД) не может быть достигнуто одним только норэпинефрином (слабая рекомендация, доказательства среднего качества). Обоснование: при отсутствии данных о пациентах с COVID-19 и шоком, комиссия основывала эту рекомендацию на косвенных данных, полученных пациентов в критическом состоянии в целом. В недавнем руководстве по клинической практике было оценено использование аналогов вазопрессина и вазопрессина у критически больных взрослых с дистрибутивным шоком [58]. Анализируя 25 РКИ (n = 3737 пациентов), авторы обнаружили низкую достоверность снижения смертности (ОР 0,91, 95% ДИ от 0,85 до 0,99), высокую достоверность снижения фибрилляции предсердий (ОР 0,77, 95% ДИ от 0,67 до 0,88) и умеренное повышение риска ишемии пальцев (ОР 2,56, 95% ДИ от 1,24 до 5,25) при добавлении вазопрессина или его аналогов к катехоламинам. К
аналогичному выводу пришел и другой недавний систематический обзор пришел [59]. Учитывая эти результаты, мы предлагаем добавить вазопрессин в качестве препарата второй линии, дополнительно к оттитрованной дозе норэпинефрина, если целевое САД не может быть достигнуто только одним норэпинефрином у пациентов с COVID-19 и шоком.
Обоснование: Нет прямых доказательств, подтверждающих эту рекомендацию; это основано на косвенных данных от больных в критическом состоянии. Недавний метаанализ данных отдельных пациентов о 2 РКИ (n = 894 пациента), сравнивающих более высокие и более низкие показатели артериального давления для терапии вазопрессором у взрослых пациентов с шоком, не выявил существенных различий в 28-дневной смертности (ОШ 1,15, 95% ДИ 0,87 до 1,52), 90-дневная смертности (ОШ 1,08, 95% ДИ от 0,84 до 1,44), повреждении миокарда (ОШ 1,47, 95% ДИ от 0,64 до 3,56) или ишемии конечностей (ОШ 0,92, 95% ДИ от 0,36 до 2,10) [60 ]. Но риск аритмий был повышен у пациентов, отнесенных к группе более высокого целевого САД (ОШ 2,50, 95% ДИ от 1,35 до 4,77). Соответственно, в недавно опубликованных 65 исследованиях сообщается об абсолютной разнице в смертности на уровне 3% (ОР 0,93, 95% ДИ 0,85-1,03) в пользу целевого САД 60-65 мм рт.ст. (более низкая цель) по сравнению с более высокими показателями [61]. С учетом лучших результатов при более низких показателях САД (и без точных указаний на вред) мы предлагаем титрование вазоактивных препаратов до достижения уровня 60-65 мм рт.
Обоснование: В отсутствие прямых доказательств у пациентов с COVID-19 и шоком, группа использовала косвенные данные от пациентов в критическом состоянии, чтобы выработать эту рекомендацию. В руководстве по клинической практике от 2018 года по оценке оптимального инотропного средства у пациентов с острой недостаточностью кровообращения (шоком) не было выявлено РКИ, сравнивающих добутамин с плацебо или отсутствием лечения [62]. Основываясь на физиологическом обосновании, мы предлагаем добавлять добутамин у пациентов с COVID-19 и шоком с признаками сердечной дисфункции и постоянной гипоперфузии, несмотря на инфузионную реанимацию и высокие дозы норэпинефрина. Применение добутамина при шоке, в том числе у пациентов с COVID-19, осложненным шоком является приоритетной задачей исследований.
Обоснование: Поскольку не существует данных об использовании стероидов у пациентов с COVID- 19 и шоком, комиссия основывала эту рекомендацию на косвенных данных от больных в критическом состоянии в целом. Как систематический обзор 228 РКИ (n = 7297 пациентов), проведенный в 2018 году, сравнивающий низкодозированную терапию кортикостероидами с отсутствием кортикостероидной терапии у взрослых пациентов с септическим шоком [63], так и руководство по клинической практике [64] сообщают об отсутствии значительной разницы в краткосрочной смертности. (ОР 0,96, 95% ДИ от 0,91 до 1,02), долгосрочная смертность (ОР 0,96, 95% ДИ от 0,90 до 1,02) или серьезные нежелательные явления (ОР 0,98, 95% ДИ от 0,90 до 1,08). Однако время лечения шока и длительность пребывания в отделении интенсивной терапии и в больнице были короче при лечении кортикостероидами. Поскольку время разрешения шока и длительность пребывания (особенно в отделении интенсивной терапии) являются важными с позиции затратности лечения, мы предлагаем использовать терапию низкими дозами кортикостероидами у пациентов с
COVID-19 и рефрактерным шоком. Ниже мы приводим дальнейшие рекомендации для пациентов с COVID-19 и дыхательной недостаточностью при отсутствии рефрактерного шока.
Б) Респираторная поддержка Распространенность гипоксической дыхательной недостаточности у пациентов с COVID-19 составляет 19% [12]. Недавние сообщения из Китая показали, что от 4% до 13% пациентов с COVID-19 в этих исследованиях получали неинвазивную вентиляцию с положительным давлением (NIPPV), и что от 2,3% до 12% требовалась инвазивная искусственная вентиляция легких (Таблица 3) [1, 12 42, 43, 65]. Хотя истинная частота гипоксической дыхательной недостаточности у пациентов с COVID-19 не ясна, похоже, что примерно в 14% разовьются тяжелые состояния, требующие кислородной терапии, а 5% больных потребуют госпитализации в ОИТ и искусственной вентиляции легких [12]. В другом исследовании сообщалось о 52 критически больных с COVID-19; 67% из этих пациентов имели ОРДС, 33 (63,5%) получили респираторную поддержку через высокопоточные назальные канюли (HFNC), 56% больным проводилась инвазивная искусственная вентиляция легких и в 42% случаев неинвазивную ИВЛ (NIPPV) [42]. Факторы риска дыхательной недостаточности Факторы риска, связанные с дыхательной недостаточностью, требующей искусственной вентиляции легких, не имеют четкого описания в публикациях, хотя из ограниченных имеющихся данных факторы риска, связанные с критическим заболеванием / госпитализацией в ОИТ, включают пожилой возраст (> 60 лет), мужской пол и наличие сопутствующих заболеваний, таких как диабет, злокачественные новообразования и состояние с ослабленным иммунитетом [1, 12, 42, 43]. Центр по контролю и профилактике заболеваний США сообщил, что общий коэффициент летальности (CFR) составил 2,3%, и 14,8% у пациентов в возрасте 80 лет и старше. У пациентов в критическом состоянии CFR составлял 49,0%, а у тех, кто получил инвазивную искусственную вентиляцию легких, он был выше 50%. Наличие ранее существующих сопутствующих заболеваний, таких как сердечно-сосудистые заболевания, диабет, хронические респираторные заболевания, гипертония и рак, были связаны с более высоким риском смерти [12].
Обоснование: Недавнее исследование описало течение болезни у 1009 пациентов с COVID-19 в Китае и показало, что 41% всех госпитализированных пациентов и более 70% пациентов с тяжелыми заболеваниями нуждаются в дополнительном кислороде [1]. У критически больных пациентов гипоксия может быть вредной и связана с плохими результатами [66]. Не существует рандомизированных или нерандомизированных исследований по использованию кислорода у взрослых с COVID-19. Тем не менее, группа использовала косвенные доказательства полученных от тяжелой популяции больных для формирования рекомендаций. Систематический обзор и метаанализ 25 РКИ (16 037 пациентов) показал, что либеральная кислородная стратегия связана с повышенным риском госпитальной смертности (ОР 1,21, 95% ДИ от 1,03 до 1,43) у пациентов в критическом состоянии [67]. Кроме того, регрессионный анализ показал линейную связь между риском смерти и более высокими показателями SPO2 [67]. Среднее значение SPO2 в группе либерального подхода к использованию кислорода составляло 96% (межквартильный интервал (IQR) от 96 до 98) во всех исследованиях. Недавнее руководство по клинической практике рекомендовало поддерживать уровень SPO2 не выше 96% [68]. Последующие исследования дали направления по целям оксигенации. В исследовании ICU-ROX (Conservative vs Usual O2 Therapy During Mechanical Ventilation in the ICU - Консервативная или обычная О2-терапия О2 при искусственной вентиляции) 1000 пациентов в критическом состоянии были рандомизированы на две группы, в одной
группе использована консервативная стратегия (на основе достижения низких значений кислорода), либо обычной помощи. Это исследование не выявило различий в смертности в течение 180 дней между двумя группами (ОШ 1,05, 95% ДИ от 0,81 до 1,37) [69]. Исследование ICU-ROX не сравнивало гипероксию с консервативной кислородной стратегией; вместо этого оно сравнило обычную помощь с консервативной кислородной стратегией. Недавнее исследование LOCO2 (Liberal or Conservative Oxygen Therapy for Acute Respiratory Distress Syndrome) рандомизировало пациентов с ОРДС на две группы: группа консервативного использования кислорода (целевой SPO2 от 88% до 92%) и группа либерального использования кислорода (целевой SPO2 ≥96%). Исследование было остановлено на раннем этапе из-за бесполезности и возможного вреда после того, как 61 смерть произошла у 205 включенных пациентов с 28-дневной смертностью (разница рисков [RD] 7,8%, 95% ДИ от -4,8 до 20,6) [70]. Через 90 дней в группе консервативного использования кислорода был более высокий риск смерти (RD 14,0%, 95% ДИ 0,7-27,2). Принимая во внимание связанный с этим вред, причиненный пациенту в крайних случаях целевых показателей SPO2, а также возросшую стоимость неоправданного потребления кислорода, а также возможное истощение ресурсов кислорода, группа экспертов настоятельно рекомендовала не использовать кислород для достижения целевого значения SPO2> 96%, и сильная рекомендация избегать более низких значений (SPO2 <90%). Следовательно, разумный диапазон SPO2 для пациентов, получающих кислород, составляет от 92% до 96%.
Обоснование: Поскольку прямых данных о пациентах с COVID-19 нет, группа экспертов использовала косвенные данные из популяции больных в критическом состоянии для обоснования этой рекомендации. В РКИ, сравнивающем HFNC с обычной кислородной терапией у
пациентов с острой гипоксической дыхательной недостаточностью, HFNC приводил к снижению 90-дневной смертности (ОР 0,42, 95% ДИ от 0,21 до 0,85), но не снижал риск интубации [71]. Систематический обзор и метаанализ 9 РКИ (2093 пациента) показал, что HFNC снижает частоту интубацию по сравнению с обычной подачей кислорода (ОР 0,85, 95% ДИ от 0,74 до 0,99), но не влияет на риск смерти или длительность пребывания в ОРИТ [72]. -74]. Несмотря на то, что данные о смертности и продолжительности пребывания были не столь убедительны, снижение потребности в интубации является важным открытием, особенно с точки зрения пандемий, таких как COVID-19, где ресурсы, такие как койки интенсивной терапии и аппараты ИВЛ ограничены. Кроме того, при ОРВИ имеются сообщения об усилении передачи заболевания медицинским работникам, особенно медсестрам, во время эндотрахеальной интубации (ОР 6,6; 95% ДИ от 2,3 до 18,9) [29, 75, 76]. Хотя это открытие основано главным образом на ретроспективных обсервационных исследованиях, HFNC, по-видимому, не несет повышенного риска передачи заболевания. В исследованиях, оценивающих бактериальное загрязнение окружающей среды, риск загрязнения при HFNC сходен с риском обычного использования кислорода [77]. При эпидемии SARS медицинские работники, обеспечивающие HFNC, не подвергались повышенному риску развития заболевания [75]. Наконец, пациенты могут находить HFNC более комфортным или, по крайней мере, таким же удобным, как обычная кислородная терапия [71, 74]. Хотя некоторые авторы рекомендовали избегать использования HFNC у пациентов с COVID-19 из-за боязни передачи заболевания, исследования, поддерживающие этот совет, отсутствуют [78]. Хотя некоторые предлагают, чтобы пациенты носили лицевые маски во время процедуры HFNC, мы не уверены в эффективности и безопасности этого подхода. Этот вопрос может быть рассмотрен в будущих исследованиях.
У взрослых с COVID-19 и острой дыхательной недостаточностью мы предлагаем использовать HFNC вместо неинвазивной масочной вентиляции (NIPPV). В РКИ, сравнивающем HFNC с NIPPV у пациентов с острой гипоксической дыхательной недостаточностью, HFNC приводил к снижению смертности через 90 дней (ОР 2,50, 95% ДИ от 1,31 до 4,78), но не оказывал значительного влияния на необходимость интубации (50% частота неудач в NIPPV против 47% обычной ингаляции кислорода и 40% в группах HFNC; p = 0,18) [71]. Другой метаанализ, сравнивающий HFNC с NIPPV, показал, что HFNC снижает потребность в интубации пациентов, но без значительного снижения смертности или продолжительности пребывания в ОИТ [72]. Кроме того, пациенты могут находить HFNC более комфортным, чем NIPPV [71]. Принимая во внимание доказательства снижения риска интубации с помощью HFNC по сравнению с NIPPV при острой гипоксической дыхательной недостаточности, а также исследования, предполагающие, что NIPPV может нести больший риск внутрибольничной инфекции среди медицинских работников, мы предлагаем HFNC по сравнению с NIPPV. Тем не менее, любые пациенты, получающие HFNC или NIPPV, должны подвергаться тщательному мониторингу и лечению в условиях, когда при нарастании дыхательной недостаточности интубация трахеи может быть облегчить состояние пациента, поскольку частота неэффективности неинвазивных подходов может быть высокой, а экстренная интубация в неконтролируемой обстановке может увеличить риск внутрибольничной инфекции среди медицинских работников [79, 80].
У взрослых, страдающих гипоксической дыхательной недостаточностью в результате COVID-19, нет прямых доказательств в поддержку использования NIPPV. Более того, некоторые предыдущие исследования показали, что этот метод может быть связан с повышенным риском передачи инфекции медицинским работникам. Мета-анализ РКИ показал снижение риска как интубации, так и смертности при использовании НИППВ при гипоксической дыхательной недостаточности. Тем не менее, эти метаанализы включали исследования, куда вошли пациенты с ослабленным иммунитетом, острым кардиогенногым отеком легких или послеоперационные пациенты; поэтому их результаты могут быть в меньшей степени применимы к пациентам с COVID-19, у которых острая гипоксическая дыхательная недостаточность и ОРДС являются более частыми проявлениями. [43, 81-83] При острой гипоксической дыхательной недостаточности с этиологией, отличной от кардиогенного отека легких, NIPPV имеет высокую частоту неудач. В одном из рандомизированных клинических испытаний неэффективность метода была отмечена у 49% пациентов с гипоксической дыхательной недостаточностью, которым проводилась NIPPV; таким пациентам необходима интубация [71]. Кроме того, у пациентов с гипоксической дыхательной недостаточностью, получавших в исследовании NIPPV, была более высокая смертность (28%, 95% ДИ 21–37%), чем у пациентов, получавших обычную кислородную терапию (23%, 95% ДИ 16% -33%) или HFNC (13%, 95% ДИ (7-20%) (р = 0,02). У пациентов с Ближневостоным респираторным синдромом (MERS) NIPPV не ассоциировалась с улучшением показателей летальности или продолжительностью пребывания по на ИВЛ по сравнению с пациентами, которые были интубированы без применения NIPPV [79]. Тем не менее, NIPPV был связан с высокой частотой отсутствия эффекта (92,4%), что привело к интубации. Пациенты, которые получали NIPPV до интубации, имели повышенную потребность в ингаляционном оксиде азота и повышенную смертность [79]. Частота отказов при других пандемиях, таких как грипп, H1N1 и SARS, колеблется от 10% до 70%, в то время как демонстрация эффективности в основном основана на серии случаев и наблюдательных исследованиях, а не на РКИ, что приводит к изменению практики. В Китае широко распространено использование NIPPV при пандемической респираторной инфекции, в то время как рекомендации из Европы,
линии при H1N1 [84]. Существуют дополнительные опасения по поводу использования NIPPV при респираторных пандемиях, таких как COVID-19: NIPPV может усугублять тяжелые формы повреждения легких в результате повреждающего транспульмонального давления и больших дыхательных объемов [85, 86] и может задерживать начало инвазивной искусственной вентиляции легких, что приводит к экстренной или более проблемной интубации, которая может увеличить риск передачи инфекции медицинским работникам [85]. Кроме того, NIPPV является процедурой, генерирующей аэрозоль, которая может увеличить риск передачи заболевания медицинским работникам [29]. Несколько других исследований и мета-анализов при SARS также выдвинули на первый план риск внутрибольничного распространения заболевания при использовании NIPPV [76, 87] Баланс между пользой и вредом при использовании NIPPV у взрослых с COVID-19 неясен. Если у некоторых пациентов с COVID-19, как известно, причиной дыхательной недостаточности могут быть другие формы дыхательной недостаточности, такие как острая гиперкапническая дыхательная недостаточность или острый кардиогенный отек легких, NIPPV может быть полезной [88, 89]. Однако, поскольку ограниченный опыт применения NIPPV при пандемиях предполагает высокую частоту неудач, мы рекомендуем тщательно следить за любым пациентом, получающим NIPPV, и лечить его в обстановке, где интубация может быть выполнена без проблем в случае декомпенсации [79, 80]. Однако, когда в условиях ограниченных ресурсов, может быть недостаточно возможностей для обеспечения инвазивной вентиляции, и даже умеренные шансы на успех с NIPPV могут оправдать его использование. Если используется NIPPV, то шлем для NIPPV является привлекательным вариантом. Одноцентровое РКИ показало снижение интубации и снижение смертности от НИППВ, при использовании шлема, у пациентов с ОРДС [90]. Особую роль в условиях пандемии, такой как COVID-19, играет то, что NIPPV с помощью шлема уменьшает рассеивание выдыхаемого воздуха, тогда как маски для лица были для этого не годились [91]. Однако шлем NIPPV стоит дороже, и без прямых доказательств пользы у пациентов с COVID-19, ресурсы не должны использоваться для приобретения этого оборудования,
если оно еще не доступно. Рисунок 2 суммирует рекомендации по HFNC и NIPPV у пациентов с COVID-19.
|
|||||||||||||||||||||||||||||||||||||||
|
Последнее изменение этой страницы: 2020-11-11; просмотров: 60; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 3.144.243.184 (0.078 с.) |