
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Основы химической термодинамики
Химическая термодинамика занимается изучением химических процессов с термодинамической точки зрения и в отличие от технической рассматривает явления, в которых происходят внутримолекулярные изменения рабочего тела при сохранении атомами молекул своей индивидуальности. Образование новых веществ (рабочего тела) или разложение веществ осуществляется в результате химической реакции. Для химического процесса характерно изменение числа и расположения атомов в молекуле реагирующих веществ. В ходе реакции разрушаются старые и возникают новые связи между атомами. В результате действия сил связей происходит выделение или поглощение энергии. Энергия, которая может проявляться только в результате химической реакции, называется химической. Химическая энергия представляет собой часть внутренней энергии системы, рассматриваемой в момент химического превращения, ибо в запас внутренней энергии входит не только кинетическая и потенциальная энергия молекул, но и энергия электронов, энергия, содержащаяся в атомных ядрах, лучистая энергия. Отличительным признаком химической реакции является изменение состава системы в результате перераспределения массы между реагирующими веществами в изолированной системе. Если же система не изолирована от окружающей среды, то свойства ее должны зависеть также от количества вещества, введенного в систему или выведенного из нее. Если, например, в калориметрическую бомбу поместить смесь из двух объемов водорода и одного объема кислорода (гремучий газ), то, несмотря на отсутствие теплообмена, происходит реакция с образованием водяного пара:
Реакция протекает с заметной скоростью при температуре 600 °С или в присутствии катализатора (платины) при комнатной температуре. Эти условия представляют собой внешние воздействия, но сама реакция протекает в условиях полной изоляции. В результате реакции происходит перераспределение массы. Масса Н2 и О2 уменьшается, а масса Н2О увеличивается. В реакции разложения
масса Н2О уменьшается, а, масса Н2 и О2 увеличивается. Таким образом, в химических реакциях масса является величиной, характеризующей состояние системы, т.е. для химических превращений масса является дополнительной координатой состояния.
Процесс перераспределения массы в изолированной системе может произойти только в результате внутренней неравновесности, и возникновение процесса в такой системе возможно лишь при существовании неравновесного поля потенциала, который был назван химическим. Неравновесное поле химического потенциала и является движущей силой химических реакций. В процессе перераспределения массы системы происходит изменение внутренней энергии, энтальпии, энтропии и ряда других функций состояния. Изменение внутренней энергии в ходе химической реакции может проявляться только в виде теплоты или в виде работы. Так, результатом реакции гремучего газа после выравнивания температур будет отдача теплоты окружающей среде. Это термодинамический процесс. Если же эту реакцию осуществить в цилиндре двигателя, то водяной пар совершит, воздействуя на поршень, определенную работу. Взяв состояние смеси до сгорания за начальное и состояние водяного пара после расширения в цилиндре за конечное, будем иметь дело с чисто термодинамическим процессом взаимодействия с окружающей средой. Таким образом, химическая реакция может рассматриваться как термодинамический процесс. В химической термодинамике основные законы термодинамики и общие методы исследования применяются для изучения химических процессов. При этом может быть установлен энергетический баланс химической реакции, направление ее возможного развития, скорость реакции и т.п. Из химических процессов для широкого круга специалистов наибольший интерес представляют реакции горения (процесс окисления топлив), ибо выделившаяся в процессе горения теплота в двигателях может быть преобразована в механическую работу.
Топливо и основы горения Общие сведения Топливом называют различные естественные и искусственные вещества, при сжигании которых выделяется большое количество тепла и которое технически выгодно использовать для получения тепловой энергии. Топливо, добываемое из недр земли в готовом виде, называют естественным (уголь, торф, сланцы, газ), а получаемое путём переработки горючих веществ и природного топлива – искусственным (кокс доменных печей, моторные топлива, коксовый и генераторный газ и др.)
До недавнего времени потребность в топливе наша страна удовлетворяла в основном за счёт ископаемых углей. В последнее время сдвиг в структуре топливного баланса произошёл в сторону нефтепереработки и добычи газа. Элементарный состав топлива В элементарный химический состав входят горючие вещества: углерод С, водород Н, сера S. Кроме того, топливо содержит кислород О,азот N,находящиеся в сложных соединениях, негорючие минеральные вещества, превращающиеся при сжигании в золу А и влагу W. Углерод С – основная составляющая топлива, в котором он находится в виде сложных соединений с другими элементами. Содержание его в антраците до 93 %, в мазуте до 85 %, в древесине около 50 %. Теплота сгорания углерода около 33 МДж/кг. Водород Н – имеется во всех топливах в количестве 3…5 % и только в мазуте его содержание составляет 12…14 %. Водород находится в топливе в виде различных соединений. Горит только водород не связанный с кислородом топлива. Теплота сгорания водорода 120 МДж/кг. Сера S – в топливе бывает в основном в двух видах: в сернистых соединениях с металлами (FeS2, ZnS и др.) и в сернокислых соединениях (FeSO4, MgSO4, CaSO4 и др.). В первом случае сера может гореть и составляет летучую горючую серу. Во втором случае сера не горит. В твёрдом топливе содержание серы достигает 8 %, в жидком Кислород О – является балластом топлива, так как вступая с горючими элементами в реакцию, окисляет их и этим понижает тепловую ценность топлива. Содержание кислорода колеблется от долей процента в мазуте и каменных углях до 45 % в дровах. Азот N2 – элемент инертный, не участвующий в реакции горения. В твёрдом топливе содержание доходит до 3 %, в мазуте доли процента. Азот топлива при температуре свыше 1550 оС превращается в токсичные окислы NO и NO2. Зола А представляет собой негорючую минеральную часть топлива. Зольность колеблется от долей процента в мазуте до 55 % в угле. Влага W, находящаяся в топливе, понижает его тепловую ценность, так как на её испарение расходуется часть тепла топлива. В жидком топливе влага составляет около 1 %, в газообразном её почти нет, а в углях – 1,5…2,5 %. Характеристики топлива Элементарный состав топлива в процентах по массе выражается следующей формулой:
Это так называемая рабочая масса топлива, то есть такой его состав, в каком оно подаётся в топку. Рабочая массане даёт возможность судить о топливе как о горючем, так как она неустойчива и зависит от способа его добычи, перевозки и хранения. Содержание золы и влаги значительно колеблется, поэтому в различных расчётах и изучении свойств топлива приходится пользоваться искусственно созданными производными этого основного состава, лишая его того или иного компонента. Путём искусственной подсушки пробы при
Так как азот и кислород находятся в топливе в связанном состоянии, то, исключив золу, получим горючую массу:
Такое деление на массы условно. Технические условия на поставку топлива даются по горючей массе, так как она является более устойчивой. В теплотехнических расчётах принято иметь дело с рабочей массой.
Для вывода пересчетной формулы с одной массы на другую, например из горючей в рабочую, запишем:
Тогда, если обозначим через
Аналогично можно найти все коэффициенты. Наряду с элементарным составом, одной из основных характеристик топлива является его теплота сгорания. Различают высшуюи низшую теплоту сгорания. Высшей теплотой сгорания называется количество теплоты, которая выделяется при полном сгорании 1 кг топлива с последующим охлаждением продуктов сгорания до температуры конденсации водяных паров и использование теплоты конденсации для нагрева. Низшей теплотой сгорания называется количество теплоты, которая выделяется при полном сгорании 1 кг топлива без использованиятеплоты конденсации водяных паров для нагрева. Пересчёт высшей теплоты сгорания на низшую производится следующим образом. Если учесть, что теплота испарения воды равна примерно 2500МДж/кг и что при окислении одной массовой единицы водорода получается девять массовых единиц воды, то теплота, потребная на испарения воды, будет равна:
откуда
Если условно принять, что горючие элементы в топливе находятся в виде механической смеси, то можно вывести приближенную формулу для оценки Д.И. Менделеев получил полуэмпирическое выражение:
где три первые коэффициента, умноженные на 100, выражают теплоту сгорания углерода, водорода и серы, а четвёртый – теплоту парообразования воды. Закон Гесса Закон Гесса, называемый иначе законом постоянства сумм тепла, гласит, что общий тепловой эффект ряда последовательных превращений (химических реакций) зависит только от начального (топливо – воздух) и конечного (продуктов сгорания) состояния, но не зависит от пути, по которому протекает процесс. Согласно закону Гесса для определения количества тепла, выделяющегося в результате сгорания топлива, нет необходимости знать, какие реакции в какой последовательности проходят, а нужно только знать начальное состояние системы «топливо – воздух» и её конечное состояние (состав продуктов сгорания). Горение – это окисление горючих элементов топлива кислородом, сопровождающееся выделением теплоты. В зависимости от скорости распространения пламени различают нормальное горение и горение со взрывом. При нормальном горении скорость распространения пламени равна 15…20 м/с, а при взрыве 2000…3000 м/с. Чтобы топливо начало гореть его необходимо нагреть до определённой температуры, называемой температурой воспламенения.
Горение топлива может быть: · полным – с образованием негорючих продуктов сгорания (углекислоты СО2,водяных паров H2 O, сернистого ангидрида S2 O); · неполным, когда в составе продуктов сгорания имеются СО, СН4 и Н2 и различные углеводороды. Содержание углеводородов невелико и ими пренебрегают. Обычно показателем неполноты сгорания топлива является наличие окиси углерода СО в продуктах сгорания. На основании закона Гесса можно ограничится рассмотрением конечных реакций горения, опустив все промежуточные, что значительно упрощает все расчеты.
|
||||||||
|
Последнее изменение этой страницы: 2020-10-24; просмотров: 73; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.118.102.225 (0.018 с.) |
 .
.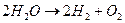 .
. .
.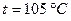 можно удалить всю влагу, как внешнюю, так и внутреннюю, и тогда останется сухая масса:
можно удалить всю влагу, как внешнюю, так и внутреннюю, и тогда останется сухая масса: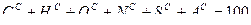 .
.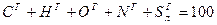 .
.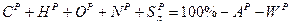 .
. содержание какого-либо элемента в рабочей массе, а через
содержание какого-либо элемента в рабочей массе, а через 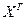 – в горючей, то, очевидно, можно написать:
– в горючей, то, очевидно, можно написать: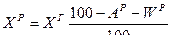 .
. ,
,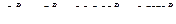 .
.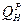 .
. ,
,


