
Заглавная страница Избранные статьи Случайная статья Познавательные статьи Новые добавления Обратная связь КАТЕГОРИИ: ТОП 10 на сайте Приготовление дезинфицирующих растворов различной концентрацииТехника нижней прямой подачи мяча. Франко-прусская война (причины и последствия) Организация работы процедурного кабинета Смысловое и механическое запоминание, их место и роль в усвоении знаний Коммуникативные барьеры и пути их преодоления Обработка изделий медицинского назначения многократного применения Образцы текста публицистического стиля Четыре типа изменения баланса Задачи с ответами для Всероссийской олимпиады по праву 
Мы поможем в написании ваших работ! ЗНАЕТЕ ЛИ ВЫ?
Влияние общества на человека
Приготовление дезинфицирующих растворов различной концентрации Практические работы по географии для 6 класса Организация работы процедурного кабинета Изменения в неживой природе осенью Уборка процедурного кабинета Сольфеджио. Все правила по сольфеджио Балочные системы. Определение реакций опор и моментов защемления |
Обратимые процессы и их свойства
Изменение состояния рабочего тела, при котором параметры состояния (все или некоторые) изменяются, а масса рабочего тела, совершающего процесс, остается неизменной, называется термодинамическим процессом. В теплотехнике наибольший интерес представляют процессы, которые протекают в тепловых машинах. Однако термодинамическое исследование таких процессов затруднено из-за ряда явлений, сопровождающих их протекание (образования вихрей в рабочем теле, вызываемых большими скоростями, теплового излучения в атмосферу, трения и др.). Поэтому в термодинамике рассматриваются упрощенные, идеализированные процессы, которые могут быть теоретически исследованы. Характерной чертой таких упрощенных процессов является их обратимость. Обратимыми называются процессы, после совершения которых в прямом и обратном направлениях, вся система тел, принимавших участие в процессе, возвращается в свое первоначальное состояние. В обратимом термодинамическом процессе линии прямого и обратного процессов сливаются. При этом работа в прямом и обратном направлениях определяется одной и той же площадью, т.е. она будет одинаковой по абсолютному значению, отличаясь только знаком. Равенство абсолютных значений работ означает и равенство абсолютных значений подводимой и отводимой теплоты. Все обратимые процессы – равновесны. Выясним, что же понимают под равновесным процессом. Допустим, что в цилиндре сжимается рабочее тело и одновременно подводится теплота. В реальных условиях повышение температуры происходит не одновременно по всей массе рабочего тела, а постепенно от нагревающей поверхности внутрь. Кроме того, слои расположенные у поршня, сжаты больше, и выравнивание давления происходит постепенно от поршня к крышке цилиндра. Таким образом, в реальных тепловых машинах температура и давление не одинаковы по всей массе рабочего тела. Такое состояние называется неравновесным, а процессы, в которых рабочее тело проходит через неравновесные состояния – неравновесными. Но, если в пространстве, занимаемом телом, температура и давление не одинаковы, то невозможно изобразить такое состояние точкой, а процесс линией. Поэтому для исследования неравновесных процессов нельзя использовать способ графического изображения и применять уравнения состояния. Чтобы упростить расчеты и исследование, в термодинамику введено понятие обратимых и равновесных процессов, которые позволяют получить результаты с достаточной для практики степенью точности.
Основные термодинамические процессы В термодинамике рассматриваются пять основных процессов идеальных газов: 1) изохорный, происходящий при постоянном объеме газа (v = const); 2) изобарный, происходящий при постоянном давлении газа (р = const); 3) изотермический, происходящий при постоянной температуре газа (Т = const); 4) адиабатный, происходящий без подвода или отвода теплоты, т.е. протекающий без теплообмена с окружающей средой (q = const); 5) политропный – обобщенный процесс изменения всех параметров рабочего тела, для которого четыре предыдущих процесса являются частными случаями.
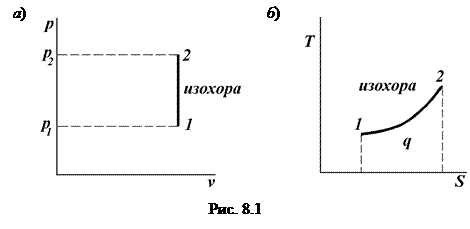
Изохорный процесс Изохорным процессом называется такое изменение состояния рабочего тела, при котором удельный объем его остается постоянным. Этот процесс может происходить только в замкнутом пространстве постоянного объема при подводе теплоты к рабочему телу или отводе теплоты от него. Уравнение изохорного процесса: v = const.
Найдем связь между параметрами в изохорном процессе. Запишем уравнение состояния газа в точках 1 и 2 (рис. 8.1):
Разделим первое уравнение на второе, и с учетом того, что v 1 = v 2, получим:
В изохорном процессе все подведенное тепло идет на повышение внутренней энергии тела. Для 1 кг газа можно записать:
Для произвольной массы вещества:
Для идеальных газов интегрирование приводит к выражениям:
Так как в изохорном процессе удельный объем газа не изменяется (dv = 0), то работа изменения объема равна нулю. Работа изменения давления в изохорном процессе согласно уравнению (6.8) равна:
Поскольку работа изменения объема не совершается, то подведенное к рабочему телу количество теплоты равно изменению внутренней энергии тела:
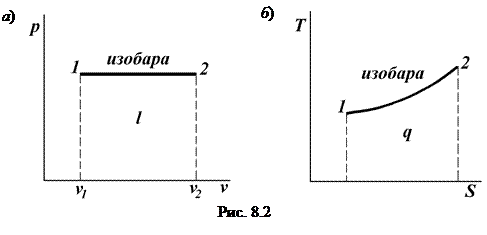
Изобарный процесс Изобарным процессом называется такое изменение состояние рабочего тела, при котором давление его остаётся постоянным. Этот процесс может быть осуществлён в цилиндре с подвижным поршнем.
Уравнение изобарного процесса: р = const.
Графическое изображение изобарного процесса в pv - и TS -диаграммах показано на рис. 8.2. Связь между параметрами в изобарном процессе определяется следующим образом. Запишем уравнение состояния газа в точках 1 и 2 (рис. 8.2):
Разделив первое уравнение на второе, с учетом того, что р1 = р2, получим:
Изменение внутренней энергии газа в изобарном процессе для 1 кг газа и для произвольной массы соответственно равно:
Работа изменения объема в изобарном процессе для 1 кг идеального газа и для произвольной массы газа соответственно равна:
В изобарном процессе работа изменения давления равна нулю. Подведенная к газу теплота в изобарном процессе находится из выражения:
Количество теплоты, подведенной к произвольной массе газа, равно:
Изотермический процесс Изотермическим процессом называется такое изменение состояние рабочего тела, при котором его температура остаётся постоянной. Уравнение изотермического процесса: Т = const. Графическое изображение изотермического процесса в pv - и TS -диаграммах представлено на рис 8.3.
Запишем уравнение состояния газа в точках 1 и 2 (рис 8.3):
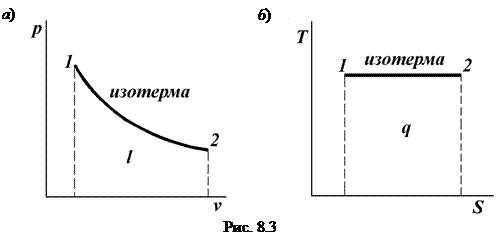
Разделив первое уравнение на второе, с учетом того, что Т1 = Т2, получим следующую связь между параметрами газа в изотермическом процессе:
Так как в изотермическом процессе Т1 = Т2, то изменение внутренней энергии газа равно нулю. Исходя из того, что в изотермическом процессе RT = const, получим следующее выражение для определения работы изменения объема (для 1кг идеального газа и для произвольной массы газа m):
Исходя из того, что в изотермическом процессе
Теплота в изотермическом процессе полностью расходуется совершение работы:
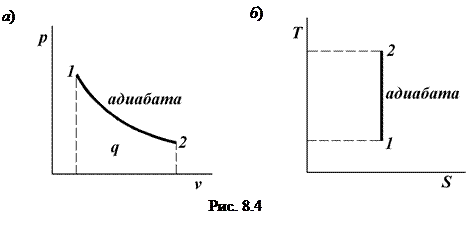
Адиабатный процесс Адиабатным называется процесс изменения состояния рабочего тела без отвода и подвода теплоты. Уравнение адиабатного процесса: pvk = const, где k = cp / cv – показатель адиабаты. Графическое изображение адиабатного процесса в pv- и TS- диаграммах показано на рис. 8.4. Заметим, что адиабата идет круче изотермы, так как
или
что равносильно
Для того чтобы определить зависимость между удельным объемом (v)и температурой (T),запишем уравнения состояния для двух точек:
и, поделив их друг на друга, получим:
С учетом формулы (8.2) имеем:
откуда
Связь между давлением (р)и температурой (Т) найдем путем совместного решения уравнений (8.3) и (8.4), т.е. получим:
или
Изменение внутренней энергии газа в адиабатном процессе находится по формулам:
Для вывода формулы по расчету работы изменения объема воспользуемся первым законом термодинамики:
Так как в адиабатном процессе
Разделим левую и правую часть уравнения Майера
на
откуда
Тогда имеем:
Связь между работой изменения объема и работой изменения давления найдем с помощью формулы по определению показателя адиабаты. После умножения числителя и знаменателя уравнения
Сравнивая последнее выражение с выражением (8.5) видим, что знаменатель дроби равен работе изменения объема. Исходя из того, что
Следовательно:
Политропный процесс В политропном процессе, как и в адиабатном, изменяются все параметры, но возможен подвод или отвод теплоты, согласно определенному закону. Уравнение адиабатного процесса: pv п = const, где п – показатель политропы и для любых политропных процессов он может принимать значения от -∞ до +∞. Политропный процесс обобщает все рассмотренные ранее процессы: · при п = 1 процесс изотермический; · при п= 0 процесс изобарный; · при п = ±∞ · при п = k процесс адиабатный. Графическое изображение политропного процесса в pv - и TS -диаграммах показано на рис. 8.5. Зависимость между параметрами в политропном процессе аналогична зависимостям, установленным для адиабатного процесса, а именно:
Работа изменения объема и связь этой работы с работой изменения давленияопределяются, как и в адиабатном процессе:
Подведенное к газу в политропном процессе удельное количество теплоты находится по формуле:
Подставляя в последнее выражение формулу (8.6), получим:
Величину Тогда окончательно имеем:
Примеры решения задач Пример 8.1 В баллоне вместимостью 15 л содержится воздух под давлением 0,4 МПа и при температуре 30 °С. Какова температура воздуха в результате подвода к нему 16 КДж теплоты? Удельная изохорная теплоёмкость воздуха Решение Предварительно вычислим массу воздуха (m) по уравнению состояния.
Здесь газовая постоянная воздуха R = 287,1 Дж/(кг·К) определена из приложения 1.
Конечную температуру процесса (
откуда
Пример 8.2 Найти, какая часть теплоты, подведённой в изобарном процессе к двухатомному идеальному газу, расходуется на увеличение его внутренней энергии. Решение Удельное количество теплоты, подведённое в изобарном процессе равно:
Из этого количества теплоты на увеличение его внутренней энергии затрачивается
Следовательно, доля теплоты, затрачиваемая на изменение внутренней энергии, равна:
Пример 8.3 Азот массой 0,5 кг расширяется по изобаре при давлении 0,3 МПа так, что температура его повышается от 100 до 300 °С. Найти конечный объем азота, совершенную им работу и подведенную теплоту. Решение Предварительно по приложению 1 находим удельную газовую постоянную азота, которая равна R = 296,8 Дж/(кг·К). Определим начальный объем азота из уравнения состояния: Теперь найдем конечной объем:
Определим работу изменения объема:
Работа изменения давления W = 0. Определим теплоту, подведенную к газу, по формуле (8.1) с заменой разности
Пример 8.4 В компрессоре сжимается воздух массой 2 кг при постоянной температуре 200°С от р1 = 0,1 МПа до р2 = 2,5 МПа. Найти массу воды (тв),необходимую для охлаждения сжимаемого воздуха, если начальная температура воды 15 °С, а конечная 50 °С, удельная теплоемкость воды св = 4,19 кДж/(кг·К). Решение Найдем работу сжатия, предварительно определив из приложение 1 газовую постоянную воздуха R = 287,1 Дж/(кг·К):
Так как в изотермическом процессе Q = L, то Q = -873,3 кДж. Это значит, что в результате работы сжатия внутренняя энергия сжимаемого воздуха должна была увеличиться на 873,3 кДж. Для сохранения температуры постоянной столько же теплоты нужно отвести от воздуха путем охлаждения его водой. Искомое количество воды найдем с помощью формулы (5.2):
Из этого уравнения получаем:
Пример 8.5 Воздух массой 2 кг при давлении р1 = 1 МПа и температуре t 1 = 300 °С расширяется по адиабате так, что объем газа увеличивается в 5 раз. Найти конечные объем, давление, температуру, работу изменения объема и изменение внутренней энергии. Решение Найдем начальный объем газа (V 1) из уравнения состояния (удельную газовую постоянную воздуха R = 287,1 Дж/(кг·К) находим из приложения 1):
По условию конечный объем V 2 = 5 V 1, поэтому V 2 = 5·0,33 = 1,65 м3. Примем для воздуха значение показателя адиабаты k = 1,4 (как для смеси двухатомных газов), и найдем конечное давление (р2):
Отсюда р2 = р 1 /9,52 = 1·106 / 9,52 = 0,1 МПа.
Воспользовавшись уравнением состояния, найдем конечную температуру:
или t 2 = (287 – 273) = 14 °С. Для вычисления работы (L) воспользуемся уравнением:
Изменение внутренней энергии в адиабатном процессе равно работе изменения объема, поэтому
Пример 8.6 Процесс расширения газа происходит по политропе с показателем n = 0,8. Определить условия протекания процесса. Решение В данном процессе n < 1. Следовательно, линия процесса должна располагаться не только выше адиабаты, но и выше изотермы, а поэтому теплота к газу должна подводиться, температура повышаться, а внутренняя энергия увеличиваться. Это означает, что теплота к газу подводится извне в большом количестве, чем это нужно для работы (l), поэтому часть подведенной теплоты идет на повышение внутренней энергии. 8.9. Задачи для самостоятельного решения 8.1. Сколько теплоты нужно сообщить при постоянном объёме газовой смеси массой 1 кг при давлении 1,2 МПа и температуре 390 °С, чтобы повысить давление до Ответ: 1,48 МДж. 8.2. В пусковом баллоне дизеля находится воздух под давлением Ответ: 8.3. Воздуху сообщается 42 кДж теплоты при постоянном давлении. Найти совершенную при этом работу, если ср = 1,01 кДж/(кг·К). Ответ:11,9 кДж. 8.4. Воздух объемом 3 м3 при температуре 10 °С расширяется изобарно с увеличением объема в 1,5 раза вследствие подвода к нему 630 кДж теплоты. Найти давление, при котором происходит процесс расширения, и совершенную при этом работу, если Ответ: р = 120 кПа; L = 180 кДж. 8.5. Объем воздуха массой 1 кг при 40 °Сизотермически увеличен в 1,5 раза. Найти удельную работу изменения объема и подведенную теплоту. Ответ: l = q = 36,4 кДж/кг, 8.6. При изотермическом сжатии азота массой 2,1 кг, взятого при 60 °С и 0,1 МПа, отводится 340 кДж теплоты. Найти конечный объем и конечное давление. Ответ: V 2 = 0,386 м3; р2 = 22,3 кПа. 8.7. К воздуху объемом 0,1 м3 при давлении 1 МПа и постоянной температуре Ответ: р2 = 283 кПа; V 2 = 0,35 м3. 8.8. От воздуха объемом 0,1 м3 при начальном давлении 1 МПа и постоянной температуре отводится 126 кДж теплоты. Найти конечные давление и объем. Ответ: р2 = 3,53 МПа; V 2 = 0,0278 м3. 8.9. Воздух с начальным объемом 8 м3 при давлении 90 кПа и температуре 20 °С изотермически сжимается до давления 0,8 МПа. Найти конечный объем и работу изменения объема. Ответ: V 2 = 0,889 м3; L = – 1,55 МДж. 8.10. Воздух при начальных давлении 0,5 МПа и температуре 40 °С адиабатно расширяется до давления 0,15 МПа. Во сколько раз должен увеличиться его объем и какова будет конечная температура? Ответ: V 2 / V 1 = 2,36; t 2 = -51 °С. 8.11. Смесь светильного газа и воздуха (k = 1,38) давлением 90 кПа и температурой 50 °С адиабатно сжимается до объема в 5 раз меньшего, чем начальный. Найти конечные давление и температуру. Ответ: р2 = 830 кПа; Т2 = 596 К. 8.12. Сжатый воздух при давлении 1 МПа и температуре 50 °С должен адиабатно расширяться до давления 50 кПа. Во сколько раз увеличиться при этом объем воздуха, какова будет конечная температура и работа изменения объема, если начальный объем V 1 = 1 м3. Ответ: V 2 / V 1 = 8,52; T 2 = 137 К; L = 1,44 МДж. 8.13. Воздух при начальных давлении 0,1 МПа и температуре 15 °С адиабатно сжимается до давления 0,8 МПа. Найти конечные удельный объем и температуру, а также удельную работу изменения давления. Ответ: v 2 = 0,191 м3/кг; Т2 = 522 К; l = -234 Дж/кг. 8.14. В цилиндре дизеля адиабатно сжимается воздух массой 0,03 кг, причем в начале сжатия объем цилиндра, заполняемого воздухом равен 0,03 м3, а давление 93 кПа. Чему равна температура воздуха в конце сжатия, если при этом объем его уменьшится в 13,5 раз? Ответ:1139 К. 8.15. Газ, занимающий объем 6 м3, сжимается политропно от давления 1 МПа до Ответ: n = 1,26; L = -7,69 МДж. 8.16. Воздух объемом 3 м3 расширяется от давления 0,55 МПа и температуры Ответ: n = 1,08; Т 2 = 289 К; W = 2,03 МДж. 8.17. Воздух объемом 1,5 м3 сжимают от давления 0,1 МПа и температуры 17 °С до давления 0,7 МПа и температуры 100 °С. Найти показатель политропы и работу изменения объема. Ответ: n = 1,15; L = -286 кДж. 8.18. Найти работу изменения объема, изменение внутренней энергии и подведенную теплоту при политропном расширении воздуха массой 5 кг при условии, что его начальная температура t 1 = 150 °С, конечная t 2 = 50 °С и показатель политропы n = 1,3. Ответ: L = 478 кДж; 8.19. Воздух расширяется политропно с показателем n = 1,45. Как будет изменяться температура воздуха? Ответ: температура воздуха будет понижаться. 8.20. Воздух совершает работу изменения объема, расширяясь политропно с показателем n = 1,35. Выяснить, совершается ли эта работа только за счет подводимой теплоты или также за счет внутренней энергии воздуха? Ответ: работа изменения объема будет производиться за счет подводимой теплоты и за счет внутренней энергии воздуха. 8.21. Как отразится на показателе политропы расширение газов в цилиндре двигателя внутреннего сгорания, увеличение притока охлаждающей воды? Ответ: показатель политропы уменьшиться. 8.22. Газ сжимается политропно с показателем n = 0,9. Как при этом будет изменяться внутренняя энергия газа? Ответ: внутренняя энергия будет уменьшаться. Термодинамические циклы Прямые и обратные циклы Состояние рабочего тела определяется его параметрами. Под воздействием внешних сил рабочее тело изменяет свое состояние, связанное с изменением его параметров, т.е, протекает термодинамический процесс. Последовательный ряд термодинамических процессов, в которых рабочее тело претерпевает изменение и в результате возвращается в первоначальное состояние, называется круговым процессом или циклом. Циклы подразделяются на прямые и обратные. Прямыми называют циклы, в которых теплота преобразуется в работу, обратными – в которых теплота передается от более холодного тела к более нагретому. Прямые циклы изображаются в диаграммах линиями, идущими по часовой стрелке (по таким циклам работают тепловые двигатели), обратные циклы – линиями, идущими против часовой стрелки (по таким циклам работают холодильные машины и тепловые насосы). Прямой цикл Рассмотрим систему, состоящую из двух источников теплоты и рабочего тела. При изучении идеальных циклов процесс подвода теплоты рассматривается без изменения химического состава рабочего тела. В большинстве реально существующих двигателей теплота подводится в процессе сгорания топлива. Процесс отвода теплоты рассматривается как передача теплоты к источнику с низкой температурой. В реальных двигателях теплота может отводиться вместе с выпуском отработавшего рабочего тела (пара или газа) в атмосферу. В pv -диаграмме прямой цикл изображается так, как показано на рис. 9.1.
В процессе 2–d–1 рабочее тело взаимодействует с источником низких температур. При этом происходит отвод теплоты q 2 от рабочего тела и его сжатие. В процессе сжатия затрачивается работа, величина которой равна площади a–1–d–2–b–a. Из диаграммы видно, что работа расширения больше работы сжатия. Полезная работа равна разности работ расширения и сжатия:
В результате совершения такого цикла получается полезная работа, которую затем можно использовать для различных целей. В соответствие с первым законом термодинамики
Для оценки степени совершенства прямых циклов используется термический коэффициент полезного действия (
Обратный цикл Пусть имеется два источника теплоты и рабочее тело, над которым совершается работа. Рабочее тело переносит теплоту q 2 от источника с низкой температурой к источнику с более высокой температурой. На совершение такого несамопроизвольного процесса затрачивается работа l ц. Процесс расширения рабочего тела осуществляется с подводом теплоты q 2 по линии 1–d–2 (рис. 9.2). В этом процессе полезная работа равна площади 1–d–2–b–a–1. В процессе сжатия 2–с–1 рабочее тело взаимодействует с источником с более высокой температурой, передавая ему теплоту q 1. В процессе сжатия затрачивается работа, равная площади 2–c–1–a–b–2.
Для оценки работы холодильных машин применяется холодильный коэффициент, равный отношению полезного количества теплоты (q 2), отнятого от холодного источника, к затраченной работе:
В холодильной машине количество теплоты q 1 выбрасывается в окружающую среду, т.е. в источник неограниченных размеров. Машины, предназначенные для дальнейшего использования теплоты q 1 и передачи ее в источник ограниченных размеров, называют тепловыми насосами. Эффективность работы тепловых насосов оценивается отопительным коэффициентом, представляющим собой отношение количества теплоты (q 1), переданного потребителю, к затраченной работе:
|
|||||||||||||||
|
Последнее изменение этой страницы: 2020-10-24; просмотров: 533; Нарушение авторского права страницы; Мы поможем в написании вашей работы! infopedia.su Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. Обратная связь - 18.223.119.17 (0.153 с.) |
 .
.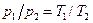 .
.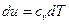 .
.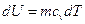 .
.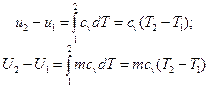 .
.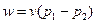 .
.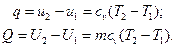
 .
.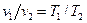 .
.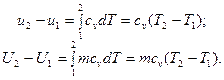
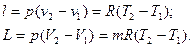
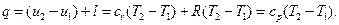 (8.1)
(8.1)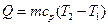 .
.
 .
.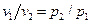 .
.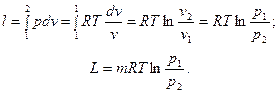
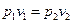 на основании уравнения (6.9) устанавливаем, что в изотермическом процессе работа изменения давления равна работе изменения объема:
на основании уравнения (6.9) устанавливаем, что в изотермическом процессе работа изменения давления равна работе изменения объема: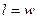 .
.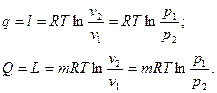
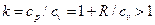 .
.
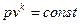 , то для двух точек процесса имеем:
, то для двух точек процесса имеем: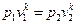
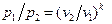 , (8.2)
, (8.2)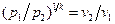 . (8.3)
. (8.3) ,
,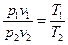 . (8.4)
. (8.4)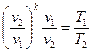 ,
,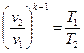 .
.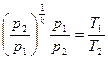
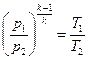 .
.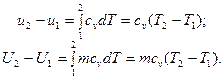
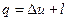 .
.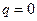 , то
, то 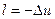 . Следовательно:
. Следовательно: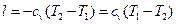 . (8.5)
. (8.5)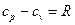
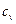 . С учетом того, что
. С учетом того, что 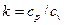 , получим:
, получим: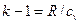
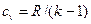 . (8.6)
. (8.6)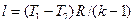 .
.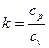 на (
на (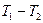 ) получим:
) получим: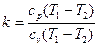 .
.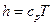 , на основании формулы (6.11) и, учитывая, что в адиабатном процессе
, на основании формулы (6.11) и, учитывая, что в адиабатном процессе 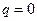 , имеем:
, имеем: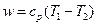 .
.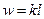 .
.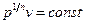 , и политропный процесс вырождается в изохорный;
, и политропный процесс вырождается в изохорный; ,
,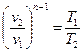 ;
; 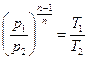 .
.
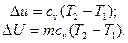
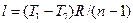 ;
;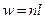 .
.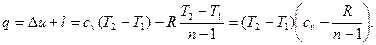
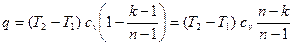 .
.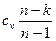 обозначают через
обозначают через 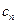 и называют теплоемкостью политропного процесса.
и называют теплоемкостью политропного процесса.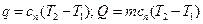 .
.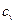 равна 736 Дж/(кг·К).
равна 736 Дж/(кг·К).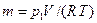 = 0,4·106 · 0,015 / (287,1 · 303) = 0,069 кг.
= 0,4·106 · 0,015 / (287,1 · 303) = 0,069 кг.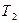 ) найдём из уравнения:
) найдём из уравнения: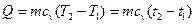 ,
,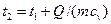 = 30 + 16·103 / (0,069 · 736) = 345 °С.
= 30 + 16·103 / (0,069 · 736) = 345 °С.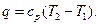
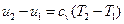 .
.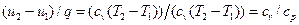 .
.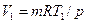 = 0,5·296,8·373 / (0,3·106) = 0,184 м3.
= 0,5·296,8·373 / (0,3·106) = 0,184 м3.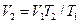 = 0,184·573 / 373 = 0,284 м3.
= 0,184·573 / 373 = 0,284 м3.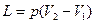 = 0,3·106 (0,284 – 0,184) = 30·103 Дж = 30 кДж.
= 0,3·106 (0,284 – 0,184) = 30·103 Дж = 30 кДж.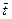 = (t 2 + t 1) / 2 = (300 + 100) / 2 = 200 °С;средняя удельная изобарная теплоемкость равна 1,052 кДж/(кг·К). Следовательно:
= (t 2 + t 1) / 2 = (300 + 100) / 2 = 200 °С;средняя удельная изобарная теплоемкость равна 1,052 кДж/(кг·К). Следовательно: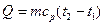 = 0,5·1,052·103 (300 – 100) = 105,2 кДж.
= 0,5·1,052·103 (300 – 100) = 105,2 кДж.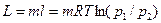 = 2·287,l · 473·ln (0,1 / 2,5) = -873,3 кДж.
= 2·287,l · 473·ln (0,1 / 2,5) = -873,3 кДж.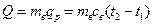 .
.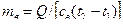 = 873,3·103 / (4,19·103 · (50 – 15)) = 5,95 кг.
= 873,3·103 / (4,19·103 · (50 – 15)) = 5,95 кг.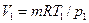 = 2 · 287,1 · 573 / (1·106) = 0,33 м3.
= 2 · 287,1 · 573 / (1·106) = 0,33 м3.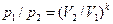 = 51,4 = 9,52.
= 51,4 = 9,52.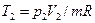 = 0,1·10б · 1,65 / (2 · 287,1) = 287 К
= 0,1·10б · 1,65 / (2 · 287,1) = 287 К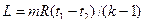 = 2 · 287,1 (300 – 14) / (1,4 – 1) = 411·103 Дж = 411 кДж.
= 2 · 287,1 (300 – 14) / (1,4 – 1) = 411·103 Дж = 411 кДж.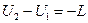 = -411 кДж.
= -411 кДж.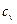 = 956 Дж/(кг·К).
= 956 Дж/(кг·К).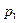 = 2,4 МПа и при температуре
= 2,4 МПа и при температуре 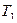 = 500 К. Найти давление в баллоне при охлаждении воздуха в нём до 15 °С и количество выделенной при этом теплоты, если вместимость баллона 0,5 м3, а удельная теплоёмкость
= 500 К. Найти давление в баллоне при охлаждении воздуха в нём до 15 °С и количество выделенной при этом теплоты, если вместимость баллона 0,5 м3, а удельная теплоёмкость 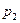 = 1,38 МПа;
= 1,38 МПа; 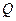 = 1,3 МДж.
= 1,3 МДж.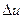 = -361 кДж; Q = 117 кДж.
= -361 кДж; Q = 117 кДж. Если от более нагретого источника теплоты к рабочему телу подвести теплоту q 1, то состояние рабочего тела меняется, происходит расширение по линии 1–с–2. Полезную работу, совершенную в процессе расширения 1–с–2 можно определить площадью 1–с–2–b–а–1.
Если от более нагретого источника теплоты к рабочему телу подвести теплоту q 1, то состояние рабочего тела меняется, происходит расширение по линии 1–с–2. Полезную работу, совершенную в процессе расширения 1–с–2 можно определить площадью 1–с–2–b–а–1.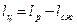 .
.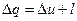 для рассматриваемого кругового цикла
для рассматриваемого кругового цикла 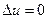 , и поэтому
, и поэтому 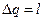 или
или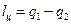 .
.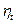 ), под которым понимается отношение работы, полученной в цикле, к затраченной теплоте:
), под которым понимается отношение работы, полученной в цикле, к затраченной теплоте: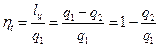 .
. Из диаграммы видно, что работа сжатия больше работы расширения. Работа цикла получается отрицательной. В результате совершения обратного цикла теплота отбирается от источника с низкой температурой и передается к источнику с высокой температурой.
Из диаграммы видно, что работа сжатия больше работы расширения. Работа цикла получается отрицательной. В результате совершения обратного цикла теплота отбирается от источника с низкой температурой и передается к источнику с высокой температурой.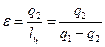 .
.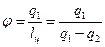 .
.


